Кислоты и кислотные остатки | Решаем химию: вопросы и ответы
При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Фото: istockphoto.comФото: istockphoto.com
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).![]()
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная h4PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная h3S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота h3SO3 – двухосновная (здесь два атома водорода), а фосфорная h4PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте h4PO4 кислотный остаток — PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты h3SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты h3S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия h3S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота h3SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты h4PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Кислотные остатки — Справочник химика 21
Название кислотных остатков [c.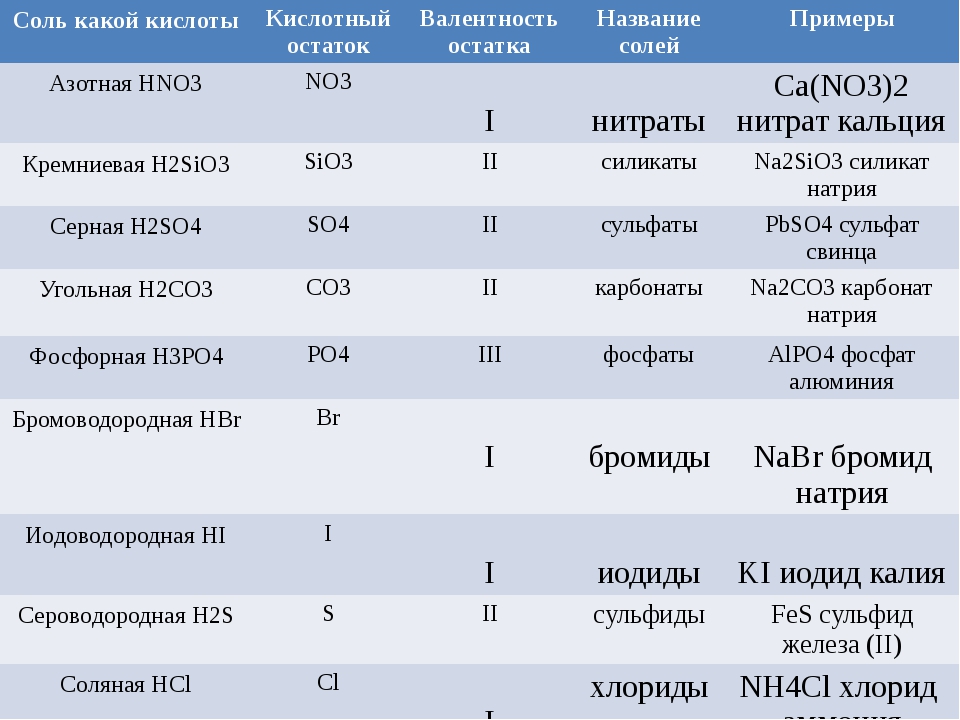 141]
141]Прн частичном замещении гидроксогрупп в молекуле основного гидроксида кислотными остатками образуются основные соли (гидроксосоли). Основные [c.34]
Формула соли Ионы Название кислотного остатка Название металла Валентность (степень окисления) [c.140]
Теперь общеизвестно, что это изменение в свойствах происходит вследствие избирательной адсорбции сернистых, азотистых и кислородсодержащих соединений, а также и полициклических ароматических углеводородов. В настоящее время в промышленности на основе этих свойств используются два процесса — контактный процесс и перколяция. Как показывает название, контактный процесс заключается в контактировании масла и адсорбента в течение определенного времени и при определенной температуре, после чего отделяют адсорбированные нежелательные компоненты. Таким образом, процесс соответствует одноступенчатой фракционировке. Он часто применяется после кислотной очистки для удаления кислотных остатков, нейтрализации и осветления в одно и то же время.
Многоосновная кислота диссоциирует по ступеням, причем отщеплению каждого из ионов водорода соответствует особая константа диссоциации. Если первый ион водорода отрывается от кислотного остатка, несущего только один заряд, то второй ион водорода отрывается от кислотного остатка, несущего уже два заряда и т. д. Для отрыва каждого последующего иона водорода требуется все большая затрата энергии, и константа диссоциации соответственно уменьшается. [c.484]
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н+. Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим [c.244]
Появляется избыток ионов ОН», т. е. среда становится щелочной-Этот случай наиболее характерен для доноров средней силы — для двух- и многозарядных анионов (СО3, РО4, SO3, а также N ), т, е, кислотных остатков слабых и средней силы кислот. Очевидно, чем слабее кислота, тем гидролиз протекает интенсивнее. [c.210]
Очевидно, чем слабее кислота, тем гидролиз протекает интенсивнее. [c.210]
Химическое соединение, диссоциирующее в водном растворе (или в расплаве) на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка (определение Аррениуса). [c.15]
Название солей состоит из названия иона кислотного остатка [c.140]
Понятие о валеитиости распространяется не только на элементы, но и на группы атомов, входящие в состав химических соединениу» и участвующие как одно целое в химических реакциях. В неорганической химии важнейшими из таких групп являются гидроксогруппа ОН, кислотные остатки, группа аммония ЫН4. [c.41]
Кислотность остатка от перегонки…….Отсутствие [c.73]
Поведение ионов — кислотных остатков, входящих в состав комплексного соединения, зависит от того, входят ли данные ионы в состав его внутренней или внешней сферы. В первом случае они называются неионогенно связанными ионами, а во втором — ионогенно связанными. [c.176]
[c.176]
Когда элемент образует несколько рядов соединений, соответствующих различным степеням окисления, после названия соединения в скобках дается указание либо на валентность катиона (римской цифрой), либо на число атомов галогена, кислорода, серы или кислотного остатка в молекуле соединения (прописью). Например, железо хлористое (П1), фосфор хлористый трех), марганца окись (дву). При этом обозначение валентности дается обычно для менее характерных валентных состояний. Например, для меди в случае двухвалентного состояния указание на валентность опускается, одновалентная же медь обозначается так медь иодистая (I). [c.9]
Продукты сульфирования нефти. Смесь, образующаяся в результате сульфирования нефти, состоит из трех сложных по составу веществ, которые условно можно назвать масла, кислый гудрон, кислотный остаток. Основные целевые продукты внутрипластового сульфирования — сульфокислоты — содержатся в кислом гудроне и в меньшей степени в кислотном остатке. Общий выход водорастворимых сульфокислот при благоприятном соотношении вступающих в реакцию нефти и Н25 04 может достигать 300 кг на 1 т кислоты. Оптимальное соотношение обеспечивается при использовании реагента с 80—85 %-ной концентрацией Н25 04.
Общий выход водорастворимых сульфокислот при благоприятном соотношении вступающих в реакцию нефти и Н25 04 может достигать 300 кг на 1 т кислоты. Оптимальное соотношение обеспечивается при использовании реагента с 80—85 %-ной концентрацией Н25 04.
Соли можно рассматрпвать как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или как продукты полного нлн частичного замеш ения гидроксо-групп в молекуле основиого гидроксида кислотными остатками. При полном замещении атомов водорода в молекуле кислоты образуются средние (нормаль ные) соли, при неиолном — кислые соли (гидросоли). Кислые соли образуются многоосиовиыми кислотами. [c.34]
Первый ион водорода отрывается от молекулы легче, последующие все труднее, так как возрастает отрицательный заряд кислотного остатка. Поэтому в не очень разбавленных растворах фосфорной кислоты ионов РО4 мало. Неравенства /(1 > Кг > . характерны и для других многоосновных кислот. Ориентировочно можно считать, что каждая последующая константа ионизации меньше предыдущей приблизительно в 10 раз. [c.252]
Неравенства /(1 > Кг > . характерны и для других многоосновных кислот. Ориентировочно можно считать, что каждая последующая константа ионизации меньше предыдущей приблизительно в 10 раз. [c.252]
При исследовании химического состава солей, растворенных в воде, определяют не количество той или иной соли, а содержание ионов металлов и кислотных остатков так как точно установить, в какие комбинации объединены ионы, невозможно. Поэтому наиболее рациональным методом выражения состава солей, растворенных в пластовой воде, является миллиграмм-эквивалентная и процентно-эквивалентная форма. [c.10]
Для неорганических кислородсодержащих кислот первая, вторая и третья константы ионизации находятся в соотношении примерно равном 1 10 Ю- . Первый ион водорода отрывается от молекулы кислоты легче, а последующие все труднее, так как возрастает отрицательный заряд кислотного остатка. [c.139]
Важным подтверждением правильности представлений Вильямсона явились работы Жерара, открывшего в 1852 г.
Кислоты состоят из водорода, способного замещаться металлом, и кислотного остатка, причем число атомов водорода равно валентности кислотного остатка. Примерами кислот могут служить соляная (хлористоводородная) НС1, серная HoSOi, азотная HNOy, уксусная СНзСООН. [c.41]
Из приведенных уравнений видно, что обмен алкильными и кислотными остатками между различными сложными эфирами протекает аналогично обмену ионов у солей [c.116]
Подобные случаи отнюдь не единичны. Во всех областях химия можно показать, что некоторые атомные группы оказывают на соседние атомы расшатывающее влияние, повышая их реакционную способность. К ним, кроме нитрогруппы, относятся, например, карбоксил —СООН, карбонил >С0, циангруппа — = N, нитрозогруппа —N = О все эти группы представляют собой кислотные остатки и обладают кратными связями.
Подобным образом ведут себя слабые доноры электронных пар — однозарядные анионы (С1″, Вг , Г , N03,0104) к этой же группе анио-1ЮБ относятся ионы SO4, SiFg и другие кислотные остатки сильных кислот. [c.210]
Эти предположения б дальнейшем были развиты в стройную теорию, получившую иазваине теории электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами к ним относятся, например, ионы йодорода и металлов. Отрицательно заряженные ионы называются анионами к ннм принадлежат ионы кислотных остатков и
Орто( )осфорная кислота не принадлежит к числу сильных кислот. Константы ее диссоцпацпи равны Л [=—/(2 == 6 10- , == 10 Будучи трехосновной, она образует три ряда солей средние и кислые с од гим или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют о р -тофос фатами или просто фосфатами, кислые — гидро-фосфатами [c.421]
Средние соли фосфорной кислоты называют о р -тофос фатами или просто фосфатами, кислые — гидро-фосфатами [c.421]
Залозецкий первый выделил из кислотных остатков нафтеновые кислоты, подвергая эти остатки промывке, нейтрализации и отгонке с водяным пароМ. [c.183]
Если элемент образует бескислородную кислоту и кислоты с различным содержанием атомов кислорода, то названия ионов кислотных остатков имеют окончание -ид для безкислородных кислот, -ит -для кислородных кислот с меньшим содержанием кислорода и -ат -для кислородных кислот с большим содержанием кислорода. Сульф й ион — кислотный остаток сероводородной кислоты Сульфми-ион — кислотный остаток сернистой кислоты Сульфа я ион — кислотный остаток серной кислоты Н ЗО . [c.140]
Подобная картина характерна и для других миогоосновных кислот первый ион водорода отрывается от молекулы легче, последующие все труднее, так как возрастает отрицательный заряд кислотного остатка. Поэтому обычно в растворе фосфорной кислоты ионов рС>4 почти нет. [c.182]
Поэтому обычно в растворе фосфорной кислоты ионов рС>4 почти нет. [c.182]
Названия кислотных остатков, связанных неионогенно (т. е. находящихся во внутренней сфере комплекса) и заключаемых при написании формул в квадратные скобки, оканчиваются на о, например, дихлоро, пентаиодо, гексанитро. Кислород обозначается термином оксо, гидроксил — гидроксо. Названия нейтральных молекул — обычные, за исключением аммиака и воды, которые обозначаются соответственно терминами аммин и акво. Кислотные остатки, связанные ионогенно (т. е. находящиеся во внешней сфере комплекса) и помещаемые в формуле вне квадратных скобок, называются следующим образом хлорид, нитрат, сульфат и т. п.
При построении названия комплексной молекулы сначала указываются внутрисферные кислотные остатки, затем внутрисферные нейтральные молекулы, центральный атом и, наконец, ионы внешней сферы. Например [М1(ЫН 1)б]С12 — гексамминникелохлорид [ o(NHз)5 l] l2 — монохлоропентамминкобальтнхлорид [c. 10]
10]
Кислотность остатка от перегонки Содержание меркаптановой серы [c.135]
В зарубежных стандартах на авиабензины имеется показатель кислотность остатка от перегонки , определяемый методом ASTM D 1093. Этот метод основан на том же принципе — извлечении кислот водой. Определение осуществляют по двух вариантам. По первому из них остаток после определения фракционного состава обрабатывают тремя объемами воды, встряхивают 30 с-и водную вытяжку пробуют на содержание кислот добавлением метилового оранжевого. По второму варианту к 50 мл топлива добавляют 15 мл воды и три капли метилового оранжевого, встряхивают 30 с и цен11рифугируют 10 мин (1500 об/мин). О содержании кислот заключают по цвету водного слоя. [c.182]
Силикаты — солеобразные химические соединения, содержащие кремнийкислородные кислотные остатки различного состава (81 0т). Они часто имеют очень сложное строение. Основа всех силикатов — кремнийкислородный тетраэдр [8104], в центре которого расположен атом кремния, а в вершинах — атомы кис. аорода. Тетраэдры [8104] могут сочленяться через вершину, ребро или грань. Число таких сочетаний и пространственное расположение определяет структурный мотив силиката. Во всех случаях атомы кремния связаны друг с другом через атомы кислорода цепочки —81—О—81 — очень прочны. [c.138]
Основа всех силикатов — кремнийкислородный тетраэдр [8104], в центре которого расположен атом кремния, а в вершинах — атомы кис. аорода. Тетраэдры [8104] могут сочленяться через вершину, ребро или грань. Число таких сочетаний и пространственное расположение определяет структурный мотив силиката. Во всех случаях атомы кремния связаны друг с другом через атомы кислорода цепочки —81—О—81 — очень прочны. [c.138]
Нарастание числа ОН-групп при переходе от три- к моноглице риду повышает гидрофильность, что и ускоряет реакцию. Следует отметить, что скорость гидролиза глицеридов зависит не столько от длины цепи кислотного остатка, сколько от числа гидрофильных групп. Реакция значительно ускоряется, если проводить ее в гомогенной фазе (например, в спиртовых растворах). [c.532]
Помогите с заполнением таблицы) Химия, 8 класс, параграф 32, 1 вопрос. Рудзитис и Фельдман
Я в столбик напишу тебе, сама в табличку впишешь
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла.
Кислоты кислородосодержащие
ΗΝO3 — кислотный остаток NO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Н3РO4 — кислотный остаток РO4 — валентность III
H2SO3 — кислотный остаток SO3 — валентность II
HNO2 — кислотный остаток NO2 — валентность I
Н2СO3 — кислотный остаток СO3 — валентность II
НВO3 — кислотный остаток ВO3 — валентность I
H3AsO4 — кислотный остаток AsО4 — валентность III
Кислоты бескислородные
НСl — кислотный остаток Сl — валентность I
H2S — кислотный остаток S — валентность II
HF — кислотный остаток F — валентность I
HI — I — валентность I
НВr — кислотный остаток Вr — валентность I
НСl — кислотный остаток Сl — валентность I
HF — кислотный остаток F — валентность I
HI — кислотный остаток I — валентность I
НВг — кислотный остаток Вr — валентность I
ΗΝO3 — кислотный остаток NO3 — валентность1
HNO2 — кислотный остаток NO2 — валентность I
НВO3 — кислотный остаток ВO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Кислоты двухосновные
H2SO3 — кислотный остаток SO3 — валентность II
Н2СO3 — кислотный остаток СO3 — валентность II
H2S — кислотный остаток S — валентность II
Кислоты трехосновные
Н3РO4 — кислотный остаток РO4 — валентность III
H3AsO4 — кислотный остаток AsO4 — валентность III
Урок по теме «Кислоты»
Муниципальное
бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 56»», г.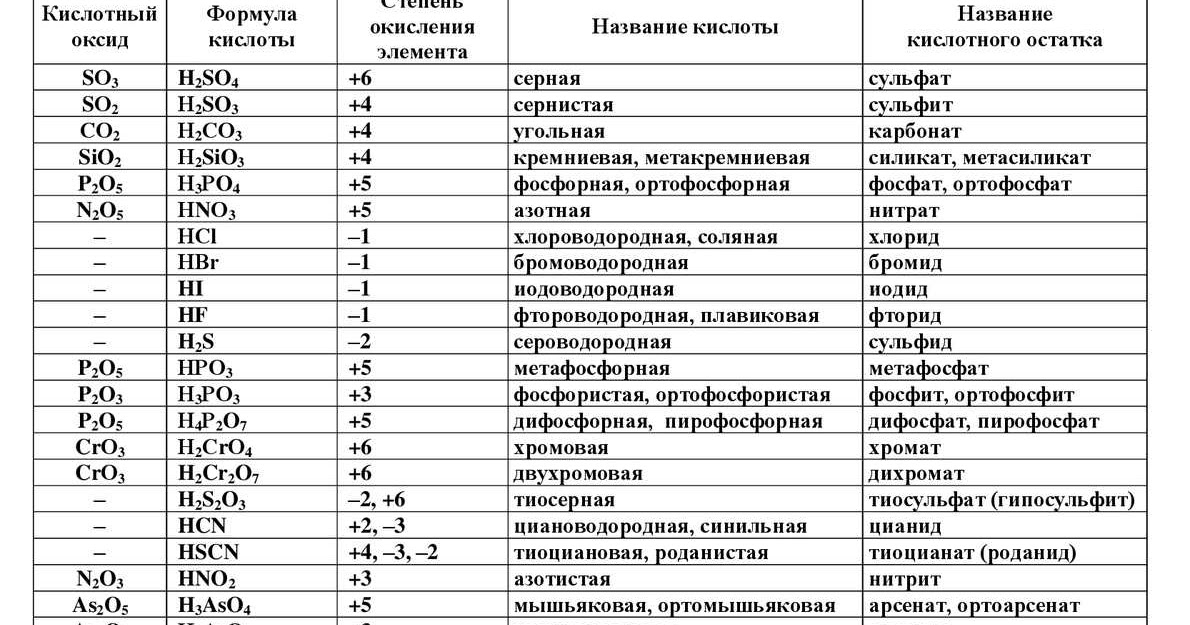 Грозного
Грозного
Тема урока: «Кислоты»
8 класс
Учитель химии
Тутаева Айна Алаудиновна
Тема урока
«Кислоты»
Цели урока:
Образовательные:
Сформировать понятие о кислотах.
Рассмотреть состав, название, классификацию кислот.
Познакомить учащихся с представителями неорганических кислот.
Изучить химические свойства кислот
Продолжить формирование знаний о различных зарядах ионов и степени окисления элементов.
Развивающие:
Развивать практические навыки
Учить анализировать полученную информацию
Развивать логическое мышление путем сравнения, обобщения, систематизации
Учить выделять причинно-следственные связи
Воспитательные
Развивать интерес к предмету
Развивать взаимосвязь между предметами
Развивать знания о применении химии в быту
Учить аккуратности при выполнении химических опытов
Оборудование:
мультимедийная презентация (ПК, проектор)
штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов
Реактивы:
Индикаторы: лакмус, метилоранж, фенолфталеин
Кислоты: соляная и серная
Металлы: цинк, железо, медь.

Оксид меди (II)
Гидроксид натрия
Соли: сульфат меди (II), хлорид бария, карбонат кальция
План урока:
1.Организационный момент (1-2 мин.)
2. Проверка домашнего задания (6 мин.)
3.Актуализация знаний учащихся (3 мин.)
4. Изучение нового материала (24 мин.)
5. Закрепление (6 мин.)
6. Подведение итогов урока, домашнее задание (2 мин.)
7. Рефлексия (2 мин.)
Ход урока
Организационный момент
Проверка домашнего задания
2.1. 2 ученика выполняют домашнее задание у доски
2.2. Работа с тренажерами
2. 3. Актуализация опорных знаний (работа с классом)
3. Актуализация опорных знаний (работа с классом)
? Вспомните как классифицируют неорганические соединения? ( На оксиды, основания, кислоты и соли).
? Назовите какие из них мы с вами уже изучили. (Оксиды и основания).
ПОКАЗЫВАЮ 2-3 карточки с формулами оксидов.
? Какой класс неорганических соединений я вам показываю? (Оксиды).
? На основании чего вы сделали такой вывод? (Дают определение оксидам).
? Прочитайте и назовите каждый оксид.
ПОКАЗЫВАЮ 2-3 карточки с основаниями.
? Формулы каких веществ я показываю сейчас? (Оснований).
? Почему эти вещества относятся к основаниям? (Дают определение оснований).
? Прочитайте и дайте названия этим основаниям.
Актуализация знаний учащихся:
Учитель: В этом учебном году вы приступили к изучению новой для вас науки.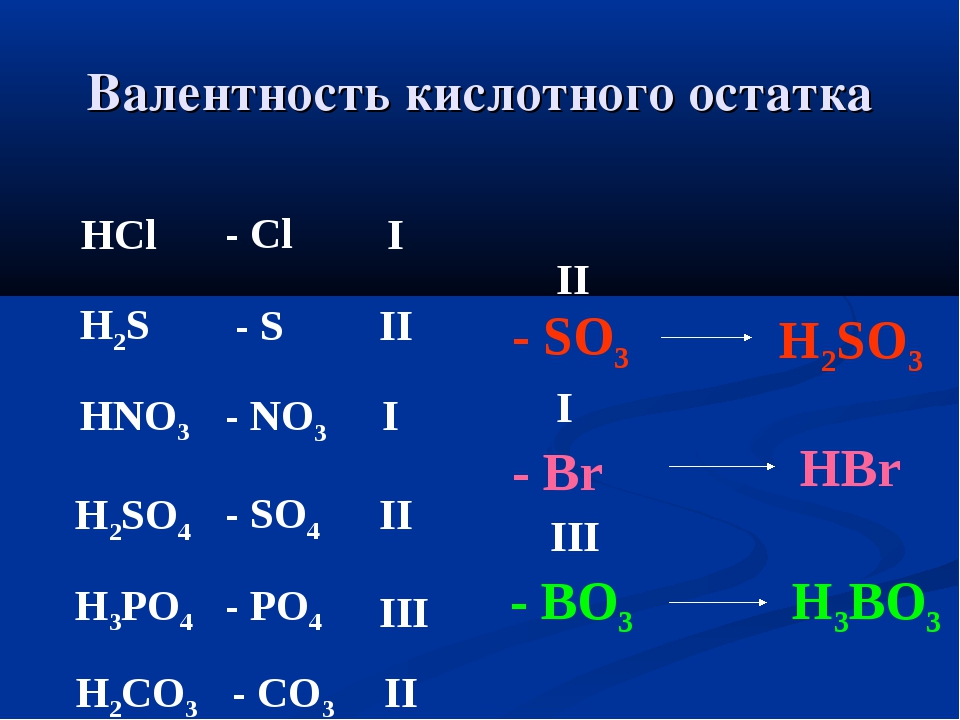 Как известно, химия – наука о веществах. Какие классы веществ вам известны?
Как известно, химия – наука о веществах. Какие классы веществ вам известны?
Слайд 1: (металлы, неметаллы, оксиды, основания, кислоты, соли).
Учитель: Мы продолжаем изучать классификацию неорганических веществ. Сегодня нам с вами предстоит знакомство с еще одним классом, но с каким именно вы узнаете, правильно выполнив следующее задание:
Слайд 2: Определите тип каждой из реакций, уравнения которых записаны в таблице. Из букв правильных ответов мы и определим название класса веществ – слайд 3.
Слайд 4 – тема урока.
Слайд 5 – цели урока.
Сформировать понятие о кислотах.
Рассмотреть состав, название, классификацию кислот.
Познакомиться с представителями неорганических кислот.
Изучить химические свойства кислот.

Изучение нового материала
Учитель: С понятием кислоты вы встречались неоднократно в бытовой жизни. Какие кислоты вам известны? Где встречаются эти кислоты?
Учащиеся: варианты ответов – на кухне, в аптечке, автомобиль и т.д.; уксусная, аскорбиновая, серная и т.д.
4.1. Кислоты вокруг нас
Учитель: Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота, которая получается из оксидов азота, образующихся при горении воздуха вокруг плазменного шнура молнии, при работе реактивных двигателей самолетов (ракет) и под воздействием солнечной радиации. Ежегодно с дождями на землю выпадает примерно 100 млн т азотной кислоты. Это немало. Извержение вулканов и сгорания топлива способствуют появлению в дождевой и снеговой воде серной кислоты. Слайд 6.
Ежегодно с дождями на землю выпадает примерно 100 млн т азотной кислоты. Это немало. Извержение вулканов и сгорания топлива способствуют появлению в дождевой и снеговой воде серной кислоты. Слайд 6.
Учитель: Если вы присядете вблизи муравейника, то надолго запомните жгучие укусы его обитателей. Муравей впрыскивает в ранку от укуса яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты. Слайд 7.
Учитель: «Химическое оружие» используется в природе весьма широко. Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться. Слайд 8.
Самая значительная функция кислот в природе состоит в разрушении горных пород и образовании почвы – слайд 9.
Важна роль кислот и в человеческом организме: аскорбиновая кислота – поставщик витамина С, фолиевая кислота – витамин В9, аминокислоты образуют множество белков, соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу, ацетилсалициловая кислота – жаропонижающее средство, молочная кислота образуется в мышцах при физической нагрузке. Олеиновая кислота – это одна из самых полезнейших жирных кислот, без которых нормальный обменный процесс в человеческом организме осуществляться не будет. Гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр. Таким образом, мы видим, что наше самочувствие в значительной степени связано с деятельностью кислот – слайд 10.
Олеиновая кислота – это одна из самых полезнейших жирных кислот, без которых нормальный обменный процесс в человеческом организме осуществляться не будет. Гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр. Таким образом, мы видим, что наше самочувствие в значительной степени связано с деятельностью кислот – слайд 10.
4.2. Определение кислот
Учитель: Ребята, а что же собой представляют кислоты с точки зрения химических соединений? Чтобы ответить на этот вопрос давайте запишем формулы и названия некоторых кислот – слайд 11.
Скажите, пожалуйста, что общего у всех кислот?
Учащиеся: Наличие водорода
Учитель: Совершенно верно. Давайте запишем определение кислот – слайд 12 — 13.
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
4.3. Первичное закрепление материала – слайды 14 – 16.
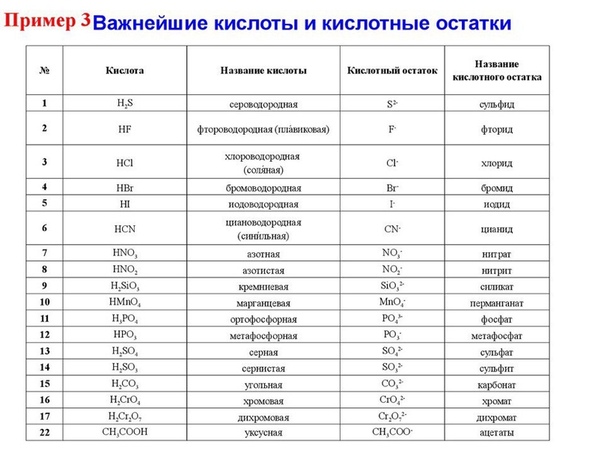
Задание 1. Подчеркните кислотный остаток в молекулах кислот: H2SO4; H2CO3; HNO3; H2SiO3; H3PO4– слайд 14.
Задание 2. Определите валентность кислотных остатков в молекулах кислот: H2SO4; H2CO3; HNO3; H2SiO3; H3PO4– слайд 15.
Задание 3. Составьте формулы кислот по известным кислотным остаткам: Cl (I), S(II), PO4(III), SiO2(II), ClO4(I), MnO4(II), NO2(II) – слайд 16.
4.4. Классификация кислот
Учитель: Ребята, посмотрите на слайд и скажите, по какому признаку данные кислоты разделены на две группы? Слайд 17.
Учащиеся: Наличие и отсутствие кислорода.
Учитель: Записываем в тетрадь (схематично) – «Классификация кислот».
По составу кислоты делятся на кислородсодержащие и бескислородные – слайд 18.
Учитель: По какому признаку данные кислоты разделены на две группы? Слайд 19.
Учащиеся: Число атомов водорода.
Учитель: Записываем в тетрадь (схематично):
По числу атомов водорода делятся на одно-, двух- и трехосновные – слайд 20.
Учитель: Кроме этого, кислоты классифицируют еще по растворимости в воде и по силе. Слайд 21.
4.5. Общие химические свойства кислот
Учитель: А теперь мы с вами рассмотрим общие химические свойства кислот. Но прежде мы должны познакомиться с техникой безопасности при работе с кислотами. Повторим: выполнять все указания учителя, не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать, обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды, обработать 2% раствором гидрокарбонатом натрия.
Но прежде мы должны познакомиться с техникой безопасности при работе с кислотами. Повторим: выполнять все указания учителя, не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать, обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды, обработать 2% раствором гидрокарбонатом натрия.
Учитель проводит демонстрационный опыт растворения в воде концентрированной H2S04, наблюдается сильное разогревание пробирки. Фиксирует внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, оказывается на поверхности, закипает, и ее брызги вместе с кислотой могут обжечь лицо и руки.
Запомни: Сначала — вода, Затем — кислота — Иначе случится беда!
Учитель: Одним из общих химических свойств кислот является действие их на индикаторы. Что такое индикаторы?
Что такое индикаторы?
Учащиеся: Вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной.
Учитель: Какие индикаторы вам известны?
Учащиеся: Лакмус, метилоранж, фенолфталеин.
Учитель: Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с разными кислотами и цветами разных растений. Оказалось, что и васильки, и роза, и цветки некоторых других растений изменяли свою окраску при действии кислот.
Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворах кислот он становился красным, а в растворах щелочей — синим.
После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований.
Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований.
Учитель: Посмотрим демонстрационный опыт: в трех химических стаканах находится соляная кислота. Прильем в стаканы индикаторы. Как изменилась окраска растворов? Слайд 22.
Учащиеся: При добавлении лакмуса и метилоранжа растворы приобрели красную окраску, в случае фенолфталеина видимых изменений не было.
Учитель: Какой вывод можно сделать?
Учащиеся: Кислоты можно обнаружить только с помощью лакмуса и фенолфталеина.
Учитель: Второе свойство кислот – взаимодействие с основаниями. Слайд 22.
Демонстрация опыта, комментарии по слайду.
Учитель: Третье свойство кислот – взаимодействие с оксидами металлов. Слайд 23. Демонстрация опыта, комментарии по слайду.
Слайд 23. Демонстрация опыта, комментарии по слайду.
Учитель: Следующее свойство кислот, которое мы с вами рассмотрим, – взаимодействие с металлами. Слайд 23. Демонстрация опыта, комментарии по слайду.
Учитель: И последнее свойство, которое мы с вами рассмотрим – это взаимодействие кислот с солями. Слайд 24. Демонстрация опыта, комментарии по слайду.
Учитель: И в заключении давайте рассмотрим некоторые интересные факты о теперь уже известных вам кислотах.
Серная кислота тяжелая маслянистая жидкость, издавна её называют “матерью всех кислот”. Алхимикам удалось получить серную кислоту еще в X веке при прокаливании солей — сульфатов (купоросов). Отсюда произошло историческое название серной кислоты – купоросное масло. Серная кислота очень широко используется при проведении различных химических производств, поэтому ее часто называют “хлебом химической промышленности”.
 Слайд 25.
Слайд 25.HNO3 – азотная кислота – Бесцветная летучая жидкость с резким запахом, дымит на воздухе, сильный окислитель. Азотная кислота применяется для производства взрывчатых веществ, красителей, лаков, лекарств, полимеров, удобрений. Её называют “царицей всех кислот”.
HF – Фтороводородная кислота (плавиковая). Плавиковая кислота обладает особыми свойствами: она легко реагирует со стеклом и химически растворяет его, поэтому хранить кислоту приходится не в стеклянной посуде, а в полиэтиленовой.
Уксусная кислота – СН3СООН – самая древняя. Упоминания о ней содержатся в древнейших рукописях. Впервые она получена из виноградного сока. Уксусная кислота широко используется в химическом производстве, а также в быту, в частности, для консервирования продуктов.
Все кислоты кислые на вкус. (Салициловая — сладкая, никотиновая — горькая.
 ).
).
Итоговое закрепление – слайды 26 – 27.
Найди группу формул кислот:
а) NH3
HC
H2 SO4
б) H2S
HNO3
HBr
в) HCl
KCl
H3PO4
Выберите формулу «третьего лишнего» вещества в каждом ряду:
а) HCl
H2SO4
K2O
б) HNO3
H2O
H2CO3
в) H2S
H2SO4
NaOH
Даны вещества.
 Расположите их в таком порядке, чтобы внизу получилось название индикатора.
Расположите их в таком порядке, чтобы внизу получилось название индикатора.
Подведение итогов урока, домашние задание:
Рефлексия
Сегодня на уроке я:
☼ Научился…
☼ Мне показалось важным…
☼ Я понял, что…
☼ Я почувствовал, что…
Своей работой на уроке я:
♦ Доволен…
♦ Не совсем доволен…
♦ Я не доволен, потому что…
Список литературы
Рудзитис Г.Е. Химия. 8 класс: учеб. для общеобразоват. учреждений /Г.Е. Рудзитис, Ф.Г. Фельдман. – 13-е изд. — М.: Просвещение, 2009.
Настольная книга учителя химии / авт.-сост. Н.Н. Гара, Р.Г. Иванова, А.
 А. Каверина. – М.АСТ,2002. – 190 с.
А. Каверина. – М.АСТ,2002. – 190 с.Обучение химии в 8 классе: метод. Пособие / Т.А. Боровских. – М.: АСТ, 2002. – 237 с. Ил. – (Библиотека учителя химии)
Урок «Кислоты» химия 8 класс ГабриелянО.С.
Тема урока «Кислоты»
Описание материала: Этот урок является первым вводным уроком в теме.
Цель урока: Сформировать комплекс знаний у учащихся о кислотах как классе неорганических веществ.
Задачи:
1. Образовательные:
Изучить строение, свойства, классификацию, нахождение в природе, области применения кислот.
2. Воспитательные:
воспитать активную жизненную позицию;
продолжать формировать научно-материалистическое мировоззрение: познаваемость окружающего мира, необходимость соблюдения правил техники безопасности при работе с кислотами, культуру выполнения химического эксперимента.
3. Развивающие:
Стимулировать обучающихся к целеполаганию, планированию деятельности, проведению эксперимента, наблюдению, анализу индивидуальных достижений, умению делать выводы, умению слушать и слышать другого человека;
Обеспечить формирование познавательных, коммуникативных, регулятивных универсальных учебных действий обучающихся;
Использовать возможности ИКТ, Интернет-ресурсов и других
информационных источников при выполнении домашних заданий и представлении
результатов.
Тип урока: урок усвоения новых знаний
Планируемый результат:
Знать определение, состав кислот и их классификацию;
Знать правила техники безопасности при работе с кислотами;
Знать важнейшие неорганические кислоты;
Уметь определять валентность кислотного остатка и составлять формулы кислот;
Уметь распознавать кислоты с помощью индикаторов;
Уметь использовать возможности ИКТ, Интернет-ресурсов и других информационных источников для выполнения домашних заданий и представления результатов.
Основные понятия:
Кислоты ;
Кислотный остаток;
Систематическая (IUPAC) и историческая номенклатура неорганических кислот;
Индикаторы.
Межпредметные связи: Биология, математика.
Ресурсы:
Основные:
Химия. 8 класс: учебник для общеобразовательных учреждений/ О.С.Габриелян.-М.:Дрофа, 2011.
Химия. Вопросы, задачи,
упражнения. 8-9 кл.:учебное пособие для общеобразовательных
учреждений/Л.С.Гузей, Р.П.Суровцева.-2-е изд., стереотип. -М.:Дрофа, 2002.-288
с.
8-9 кл.:учебное пособие для общеобразовательных
учреждений/Л.С.Гузей, Р.П.Суровцева.-2-е изд., стереотип. -М.:Дрофа, 2002.-288
с.
Дополнительные: Библиотекарь (электронная библиотека) http://bibliotekar.ru/
Фестиваль педагогических идей. Открытый урок. http://festival.1september.ru/
Учительский портал http://www.uchportal.ru/
Социальная сеть работников образования http://nsportal.ru/
Сеть творческих учителей/химоза http://www.it-n.ru/
Организация пространства: Работа фронтальная, индивидуальная (работа с тестами, подготовка докладов), парная (проведение эксперимента, взаимопроверка, взаимопомощь).
Виды учебной деятельности обучающихся:
Коммуникативные УУД: — обеспечение возможности сотрудничества: умение слышать, слушать и понимать партнера, оказывать поддержку друг другу и эффективно сотрудничать как с учителем, так и со сверстниками, построение речевых высказываний, работа с информацией, построение вопросов;
Личностные УУД: готовность и способность обучающихся к саморазвитию, мотивации к обучению и познанию, самоопределение, ценностно — смысловые установки обучающихся, отражающие их индивидуально-личностные позиции, социальные компетенции, личностные качества;
Регулятивные УУД – целеполагание, самоконтроль, самооценка;
Познавательные УУД –
общие учебные действия, подготовка и решение практических задач, овладение
межпредметными понятиями, расширение опыта специфического для предметной
области (химии), деятельности по получению нового знания, его преобразованию и
применению, а также систему основополагающих элементов научного знания, лежащих
в основе современной научной картины мира.
Приемы и средства обучения: Опора на знания обучающихся, использование алгоритмов, сравнение и анализ, компьютер, мультимедийный проектор, слайды, выполненные в программе Microsoft Power Point, электронное мультимедийное приложениек учебнику изд. «Дрофа».
Оборудование и реактивы:
На столах учащихся:
периодическая таблица, таблица растворимости, штатив с пробирками, раствор соляной кислоты, раствор гидроксида натрия, в чашечках Петри дольки лимона, яблока, мандарина; индикаторы: фенолфталеин, лакмус, метилоранж, универсальный; стеклянные палочки, карточки для самостоятельной работы.
На столе учителя: Канапе из фруктов и овощей, раствор серной кислоты, вода, индикаторы, штатив с пробирками, компьютер.
В классе:
таблица растворимости, периодическая таблица Менделеева
Ход урока
“Ум заключается не только в знании, но и в умении прилагать знание на деле”. (Аристотель)
I. Организационный момент.
Организационный момент.
Приветствие.
Фиксация отсутствующих.
Проверка готовности учащихся к уроку.
Организация внимания.
II. Мотивация.
Начинается наш урок, эпиграф к которому звучит так: “Ум заключается не только в знании, но и в умении прилагать знание на деле”. (Аристотель).
III. Актуализация знаний.
Слайд№ 1
Сегодня на занятии мы продолжим изучать многообразие мира неорганических веществ. Но для начала давайте вспомним:
Какие классы неорганических веществ вы изучили? (оксиды, гидриды, основания)
Слайд№ 2
Из перечисленных классов уделим внимание оксидам: Какие вещества (соединения) называются оксидами? (Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород.)
Учитель: Скажите, а какие вещества называются основаниями?( Основания – это сложные вещества, состоящие из ионов металлов и гидроксидионов)
От чего зависит количество гидроксильных групп в основании? ( Количество гидроксильных групп зависит от валентности (С. О.) металла,
входящего в состав основания)
О.) металла,
входящего в состав основания)
Слайд№ 3
Поработаем с карточками: из предложенного списка веществ
выпишите оксиды и щёлочи.
А теперь проведем взаимопроверку: отметьте количество правильных и неправильных ответов.
Слайд№ 4(правильные ответы)
Оксиды: CaO, CI2O7, CO2 , AL2O3, K2O, N2O5, SO3.
Щёлочи: , NaOH, LiOH, КОН
Учитель: Прекрасно! Сегодня мы продолжим изучение веществ. А вот каких именно?
IV. Вводная информация учителя и формулировка цели урока.
Как говорится в пословице: «Как потопаешь, так и полопаешь!» За окном холодно, и я решила угостить вас витаминами! Вы любите фрукты?
Ребята, а можно пробовать на вкус вещества в лаборатории? (Правила по технике безопасности). Ученик: НЕЛЬЗЯ!!!!
Учитель: Эти угощения вы заберете с собой после урока
— А как вы думаете, что объединяет содержимое корзины?
Учитель:
Угощенья не спроста,
На вкус всё кислое слегка-
Лимончик, киви, апельсин
И яблочко и мандарин!
Знаешь ты, и знаю я,
Знают даже бегемоты-
Содержат вкусности- КИСЛОТЫ (учащиеся хором отвечают)
Слайд№ 5
Учитель: И так, тема нашего урока: «Кислоты» (Учитель предлагает ученикам
самостоятельно сформулировать тему урока и записать тему в тетрадь).
— Что вы знаете о кислотах?……..
— А еще что хотели бы узнать?……….
Слайд№ 6
Учитель: И так, задачи нашего урока:
— изучить строение и свойства кислот;
— познакомиться с классификацией кислот;
— узнать формулы некоторых неорганических кислот;
— познакомиться с правилами техники безопасности при работе с кислотами;
— научиться распознавать кислоты среди других соединений;
— научиться определять заряды ионов кислотных остатков.
Учитель: у вас на столах лежат карточки «Знаем, Хотим узнать, Узнали» и я предлагаю заполнить первые две колонки, исходя из задач нашего урока.
V. Первичное усвоение новых знаний
Учитель: Наверняка, когда мы произносим слово кислота, то сразу представляем некое
опасное вещество, к которому возникает негативное чувство. Многие думают, что
кислоты скорее наши враги, чем друзья и считают, что кислоты получают только
синтетическим путём. На самом деле это не так. И именно органические кислоты
позволяют нам убедиться в обратном. Некоторые продукты, которые мы употребляем
в пищу содержат органические кислоты. Как вы думаете, какие продукты содержат
кислоты?
На самом деле это не так. И именно органические кислоты
позволяют нам убедиться в обратном. Некоторые продукты, которые мы употребляем
в пищу содержат органические кислоты. Как вы думаете, какие продукты содержат
кислоты?
Слайд№ 7
В щавеле содержится щавелевая кислота , в яблоках — яблочная кислота ,
в лимоне — лимонная кислота.
Слайд№ 8
При физических нагрузках в организме человека вырабатывается молочная кислота, соляная кислота входит в состав желудочного сока и создает барьер для микробов, а также создает благоприятную среду для работы пищеварительного фермента. Кислоты нашли широкое применение в медицине, народном хозяйстве, кулинарии.
Слайд№ 9
Но не всегда они приносят пользу. Кислотные дожди – одна из экологических проблем нашей планеты.
Сегодня на уроке мы уделим внимание неорганическим кислотам.
Состав кислот. Слайд№10
Учитель: Посмотрите на экран, здесь даны формулы кислот. Что между ними общего?
Что между ними общего?
Ученики: В формулах всех веществ есть атомы водорода.
Первый элемент слева в формуле – водород (Н), справа- кислотный остаток.
Учитель: Исходя из состава, дайте определение понятию – кислота.
Ученики: Кислоты — это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Прочитайте определение на экране, в учебнике на странице 120.
Распознавание кислот
Учитель: Как распознать кислоты? Просмотр эксперимента (ЭОР №1 )
«Изменение окраски индикаторов в кислотах». Учащиеся заполняют таблицу.
Учитель: у вас на столах лежат незаконченные таблички «Окраски индикаторов в определенной среде». Предлагаю заполнить пустые графы.
Эксперимент
Учитель: А теперь проведем эксперимент: образуем группы, объединяясь по 2 парты.
Перед вами лимон, апельсин, яблоко и лакмус. Капнем по 1 капле индикатора на
предложенные вещества. Что произошло?
Что произошло?
Слайд№ 11
Учащиеся делают вывод: Независимо от вида кислоты, индикаторы изменяют свой цвет одинаково, а это означает, что все кислоты обладают сходными свойствами.
Слайд№ 12
Прочитайте названия и формулы кислот на экране (дети читают вслух, учитель раздаёт детям готовые мини-таблички с основными неорганическими кислотами и их названиями . Таблички можно вклеить)
Классификация кислот
Слайд№ 13
Учитель: Обратите внимание на формулы кислот. Рассмотрите их и ответьте на вопрос: как можно разделить кислоты по составу? Что является на ваш взгляд основой? Обратите внимание на то, сколько атомов водорода может быть в кислоте .
Ответ учащихся : Основой является водород:
по числу атомов водорода кислоты можно разделить на
1.одноосновные (HCl, HNO3)
2. двухосновные (H2S, H2SO4, H2CO3)
3. трехосновные(H3PO4)
трехосновные(H3PO4)
Учитель: запишем в тетрадь в виде схемы:
Кислоты
одноосновные двухосновные трехосновные
(HCl, HNO3) (H2S, H2SO4, H2CO3) (H3PO4)
Слайд№ 14
Учитель:
Какой второй признак классификации кислот вы бы выделили?
Учащиеся: по наличию атомов кислорода. Состав кислотных остатков различен: в одни входит кислород, в другие не входит
Учитель: продолжаем нашу схему
Бескислородные (HCI,HF) кислородсодержащие (H2SO4, H2CO3)
Слайд№ 15
Учитель: третий признак:
по растворимости (по таблице растворимости определяются кислоты растворимые в воде и нерастворимые)
нерастворимая кислота — кремниевая H2SiO3
Учитель: Ребята, а как вы думаете, кислоты – опасные вещества?
Слайд№ 16
Сегодня мы познакомимся с некоторыми кислотами. И так, серная
кислота.
И так, серная
кислота.
ЭОР №2,3
Учитель: Правила техники безопасности при смешивании серной кислоты с водой.
Учащиеся: нужно приливать кислоту к воде, потому что при смешивании происходит резкое повышение температуры и кислоту может выбросить из пробирки.
Сначала вода,
затем кислота
иначе случится беда!
Учитель: А что же делать, если кислота все же попала на кожу?
(Актуализация знаний)
Учащиеся вспоминают как нужно вести себя, если щелочь попала на кожу. ЭОР№4
Учащиеся делают выводы о правилах обращения с кислотами и мерами безопасности.
Учитель: Есть особые кислоты….. одна из таких Н2СО3
ЭОР №5
Просмотр видеофрагмента:
Учащиеся делают вывод о том, что в свободном состоянии угольная кислота не существует, с помощью учителя записывают уравнения:
H2CO3=CO2↑ + H2O
H2SO3= SO2↑ +H2O
Слайд№ 17
ФИЗКУЛЬТМИНУТКА
Продолжаем наш урок, чтобы он пошёл вам впрок — мы немного отдохнем:
Очень химию мы любим!
Шеей влево, вправо крутим.
Воздух – это атмосфера.
Если правда — топай смело!
В атмосфере есть азот,
Делай вправо поворот!
Так же есть и кислород,
Делай влево поворот.
Воздух обладает массой.
Мы потопаем по классу!
К учителю повернемся
И дружно улыбнемся!
Определение степени окисления элементов, входящих в состав кислот и зарядов ионов
Учитель: немного отдохнули, а сейчас давайте вспомним, что такое «Степень окисления»?
Слайд№18
Слайд№19
По формулам кислот можно определять степени окисления атомов химических элементов, образующих кислоты.
Рассмотрим бинарные кислоты
+1 -1 +1 -2
HCl и H2S
Рассчитаем степени окисления элементов в фосфорной кислоте.
+1 x -2
H3РO4
Составим уравнение:
(+1)∙3+х+(-2)∙4=0 , где х- степень окисления фосфора; х=5
Работа на доске:
Составим оксиды соответствующих кислот:
+1 +5 -2 +5 -2 +1 +6 -2 +6 -2
HNO3 — N2O5 H2SO4 – SO3
Когда мы давали определение кислотам, то говорили, что они состоят
из атомов водорода и кислотного остатка. Так вот, кислотный остаток имеет свой
заряд, который определяется по основности кислоты.
Так вот, кислотный остаток имеет свой
заряд, который определяется по основности кислоты.
Например,
1+ 1- 1 + 2-
HNO3 H 2SO4
Все заряды кислотных остатков указаны в таблице растворимости.
VI. Первичная проверка понимания (работа на доске):
Слайд№20
Поработаем в парах:
Дайте характеристику кислотам по алгоритму:
1. Название кислоты
2. Наличие кислорода
3. Основность
4. Растворимость
5. Степень окисления элементов, образующих кислоту
6. Заряд иона, образуемого кислотным остатком
7. Соответствующий оксид
Учащиеся выбирают для характеристики любую кислоту
VII. Первичное закрепление
Слайд№21
Учитель: На экране вы видите формулы кислотных оксидов. Составьте формулы соответствующих им кислот и запишите в тетрадь.
Учащиеся составляют формулы кислот в тетради
(Слайд №22) — Самопроверка, выставление отметки.
Если осталось время, упр. 3 стр.126
VIII. Домашнее задание:
Слайд№23
1. Выучить формулы и названия кислот
2. § 21;
3. Дать характеристику кремниевой кислоте по алгоритму ;
4. стр.126 упр. 4 (а).
IX.Рефлексия.
Слайд№24
А теперь вернемся к нашим табличкам и заполним последнюю колонку.
Оцените свою работу на уроке…..
Выставление оценок за урок, аргументация учителя.
Кислоты
Содержание:
Кислоты
- Кислота В предыдущем разделе мы уже сталкивались с соляной кислотой HCl, серной кислотой h3S04 и соляной кислотой НР03.Там очень много кислоты. Но все они имеют общие черты. Их молекулы состоят из атомов водорода (которые могут быть заменены металлами) и кислоты residues.
- So например, в молекуле серной кислоты h3S04 атом водорода легко заменяется атомом цинка, а атом цинка соединяется с двухвалентной кислотой Остальная часть этого сформирует соль ZnS04: I p и Zn + h3S04 ZnS04 + h3t В молекуле ортофосфорной кислоты h4P04 атом водорода замещается атомом кальция, который связывается с остатком трехвалентной кислоты^ P04.
 У меня есть ш и ЗСа + 2н3р04 — > — СА3 (P04) 2-ф — 3h3t
У меня есть ш и ЗСа + 2н3р04 — > — СА3 (P04) 2-ф — 3h3t
Валентность кислотных остатков определяется числом атомов водорода, которые могут быть заменены на metals. Людмила Фирмаль
So, кислота может быть определена как: Кислота представляет собой сложное вещество, состоящее из атомов водорода и остатков кислоты, которые могут быть обменены или обменены с атомами металла Классификация кислот. В зависимости от состава кислоту делят на кислородсодержащую и бескислородную, в зависимости от количества атомов водорода-одноосновную, двухосновную, трехосновную( МА15 > — схема 15 Химическая формула, структурная формула 2 и название кислоты.
В таблице 10 приведены химическая формула и названия наиболее важных кислот. При составлении структурной формулы бескислородной кислоты, следует отметить, что в молекулах этих кислот, атомы водорода непосредственно присоединен к соответствующему неметаллических атом-Нсl. При составлении структурной формулы кислородсодержащих кислот, следует отметить, что водород является центральным атомом 1.
Более полное определение кислоты в терминах теории электролитической диссоциации приведено на стр. 9 п. 2 большинство кислот имеют молекулярную структуру, поэтому следует использовать термин «структурная формула». Таблица 10.
Формулы некоторых кислот и кислотных остатков Формула кислоты Никто Кислотный остаток Соляная кислота соляная кислота серная кислота кремниевая кислота фосфорная кислота НС1-КИ Разработка плана,-с бортовым номером 03 hno2 с-nо2 н2ѕо4 = сц4 h3CO3-CO3 HjSiO, Si03 Ч, по4 = по4 Атомы кислорода занимают. Например, если вам нужно создать структурную формулу для серной и фосфорной кислот: 1.1. под остальными атомами водорода данной кислоты запишите один.
Затем, через атом кислорода с помощью черточки, мы связываем их с центральным атомом. Нет Н-Очь \ ДЧ-О-П / Н-О ’ Да. 2.Оставшиеся атомы кислорода связываются с центральным атомом (с учетом его валентности): Ч-С) О Ч-О. НЕТ-П-0 н / д / нет В ответ на вопрос: «выполните упражнения 1 и 2(стр. 80).Задача I и 2 (стр. 80). Схема 16 показывает популярный способ получения кислоты. Образец 16 Первые 2 способа(стр. 59 и 54).Далее мы поговорим о 3-м способе получения кислот.
80).Задача I и 2 (стр. 80). Схема 16 показывает популярный способ получения кислоты. Образец 16 Первые 2 способа(стр. 59 и 54).Далее мы поговорим о 3-м способе получения кислот.
Небольшое количество высушенного хлорида натрия помещают в пробирку (рис.45), наливают на нее концентрированную серную кислоту и закрывают пробку пробкой с газоотводной трубкой. Опустите конец трубки в другую трубку. Затем тщательно нагрейте смесь хлорида натрия и концентрированной серной кислоты acid. In в этом случае выделяется бесцветный газ, который испускает дым в воздухе. air.
It представляет собой хлористый водород, который также образуется при сгорании водорода в хлоре(стр. 54). Когда трубка полна. 45.Получение хлористого водорода. Закрыт газом, пробка、 С закрытым концом опустите его в воду и снимите пробку. Хлористый водород хорошо растворяется в воде, поэтому вся трубка заполнена водой. water. In в полученный раствор добавляют фиолетовую лакмусовую бумажку, которая получается red.
As в результате при растворении хлористого водорода в воде образуется соляная кислота. Реакция отражается в следующем уравнении: Na2S04 + 2 HCI t + h3iso4 Назик. В этой реакции взаимодействуют 2 сложных вещества, компоненты которых обмениваются местами. Это обменная реакция. Обменная реакция называется реакцией между 2 комплексными веществами, в которой компоненты обмениваются местами.
Реакция нейтрализации (стр. 73) является частным случаем обменных реакций. В следующих случаях обменная реакция будет последней (то есть фактически жизнеспособной). 1) если 1 из образованного вещества является volatile. So например, выделяется хлористый водород, газообразное вещество, поэтому обменная реакция между хлоридом натрия и концентрированной серной кислотой продолжается до конца. 2) если 1 из образовавшихся веществ осаждается в insoluble.
- At время получения нерастворимых оснований, знакомство с этим случаем(стр. 71). 3) Если в результате реакции образуется вода.
 Типичным примером является реакция нейтрализации(<;. 73). Учитывая летучесть, прочность и растворимость кислот (нерастворимая кремниевая кислота h3Si03), их обычно можно расположить в порядке отделения друг от друга солей. Эта строка равна 1. h3S04, HC1, HN03, h4P04, h3S03,h3C03, h3S, h3Si03 Аналог.
Типичным примером является реакция нейтрализации(<;. 73). Учитывая летучесть, прочность и растворимость кислот (нерастворимая кремниевая кислота h3Si03), их обычно можно расположить в порядке отделения друг от друга солей. Эта строка равна 1. h3S04, HC1, HN03, h4P04, h3S03,h3C03, h3S, h3Si03 Аналог.
Например, концентрированная серная кислота вступает в реакцию с солями азотной, соляной и фосфорной кислот. Например, реакция нитрата натрия с соляной кислотой практически не может быть осуществлена, так как летучесть и прочность соляной кислоты и азотной кислоты практически одинаковы.
Ответьте на вопросы 3 и 4 (стр. 80).Физические свойства кислот. Людмила Фирмаль
Многие кислоты, такие как серная, азотная и соляная кислоты, являются бесцветными жидкостями. Твердая кислота также известна как: ортофосфорная кислота NaP04, металлин НР03, борная кислота н3вое. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты Кремниевая h3Si03. Кислый раствор имеет кислый вкус. Химические свойства кислот. 1.Раствор кислоты окрашивает лакмус в красный цвет, а метиловый Апельсин-в розовый.
Кислый раствор имеет кислый вкус. Химические свойства кислот. 1.Раствор кислоты окрашивает лакмус в красный цвет, а метиловый Апельсин-в розовый.
2.1. одним из важнейших химических свойств кислот является способность вступать в реакцию с определенными metals. In в этих реакциях обычно выделяется водород и образуются соли. Zn + 2HCI ZnCl2 + h3f Чтобы выяснить, какие металлы заменяют водород из кислот, российский ученый Н. N. It руководствуется серией металлических работ (1826-1911), определенных экспериментально Бекетовым (1865). К, Na, Са, MG, Алюминия, Цинка, Железа, Никеля, Олова, Свинца, Ч, КР, Серебро, Платина, Au2.
В этой серии Все металлы, которые находятся перед водородом, могут быть заменены водородом из кислот. Исключение составляет азотная кислота. При взаимодействии с металлами вместо водорода выделяются другие газы. 3.Кислоты взаимодействуют с основными оксидами. CuO + h3S04-V C11SO4 + h30 4.Кислота вступает в реакцию с основанием: NaOH + HCl NaCl + h30 5. h30 + Si02 Приложение.
h30 + Si02 Приложение.
Использование наиболее важных кислот рассмотрено в соответствующем разделе(соляная кислота-146 страниц, серная кислота-100 страниц, азотио-II, 35 страниц, ортофосфорная кислота-II, 41 страница). * y ответьте на вопросы и выполните упражнения 5-9.Решите Задачу 3.* I. Что такое вещество, называемое кислотой? Напишите в блокноте следующую таблицу, в соответствующей колонке выведите химическую формулу кислоты, подчеркните кислотный остаток и отметьте его валентность.
Кислота Бескислородный одноосный биационный подшипник tribasic 2.Создайте следующую структурную формулу кислот: б) бромистоводородная кислота; в) сера; г) соляная кислота 4. 3.Как получают кислоту? Создайте уравнение реакции. 4.Вы можете получить следующие 2 способа. фосфорная кислота. б) сероводородная кислота? Напишите уравнение соответствующей реакции. 5.Запишите в блокнот следующую таблицу и запишите 3 уравнения реакции, в которых участвует кислота и образуется в соответствующей колонке.
Реакция реакция реакция реакция реакция реакция Декомпозиция интегрированных замещающих заменителей 6.Приведите 3 уравнения химических реакций, характеризующих химические свойства кислот. Обратите внимание на тип реакции, с которым они связаны. 7.Какое из веществ, которым дана формула, реагирует с соляной кислотой: а)CuO; 6)C)Cu(OH) 2; d) Ag; d) A1(OH)?Напишите уравнение жизнеспособной реакции. 8.Рассмотрим следующую схему реакций: Zn + HCI Cu + HCI Mg-f h3S04 Li + h3S04 NaCI + HCI-h4P04 + h3S04 Na2S04-f HCI Na2COs + HCI Fe (OH) 3 + HNO-NaCI + HNO、
Напишите уравнение жизнеспособной реакции. 9. Напишите резюме ответов о свойствах соляной, серной и фосфорной кислот в соответствии с планом, представленным на стр. 43. 1.Какая кислота богата фосфором-ортофосфорная кислота h4P04 или металлин HPO3? 2. 5 декабря 3.95.It содержит элементы Селена Se (относительная атомная масса Se 79) и 0,1 5 месяцев. В том числе и водород. 3.Напишите уравнение реакции сульфата железа (II) и серной кислоты и рассчитайте массовое соотношение между элементами в молекуле реакции и образующимся веществом.
Смотрите также:
Решение задач по химии
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH ® K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
|
fЭ (формульная единица вещества) º эквивалент |
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH ® K3PO4 + 3H2O fЭ(H3PO4) = 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.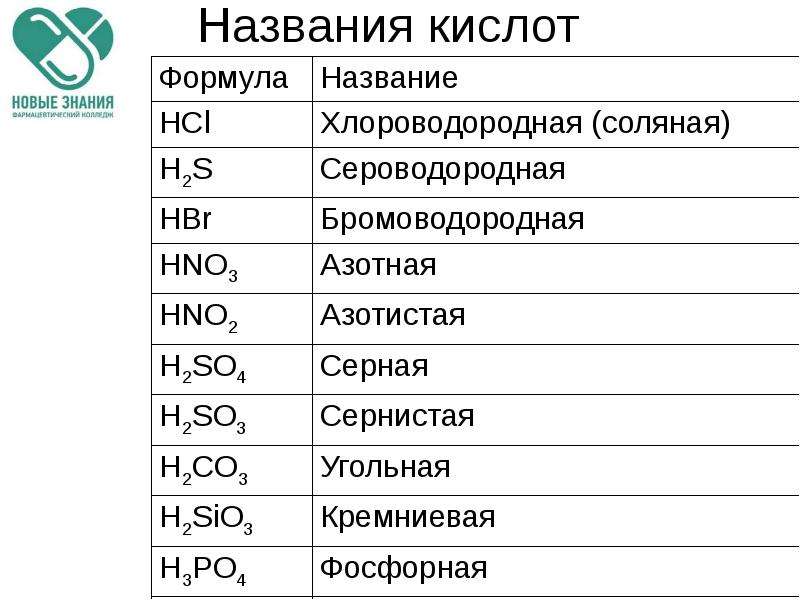
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
|
Частица |
Фактор эквивалентности |
Примеры |
|
Элемент |
, где В(Э) – валентность элемента |
|
|
Простое вещество |
, где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
fЭ(H2) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2) = 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
|
Оксид |
, где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
fЭ(Cr2O3) = 1/(2×3) = 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(H2O) = 1/(2×1) = 1/2; fЭ(P2O5) = 1/(2×5) = 1/10 |
|
Кислота |
, где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
fЭ(H2SO4) = 1/1 = 1 (основность равна 1) или fЭ(H2SO4) = 1/2 (основность равна 2) |
|
Основание |
, где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
|
Соль |
, где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка |
fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку)
|
|
Частица в окислительно-восстановительных реакциях |
, где – число электронов, участвующих в процессе окисления или восстановления |
Fe2+ + 2® Fe0 fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5 ® ® Mn2+ + 4H2O fЭ(MnO4–) = 1/5 |
|
Ион |
, где z – заряд иона |
fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
.
fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
.
fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
|
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка). |
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
|
nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
, – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
,– молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Л.А. Яковишин
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.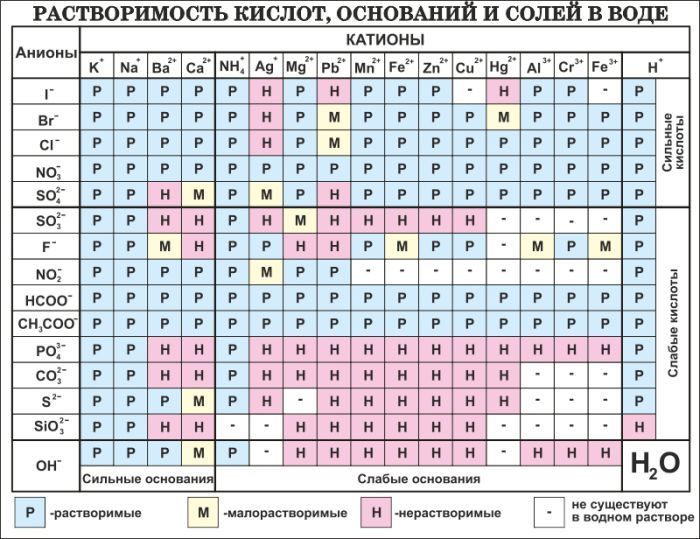
Валентность и структура ароматических остатков определяют фазовое поведение прионоподобных доменов
Мы благодарим J.-M. Choi, A.A. Hyman и J.P. Taylor за содержательные обсуждения; М. Стачелл-Бреретон и Н. Милкович за техническую помощь; С. Чакраварти, Дж. Хопкинс и всему персоналу линии пучка BioCAT в Усовершенствованном источнике фотонов за помощь в измерениях SAXS; C. Liu за предоставление необработанных данных, связанных с измерениями FUS; и анонимных рецензентов за конструктивную критику, которая очень помогла нам в нашем повествовании.Изображения микроскопии были получены в Центре визуализации клеток и тканей при поддержке SJCRH и NCI (грант P30 CA021765). Задания ЯМР доступны в BMRB под кодом доступа 50017. Финансирование: Эта работа финансировалась Исследовательским коллективом Детской исследовательской больницы Св. Научный фонд (от MCB1614766 до RVP), Human Frontier Science Program (от RGP0034/2017 до R.В.П.), Американской федерации исследований старения (А. С.) и Американско-ливанско-сирийской ассоциации благотворительных организаций (Т.М.). Использование усовершенствованного источника фотонов было поддержано Министерством энергетики США по контракту DE-AC02-06Ch21357. Вклад авторов: Концептуализация: E.W.M., A.S.H., R.V.P. и T.M.; Методология: EWM, I.P., A.S.H., A.S., R.V.P. и TM; Расследование: EWM, I.P., ASH, MF, JJI, AB, CRG, A.S., RVP и TM; Ресурсы: A.S., R.V.P. и T.М.; Написание — первоначальный вариант: EWM, ASH, RVP и TM; Написание – рецензирование и редактирование: все авторы; Визуализация: EWM, IP, ASH и A.S.; Привлечение финансирования: R.V.P. и Т.М. Конкурирующие интересы: Р.В.П. является членом научно-консультативного совета DewpointX. Эта работа не финансировалась и не находилась под каким-либо влиянием этой принадлежности. Остальные авторы заявляют об отсутствии конкурирующих интересов. Доступность данных и материалов: Код, необходимый для воспроизведения результатов, можно получить в Zenodo ( 45 ).
С.) и Американско-ливанско-сирийской ассоциации благотворительных организаций (Т.М.). Использование усовершенствованного источника фотонов было поддержано Министерством энергетики США по контракту DE-AC02-06Ch21357. Вклад авторов: Концептуализация: E.W.M., A.S.H., R.V.P. и T.M.; Методология: EWM, I.P., A.S.H., A.S., R.V.P. и TM; Расследование: EWM, I.P., ASH, MF, JJI, AB, CRG, A.S., RVP и TM; Ресурсы: A.S., R.V.P. и T.М.; Написание — первоначальный вариант: EWM, ASH, RVP и TM; Написание – рецензирование и редактирование: все авторы; Визуализация: EWM, IP, ASH и A.S.; Привлечение финансирования: R.V.P. и Т.М. Конкурирующие интересы: Р.В.П. является членом научно-консультативного совета DewpointX. Эта работа не финансировалась и не находилась под каким-либо влиянием этой принадлежности. Остальные авторы заявляют об отсутствии конкурирующих интересов. Доступность данных и материалов: Код, необходимый для воспроизведения результатов, можно получить в Zenodo ( 45 ). Все остальные данные имеются в рукописи или дополнительных материалах. Все экспрессионные плазмиды доступны от T.M. по соглашению о передаче материалов с детской больницей Св. Иуды.
Все остальные данные имеются в рукописи или дополнительных материалах. Все экспрессионные плазмиды доступны от T.M. по соглашению о передаче материалов с детской больницей Св. Иуды.Распределение валентных электронов кофактора флавина в НАДН-цитохром b5 редуктазе
Guillot, B., Jelsch, C., Podjarny, A. & Lecomte, C. Анализ плотности заряда структуры белка при субатомном разрешении: случай человеческой альдозоредуктазы. Acta Кристаллогр. Д биол.Кристаллогр . 64 , 567–588 (2008).
КАС пабмед Google Scholar
Хирано Ю., Такеда К. и Мики К. Анализ плотности заряда белка железо-сера при сверхвысоком разрешении 0,48 Å. Природа 534 , 281–284 (2016).
ОБЪЯВЛЕНИЕ КАС пабмед Google Scholar
Jelsch, C. et al. Точная кристаллография белков со сверхвысоким разрешением: распределение валентных электронов в крамбине.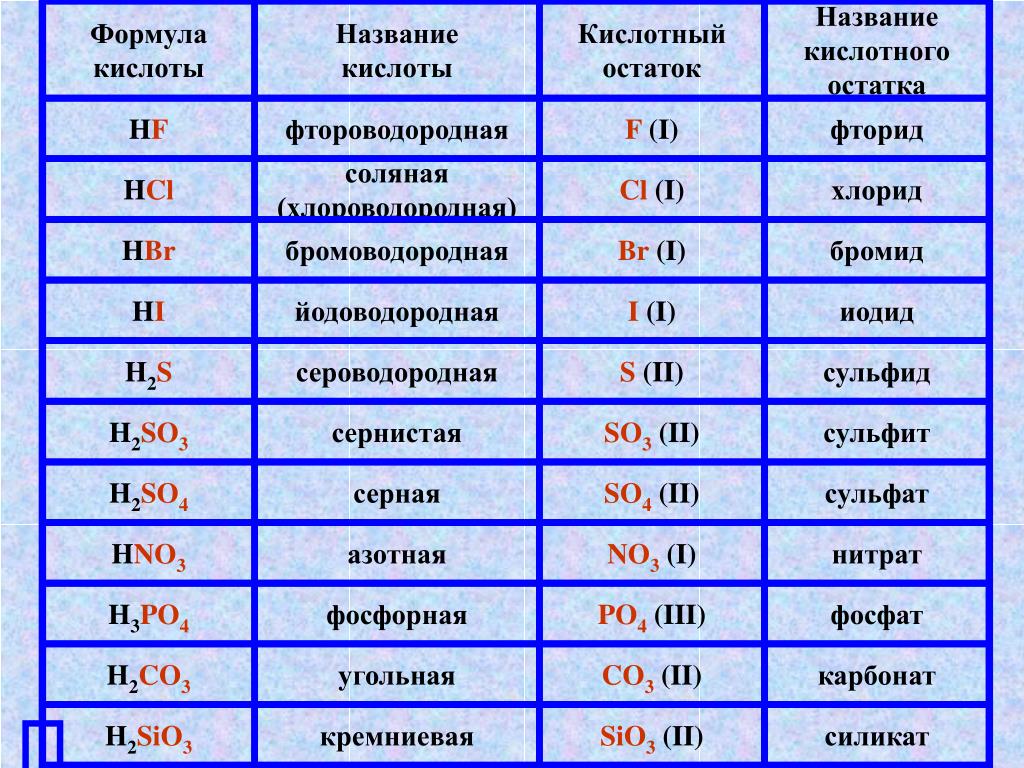 Проц. Натл. акад. науч. США 97 , 3171–3716 (2000).
Проц. Натл. акад. науч. США 97 , 3171–3716 (2000).
ОБЪЯВЛЕНИЕ КАС пабмед Google Scholar
Лю, К. и др. Кристаллическая структура нового неактивного лизина 49 PLA2 из Agkistrodon acutus Venom: сверхвысокое разрешение, определение структуры ab initio. Дж. Биол. хим. 278 , 41400–41408 (2003 г.).
КАС пабмед Google Scholar
Шмидт, А., Йелш, К., Остергаард, П., Рыпневски, В. и Ламзин, В. Новый взгляд на трипсин: кристаллография с (суб)атомным разрешением и квантовая химия, раскрывающая детали катализа. Дж. Биол. хим. 278 , 43357–43362 (2003 г.).
КАС пабмед Google Scholar
Зарычта Б. и др. Холестериноксидаза: кристаллическая структура сверхвысокого разрешения и анализ на основе модели многополярного атома. Acta Кристаллогр.Д биол. Кристаллогр . 71 , 954–968 (2015).
Acta Кристаллогр.Д биол. Кристаллогр . 71 , 954–968 (2015).
КАС пабмед Google Scholar
Walsh, C. & Wencewicz, A. Флавоферменты: универсальные катализаторы биосинтетических путей. Нац. Произв. 30 , 175–200 (2013).
КАС пабмед Google Scholar
Сенда, Т., Сенда, М., Кимура, С. и Ишида Т. Окислительно-восстановительный контроль конформации белка во флавопротеинах. Антиоксидант. Окислительно-восстановительный сигнал. 11 , 1741–1766 (2009).
КАС пабмед Google Scholar
Машеру, П., Каппес, Б. и Илик, С. Флавогеномика – геномный и структурный взгляд на флавинзависимые белки. ФЕБС J . 278 , 2625–2634 (2011).
КАС пабмед Google Scholar
Иянаги Т. , Ватанабэ С.& Anan., K. Одноэлектронные окислительно-восстановительные свойства печеночной НАДН-цитохром b 5 редуктазы. Биохимия 23 , 1418–1425 (1984).
, Ватанабэ С.& Anan., K. Одноэлектронные окислительно-восстановительные свойства печеночной НАДН-цитохром b 5 редуктазы. Биохимия 23 , 1418–1425 (1984).
КАС пабмед Google Scholar
Окаясу Т., Нагано М., Ишибаши Т. и Имаи Ю. Очистка и частичная характеристика линолеоил-КоА-десатуразы из микросом печени крысы. Дуга. Биохим. Биофиз . 206 , 21–28 (1981).
КАС Google Scholar
Spatz, L. & Strittmatter, P. Форма восстановленной никотинамидадениндинуклеотид-цитохром b 5 редуктазы, содержащая как каталитический центр, так и дополнительный гидрофобный сегмент, связывающийся с мембраной J. Biol. хим. 248 , 793–799 (1973).
КАС пабмед Google Scholar
Элахиан, Ф., Сепехризаде З., Могими Б. и Мирзаи С. Цитохром b 5-редуктаза человека: структура, функция и потенциальные применения._20-1200x800.jpg) Крит. Преподобный Биотехнолог. 34 , 134–143 (2012).
Крит. Преподобный Биотехнолог. 34 , 134–143 (2012).
ПабМед Google Scholar
Hildebrandt A. & Estabrook R. W. Доказательства участия цитохрома b 5 в гептатических микросомальных реакциях окисления смешанной функции. Арх. Биохим.Биофиз. 143 , 66–79 (1971).
КАС пабмед Google Scholar
Hultquist D.E. & Passon P.G. Катализ восстановления метаноглобина эритроцитарной цитохромной b 5 и цитохромной b 5 редуктазой. Нац. Новая биол. 229 , 252–254 (1971).
КАС пабмед Google Scholar
Ошино Н., Имаи Ю. и Сато Р. Функция цитохрома b 5 в десатурации жирных кислот микросомами печени крыс. J. Biochem. 69 , 155–167 (1971).
КАС пабмед Google Scholar
Keyes S. R. & Cinti D. L. Биохимические свойства цитохрома b 5-зависимое удлинение микросомальных жирных кислот и идентификация продукта. Дж. Биол. хим. 255 , 11357–11364 (1980).
R. & Cinti D. L. Биохимические свойства цитохрома b 5-зависимое удлинение микросомальных жирных кислот и идентификация продукта. Дж. Биол. хим. 255 , 11357–11364 (1980).
КАС пабмед Google Scholar
Редди В.В., Купфер Д., Капси Э. Механизм введения двойной связи С-5 в биосинтез холестерина микросомами печени крысы. Дж. Биол. хим. 252 , 2797–2801 (1977).
КАС пабмед Google Scholar
Bando, S. et al. Структура НАДН-цитохром b 5 редуктазы эритроцитов человека. Acta Кристаллогр. Д биол. Кристаллогр . 60 , 1929–1934 (2004).
ПабМед Google Scholar
Bewley, M., Marohnic, C. & Barber, M. Структура и биохимия NADH-зависимой цитохром b 5 редуктазы теперь согласуются. Биохимия 40 , 13574–13582 (2001).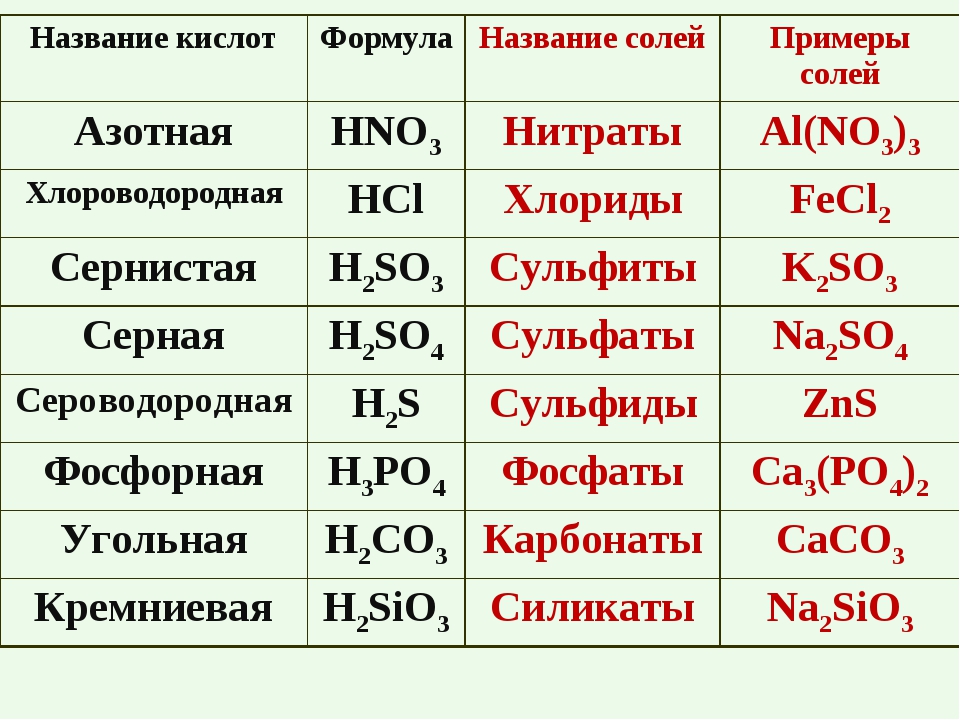
КАС пабмед Google Scholar
Ким С.и другие. Структура редуктазы цитохрома b 5 Physarum polycephalum с разрешением 1,56 Å. Acta Кристаллогр. F Структура. биол. Кристалл. Коммуна . 63 , 274–279 (2007).
КАС Google Scholar
Нисида Х. и др. Кристаллическая структура НАДН-цитохром b 5 редуктазы из печени свиньи с разрешением 2,4 Å. Биохимия 34 , 2763–2767 (1995).
КАС пабмед Google Scholar
Ямада, М.и другие. Выяснение каталитического цикла НАДН-цитохром b 5 редуктазы с помощью рентгеновской кристаллографии: новое понимание регуляции эффективного переноса электронов. Дж. Мол. биол. 425 , 4295–4306 (2013).
КАС пабмед Google Scholar
Энг, Р. А. и Хубер, Р. Точные параметры связей и углов для уточнения структуры рентгеновских лучей. Акта Крист. Найдено. Кристаллогр . 47 , 392–400 (1991).
А. и Хубер, Р. Точные параметры связей и углов для уточнения структуры рентгеновских лучей. Акта Крист. Найдено. Кристаллогр . 47 , 392–400 (1991).
Google Scholar
Bader, RFW Атомы в молекулах: квантовая теория (Oxford Univ. Press, 1990).
Koritsanszky, T. & Coppens, P. Химическое применение рентгеновского анализа плотности заряда. Хим. Ред. 101 , 1583–1627 (2001 г.).
КАС пабмед Google Scholar
Цирельсон В., Барташевич Э., Сташ А. и Потемкин В. Определение порядков ковалентных связей и индексов валентности атомов с использованием топологических особенностей экспериментальной электронной плотности. Acta Кристаллогр. Б Структура. Наука . 63 , 142–150 (2007).
КАС Google Scholar
Ховард С. и Ламарш О. Описание порядков ковалентной связи с использованием топологии плотности заряда. J. Phys. Орг. хим. 16 , 133–141 (2003).
Описание порядков ковалентной связи с использованием топологии плотности заряда. J. Phys. Орг. хим. 16 , 133–141 (2003).
КАС Google Scholar
Эспиноса, Э., Суассу, М. и Лачекар, Х. Топологический анализ электронной плотности в водородных связях. Acta Кристаллогр. Б Структура. Наука . 55 , 563–572 (1999).
КАС Google Scholar
Грабовски С., Сокальский А., Дыгуда Э. и Лещински Дж. Количественная классификация ковалентных и нековалентных водородных связей. J. Phys. хим. B 110 , 6444–6446 (2006).
КАС пабмед Google Scholar
Espinosa, E., Molins, E. & Lecomte, C. Прочность водородных связей, выявленная топологическим анализом экспериментально наблюдаемых электронных плотностей. Хим. физ. лат. 285 , 170–173 (1998).
ОБЪЯВЛЕНИЕ КАС Google Scholar
Субраманиан, С.и Заворотко, М. Использование водородной связи: последние разработки в области инженерии кристаллов. Координ. хим. 137 , 357–401 (1994).
КАС Google Scholar
Журов В., Журова Э., Сташ А. и Пинкертон А. Важность учета ангармонического движения в исследованиях плотности заряда: сравнение исследований при переменной температуре двух взрывчатых веществ, гексогена и октоген Acta Кристаллогр.Найдено. Кристаллогр . 67 , 160–173 (2011).
ОБЪЯВЛЕНИЕ КАС Google Scholar
Деревенда З., Ли Л. и Деревенда У. Возникновение водородных связей C–H···O в белках. Дж. Мол. биол. 252 , 248–262 (1995).
КАС пабмед Google Scholar
Howard, E. et al. Нейтронная и рентгеновская дифракция высокого разрешения при комнатной температуре комплекса H-FABP-олеиновая кислота: изучение внутреннего кластера воды и связывания лиганда с помощью переносимого мультиполярного распределения электронной плотности IUCrJ 3 , 115–126 (2016).
et al. Нейтронная и рентгеновская дифракция высокого разрешения при комнатной температуре комплекса H-FABP-олеиновая кислота: изучение внутреннего кластера воды и связывания лиганда с помощью переносимого мультиполярного распределения электронной плотности IUCrJ 3 , 115–126 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Desiraju, G. Водородная связь C-H…O в кристаллах: что это такое? Согл. хим. Рез. 24 , 290–296 (1991).
КАС Google Scholar
Хендерсон, Р. Криозащита белковых кристаллов от радиационного повреждения при дифракции электронов и рентгеновских лучей. Проц. биол. Наука . 241 , 6–8 (1990).
КАС Google Scholar
Yano, J. et al. Рентгеновское повреждение комплекса Mn4Ca в монокристаллах фотосистемы II: на примере кристаллографии металлопротеинов. Проц. Натл. акад. Наука . 102 , 12047–12052 (2005 г.).
Проц. Натл. акад. Наука . 102 , 12047–12052 (2005 г.).
ОБЪЯВЛЕНИЕ КАС пабмед Google Scholar
Корбетт, М. и др. Фотовосстановление активного центра металлопротеина путидаредоксина синхротронным излучением. Acta Кристаллогр. Д биол. Кристаллогр . 63 , 951–960 (2007).
КАС пабмед Google Scholar
Нисида, Х. и Мики, К. Электростатические свойства, полученные на основе уточненных структур НАДН цитохрома b 5 редуктазы и других флавин-зависимых редуктаз: связывание пиридиновых нуклеотидов и взаимодействие с партнером по переносу электронов. Белки 26 , 32–41 (1996).
КАС пабмед Google Scholar
Kimura, S., Emi, Y., Ikushiro, S. & Iyanagi, T. Систематические мутации высококонсервативного His49 и карбоксильного конца рекомбинантной свиной печени NADH-цитохром b 5-редуктазный солюбилизированный домен. Биохим. Биофиз. Acta 1430 , 290–301 (1999).
Биохим. Биофиз. Acta 1430 , 290–301 (1999).
КАС пабмед Google Scholar
Кимура С., Кавамура М. и Иянаги Т. Роль Thr66 в свиной NADH-цитохром b 5 редуктазе в катализе и контроле лимитирующей стадии переноса электронов. Дж. Биол. хим. 278 , 3580–3589 (2002).
ПабМед Google Scholar
Wang, Y., Yu, Z., Wu, J. & Liu, C. Делокализация электронов и перенос заряда в полипептидных цепях. J. Phys. хим. А 113 , 10521–10526 (2009 г.).
КАС пабмед Google Scholar
Мики К., Кайда С., Иянаги Т. и Кобаяши К. Кристаллизация и предварительное рентгенокристаллографическое исследование НАДН-цитохром b 5 редуктазы из микросом печени свиньи. Дж. Биол. хим. 262 , 11801–11802 (1987).
КАС пабмед Google Scholar
Флот, Д. и др.Микрофокусный луч структурной биологии ID23-2 в ESRF. Дж. Синхротрон Рад . 17 , 107–118 (2009).
и др.Микрофокусный луч структурной биологии ID23-2 в ESRF. Дж. Синхротрон Рад . 17 , 107–118 (2009).
Google Scholar
Отвиновски З. и Минор В. Обработка данных рентгеновской дифракции, собранных в осцилляторном режиме. Методы Enzymol . 276 , 307–326 (1997).
КАС Google Scholar
Пайтханкар, К., Owen, R. & Garman., E. Расчеты поглощенной дозы для макромолекулярных кристаллов: улучшения в RADDOSE. Дж. Синхротрон Рад . 16 , 152–162 (2009).
КАС Google Scholar
Нисида, Х., Инака, К. и Мики, К. Специфическое расположение трех аминокислотных остатков для флавин-связывающих бочкообразных структур в НАДН-цитохром b 5 редуктазе и других флавин-зависимых редуктазах. Письмо ФЭБС. 361 , 97–100 (1995).
КАС пабмед Google Scholar
Вагин А. , Тепляков А. МОЛРЕП: автоматизированная программа молекулярной замены. J. Appl. Кристаллогр . 30 , 1022–1025 (1997).
, Тепляков А. МОЛРЕП: автоматизированная программа молекулярной замены. J. Appl. Кристаллогр . 30 , 1022–1025 (1997).
КАС Google Scholar
Брюнгер, А. и др. Система кристаллографии и ЯМР: новый пакет программного обеспечения для определения структуры макромолекул. Acta Кристаллогр. Д биол. Кристаллогр . 54 , 905–921 (1998).
ПабМед Google Scholar
Шелдрик Г. и Шнайдер Т. SHELXL: уточнение с высоким разрешением. Методы Enzymol . 277 , 319–343 (1997).
КАС пабмед Google Scholar
Хансен, Н. и Коппенс, П. Проверка уточнения асферических атомов на наборах данных о малых молекулах. Acta Кристаллогр. Кристалл. физ. Дифф. Теор. Генерал Кристаллогр . 34 , 909–921 (1978).
ОБЪЯВЛЕНИЕ Google Scholar
Guillot, B. , Viry, L., Guillot, R., Lecomte, C. & Jelsch, C. Уточнение белков с субатомным разрешением с помощью MOPRO. J. Appl. Кристаллогр . 34 , 214–223 (2001).
, Viry, L., Guillot, R., Lecomte, C. & Jelsch, C. Уточнение белков с субатомным разрешением с помощью MOPRO. J. Appl. Кристаллогр . 34 , 214–223 (2001).
КАС Google Scholar
Зарычта Б., Пишон-Песме, В., Гийо, Б., Леконт, К. и Йелш, К. О применении экспериментальной мультиполярной библиотеки псевдоатомов для точного уточнения кристаллических структур малых молекул и белков. Acta Кристаллогр. Найдено. Кристаллогр . 63 , 108–25 (2007).
ОБЪЯВЛЕНИЕ КАС Google Scholar
Guillot, B., Muzet, N., Artacho, E., Lecomte, C. & Jelsch, C. Экспериментальные и теоретические исследования электронной плотности в больших молекулах: NAD + , β-никотинамидадениндинуклеотид. J. Phys. хим. 107 , 9109–9121 (2003 г.).
КАС Google Scholar
Ярзембска, К. , Горал, А. и Гайда, Р. Хугстин-Уотсон-Крик 9-метиладенин: комплекс 1-метилтимина: исследование плотности заряда в контексте инженерии кристаллов и спаривания оснований нуклеиновых кислот. Кристалл. Рост Des. 13 , 239–254 (2013).
, Горал, А. и Гайда, Р. Хугстин-Уотсон-Крик 9-метиладенин: комплекс 1-метилтимина: исследование плотности заряда в контексте инженерии кристаллов и спаривания оснований нуклеиновых кислот. Кристалл. Рост Des. 13 , 239–254 (2013).
КАС Google Scholar
Мунши П.& Роу, Т. Внутри- и межмолекулярные взаимодействия в малых биоактивных молекулах: кооперативные особенности экспериментального и теоретического анализа плотности заряда. Acta Кристаллогр. Б Структура. Наука . 62 , 612–626 (2006).
Google Scholar
Фурнье, Б. и др. Плотность заряда и электростатические взаимодействия фидарестата, ингибитора альдозоредуктазы человека. Дж. Ам. хим. соц. 131 , 10929–10941 (2009).
КАС пабмед Google Scholar
Allen, F. Систематическое попарное сравнение геометрических параметров, полученных с помощью рентгеновской и нейтронной дифракции. Acta Кристаллогр. Б Структура. Наука . 42 , 515–522 (1986).
Acta Кристаллогр. Б Структура. Наука . 42 , 515–522 (1986).
Google Scholar
DeLano, WL Система молекулярной графики PyMol (DeLano Scientific, 2002).
Ю М.и Тринкль, Д. Точный и эффективный алгоритм интегрирования зарядов Бейдера. J. Chem. физ. 134 , 064111–064118 (2011).
ОБЪЯВЛЕНИЕ пабмед Google Scholar
Эспиноса, Э. и Молинс, Э. Извлечение потенциалов взаимодействия из топологии распределения электронной плотности: случай водородных связей. J. Chem. физ. 113 , 5686–5694 (2000).
ОБЪЯВЛЕНИЕ КАС Google Scholar
Химия азота (Z=7) — Химия LibreTexts
Азот присутствует почти во всех белках и играет важную роль как в биохимических, так и в промышленных применениях.Азот образует прочные связи из-за своей способности образовывать тройную связь с самим собой и другими элементами. Таким образом, в соединениях азота содержится много энергии. Еще 100 лет назад мало что было известно об азоте. Теперь азот обычно используется для сохранения продуктов питания и в качестве удобрения.
Таким образом, в соединениях азота содержится много энергии. Еще 100 лет назад мало что было известно об азоте. Теперь азот обычно используется для сохранения продуктов питания и в качестве удобрения.
Введение
Установлено, что азот имеет 3 или 5 валентных электронов и находится на вершине 15-й группы периодической таблицы. У него может быть 3 или 5 валентных электронов, потому что он может связываться на внешних 2p- и 2s-орбиталях.Молекулярный азот (\(N_2\)) не вступает в реакцию при стандартной температуре и давлении и представляет собой бесцветный газ без запаха.
Рисунок \(\PageIndex{1}\) : Диаграмма Бора атома азота. Азот – это неметаллический элемент, наиболее распространенный в атмосфере, газообразный азот (N 2 ) составляет 78,1% объема земного воздуха. Он появляется только в 0,002% земной коры по массе. Соединения азота содержатся в пищевых продуктах, взрывчатых веществах, ядах и удобрениях.Азот входит в состав ДНК в виде азотистых оснований, а также в виде нейротрансмиттеров. Это один из крупнейших промышленных газов, который производится в промышленных масштабах в виде газа и жидкости.
Это один из крупнейших промышленных газов, который производится в промышленных масштабах в виде газа и жидкости.
| Название и условное обозначение | Азот, N |
| Категория | неметалл |
| Атомный вес | 14.0067 |
| Группа | 15 |
| Электронная конфигурация | 1с 2 2с 2 2п 3 |
| Валентные электроны | 2, 5 |
| Фаза | Газ |
История
Азот, составляющий около 78% нашей атмосферы, представляет собой бесцветный газ без запаха, вкуса и химически неактивный газ при комнатной температуре. Он назван от греческого нитрон + гены образования соды. На протяжении многих лет в 1500-х и 1600-х годах ученые намекали, что помимо углекислого газа и кислорода в атмосфере есть еще один газ. Лишь в 1700-х годах ученые смогли доказать, что на самом деле существует еще один газ, набирающий массу в атмосфере Земли.
Он назван от греческого нитрон + гены образования соды. На протяжении многих лет в 1500-х и 1600-х годах ученые намекали, что помимо углекислого газа и кислорода в атмосфере есть еще один газ. Лишь в 1700-х годах ученые смогли доказать, что на самом деле существует еще один газ, набирающий массу в атмосфере Земли.
Открыт в 1772 году Дэниелом Резерфордом (и независимо другими, такими как Пристли и Кавендиш), который смог удалить кислород и углекислый газ из замкнутой трубки, наполненной воздухом.Он показал, что существует остаточный газ, который не поддерживает горение, как кислород или углекислый газ. В то время как его эксперимент доказал существование азота, другие эксперименты также проводились в Лондоне, где они назвали вещество «сгоревшим» или «дефлогистированным воздухом».
Азот является четвертым наиболее распространенным элементом в организме человека, и в известной Вселенной его больше, чем углерода или кремния. Большая часть коммерчески производимого газообразного азота извлекается из сжиженного воздуха. Из этого количества большая часть используется для производства аммиака (\(NH_3\)) по процессу Габера.Многое также превращается в азотную кислоту (\(HNO_3\)).
Из этого количества большая часть используется для производства аммиака (\(NH_3\)) по процессу Габера.Многое также превращается в азотную кислоту (\(HNO_3\)).
Изотопы
Азот имеет два встречающихся в природе изотопа, азот-14 и азот-15, , которые можно разделить химическим обменом или термической диффузией. У азота тоже есть изотопы с массой 12, 13, 16, 17, но они радиоактивны.
- Азот 14 является наиболее распространенной формой азота и составляет более 99% всего азота, обнаруженного на Земле. Это стабильное соединение, нерадиоактивное.Азот-14 имеет наиболее практическое применение и встречается в сельскохозяйственной практике, консервировании пищевых продуктов, биохимических веществах и биомедицинских исследованиях. Азот-14 в изобилии содержится в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником.
- Азот-15 — еще одна стабильная форма азота.
 Он часто используется в медицинских исследованиях и консервации. Этот элемент нерадиоактивен и поэтому иногда может использоваться в сельскохозяйственной практике.Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку в отличие от азота-14 (ядерный спин 1) он имеет ядерный спин 1/2, что имеет преимущества, когда дело доходит до наблюдения за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не увидели его полного потенциала для использования в исследованиях мозга.
Он часто используется в медицинских исследованиях и консервации. Этот элемент нерадиоактивен и поэтому иногда может использоваться в сельскохозяйственной практике.Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку в отличие от азота-14 (ядерный спин 1) он имеет ядерный спин 1/2, что имеет преимущества, когда дело доходит до наблюдения за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не увидели его полного потенциала для использования в исследованиях мозга.
Соединения
Двумя наиболее распространенными соединениями азота являются нитрат калия (KNO 3 ) и нитрат натрия (NaNO 3 ).Эти два соединения образуются при разложении органических веществ, содержащих калий или натрий, и часто встречаются в удобрениях и побочных продуктах промышленных отходов. Большинство соединений азота имеют положительную свободную энергию Гиббса (т. е. реакции не протекают самопроизвольно).
Большинство соединений азота имеют положительную свободную энергию Гиббса (т. е. реакции не протекают самопроизвольно).
Молекула диазота (\(N_2\)) представляет собой «необычайно стабильное» соединение, особенно потому, что азот образует тройную связь сам с собой. Эту тройную связь трудно разорвать.Чтобы диазот соответствовал правилу октета, он должен иметь тройную связь. Азот имеет в общей сложности 5 валентных электронов, поэтому удвоив его, мы получим в общей сложности 10 валентных электронов с двумя атомами азота. Октет требует, чтобы атом имел 8 полных электронов, чтобы иметь полную валентную оболочку, поэтому он должен иметь тройную связь. Соединение также очень инертно, так как имеет тройную связь. Тройные связи очень трудно разорвать, поэтому они сохраняют свою полную валентную оболочку, а не реагируют с другими соединениями или атомами.Подумайте об этом таким образом, каждая тройная связь подобна резиновой ленте, с тремя резиновыми лентами атомы азота очень притягиваются друг к другу.
Нитриды
Нитриды представляют собой соединения азота с менее электроотрицательным атомом; другими словами, это соединение с атомами, которые имеют менее полную валентную оболочку. Эти соединения образуются с литием и металлами группы 2. Нитриды обычно имеют степень окисления -3.
\[3Mg + N_2 \rightarrow Mg_3N_2 \label{1}\]
При смешивании с водой азот образует аммиак, и этот нитрид-ион действует как очень сильное основание.-_{(водн.)} \метка{2}\]
При образовании азота с другими соединениями он главным образом образует ковалентные связи. Обычно они производятся с другими металлами и выглядят так: MN, M 3 N и M 4 N. Эти соединения обычно твердые, инертные и имеют высокие температуры плавления из-за способности азота образовывать тройные ковалентные связи.
Ионы аммония
Азот фиксируется путем реакции с газообразным водородом над катализатором. Этот процесс используется для производства аммиака. Как упоминалось ранее, этот процесс позволяет нам использовать азот в качестве удобрения, потому что он разрушает прочную тройную связь, удерживаемую N 2 . Знаменитый процесс синтеза аммиака Габера-Боша выглядит так:
Как упоминалось ранее, этот процесс позволяет нам использовать азот в качестве удобрения, потому что он разрушает прочную тройную связь, удерживаемую N 2 . Знаменитый процесс синтеза аммиака Габера-Боша выглядит так:
\[N_2 + 3H_2 \rightarrow 2NH_3 \label{3}\]
Аммиак является основанием и также используется в типичных кислотно-щелочных реакциях.
\[2NH_{3(водн.)} + H_2SO_4 \rightarrow (NH_4)_2SO_{4(водн.)} \label{4}\]
Ионы нитрида являются очень сильными основаниями, особенно в водных растворах.
Оксиды азота
Нитриды имеют различные степени окисления от +1 до +5 для оксидных соединений. Почти все образующиеся оксиды являются газами и существуют при 25 градусах Цельсия. Оксиды азота кислые и легко присоединяют протоны.
\[N_2O_5 + H_2O \rightarrow 2HNO_{3 (водный)} \label{5}\]
Оксиды играют большую роль в живых организмах. Они могут быть полезными, но опасными.
- Монооксид азота (N 2 O) — анестетик, используемый стоматологами в качестве веселящего газа.

- Двуокись азота (NO 2 ) вредна. Он связывается с молекулами гемоглобина, не позволяя молекуле выделять кислород по всему телу. Он выделяется из автомобилей и очень вреден.
- Нитрат (NO 3 — ) представляет собой многоатомный ион.
- Более нестабильные оксиды азота позволяют путешествовать в космос.
Гидриды
Гидриды азота включают аммиак (NH 3 ) и гидразин (N 2 H 4 ).
- В водном растворе аммиак образует описанный выше ион аммония, обладающий особыми амфипротными свойствами.
- Гидразин обычно используется в качестве ракетного топлива
Применение азота
- Азот обеспечивает защиту нашей атмосферы для производства химикатов и электронных отсеков.
- Азот используется в качестве удобрения в сельском хозяйстве для стимулирования роста.
- Газ под давлением для масла.
- Хладагент (например, для быстрой заморозки продуктов)
- Взрывчатые вещества.

- Обработка/защита металлов с помощью азота вместо кислорода
Каталожные номера
- Петруччи, Ральф Х., Уильям Харвуд и Ф. Херринг. Общая химия: принципы и современные приложения. 8 й Изд. Нью-Джерси: Pearson Education Inc., 2001. .
- Садава, Дэвид и др. ЖИЗНЬ: биология. Издание восьмое.Ассоциированный Синауэр.
- Томас, Джейкоб. Азот и его применение в современном будущем . Издательство государственного университета Сан-Диего: 2007. .
Проблемы
- Дополнить и сбалансировать следующие уравнения
N 2 + ___H 2 → ___NH _
H 2 N 2 O 2 → ?
2NH 3 + CO 2 → ?
__Mg + N 2 → Mg _ N _
N 2 H 5 + H 2 O → ?
- Какие существуют изотопы азота?
- Список Оксиадационные состояния различных оксидов азота: N 2 O, NO, N 2 O 3 , N 2 O 4 , N 2 O 5
- Перечислите различные элементы, с которыми азот будет реагировать, делая его щелочным или кислым.
 …
… - Использование азота
Ответы
- Дополнить и сбалансировать следующие уравнения
N 2 + 3H 2 → 2NH 3 (процесс Габера)
H 2 N 2 O 2 → HNO
2NH 3 + CO 2 → (NH 2 ) 2 CO + H 2 O
2Mg + 3N 2 → Mg 3 N 2
N 2 H 5 + H 2 O → N 2 + H + + H 2 O
- Какие существуют изотопы азота?
Стабильные формы включают азот-14 и азот-15
- Перечислите степени окисления различных оксидов азота: +1, +2, +3, +4, +5 соответственно
- Перечислите различные элементы, с которыми азот будет реагировать, чтобы сделать его щелочным или кислотным: Ион нитрида является сильным основанием при реакции с водой, аммиак обычно является слабой кислотой
- Использование азота включает анестетик, хладагент, металлический протектор
Эрбий — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: эрбий
(Промо)
Вы слушаете Химия в ее стихии, представленная вам журналом Королевского химического общества Chemistry World ,
(Конец рекламного ролика)
Крис Смит
На этой неделе мы познакомимся с человеком и одним из химических веществ, которые привели к рождению науки спектроскопии, но розовый ваш цвет?
Андреа Селла
Пару лет назад один коллега просунул голову в мою дверь и сказал, как это делают химики: «Я в поисках». Это довольно распространено на химических факультетах — вы хотите провести быстрый эксперимент и просто хотите немного чего-нибудь, не заказывая целую бутылку.Итак, вы спрашиваете друга, есть ли у него что-нибудь. — У вас есть немного оксида эрбия? «Конечно, я сказал. У меня есть кое-что в лаборатории». Через несколько минут мой друг ушел с маленькой бутылочкой, содержащей нежно-розовый порошок.
Это довольно распространено на химических факультетах — вы хотите провести быстрый эксперимент и просто хотите немного чего-нибудь, не заказывая целую бутылку.Итак, вы спрашиваете друга, есть ли у него что-нибудь. — У вас есть немного оксида эрбия? «Конечно, я сказал. У меня есть кое-что в лаборатории». Через несколько минут мой друг ушел с маленькой бутылочкой, содержащей нежно-розовый порошок.
Через несколько недель я увидел его на лестничной площадке и спросил, как у него дела с эрбием. «Это потрясающие вещи. Вы ДОЛЖНЫ это увидеть». Он ответил. Он вытащил из кармана пузырек с образцами, содержащий потрясающие розовые кристаллы, которые заманчиво блестели.»Ух ты!» Я сказал — химиков всегда впечатляют красивые кристаллические продукты. «Стало лучше». — загадочно сказал он. Он поманил меня в коридор, который был недавно отремонтирован. «Смотри», сказал он.
По мере того, как кристаллы ловили свет от новых флуоресцентных ламп, свисающих с потолка, розовый цвет, казалось, становился глубже и ярче. «Ух ты!» — повторил я. Мы поместили кристаллы обратно на солнечный свет, и цвет снова потускнел. Перемещая кристаллы вперед и назад, они магическим образом светились и тускнели.
«Ух ты!» — повторил я. Мы поместили кристаллы обратно на солнечный свет, и цвет снова потускнел. Перемещая кристаллы вперед и назад, они магическим образом светились и тускнели.
Это был ошеломляющий пример люминесценции группы элементов, редкоземельных элементов, к которым относится эрбий. Красный люминофор в люминесцентных лампах, должно быть, содержал ионы эрбия, и поскольку длина волны излучения люминофора точно соответствовала поглощению в кристаллах моего друга, происходит резонансное поглощение, вызывающее волшебное свечение.
Редкие земли были открыты миру совершенно случайно шведским лейтенантом и скалолазом Карлом Акселем Аррениусом в 1787 году в каменоломне на острове Ваксхольм в Швеции, где расположен небольшой город Иттербю.Минерал, открытый Аррениусом, привел к открытию 16 элементов, каждый из которых имел удивительно схожие свойства. И небольшая деревня Иттербю послужила источником вдохновения для названий некоторых из них: иттербий, иттрий, тербий и элемент этого подкаста, эрбий. Другие получили такие названия, как скандий, гольмий, тулий, в знак признания региона, откуда они впервые появились.
Другие получили такие названия, как скандий, гольмий, тулий, в знак признания региона, откуда они впервые появились.
Уже более столетия среди химиков бушуют споры об этих элементах. И одним из ключевых игроков в этом химическом ряду был Роберт Бунзен, один из изобретателей спектроскопии вместе с Густавом Кирхгофом.Вместе им пришла в голову идея помещать химические соединения в пламя и анализировать полученный свет с помощью призмы. Спектры, которые они наблюдали, оказались прекрасными аналитическими инструментами — Кирхгоф использовал этот метод для идентификации элементов на Солнце. Этот метод быстро стал одним из центральных столпов химии.
Но, как и многие другие, работавшие в этой области, Бунзен был заинтригован слабым цветом лантаноидов и их удивительной неизменностью. Соединения эрбия, независимо от партнера — оксида, хлорида, фторида, амида, гидрокарбилов — почти всегда бледно-розового цвета.В течение трех долгих лет Бунзен методично провел сотни кристаллизаций, необходимых для очистки элементов, а затем тщательно измерил и зарисовал искровые спектры, которые содержали множество четких полос различной интенсивности. Для своего времени это был спектроскопический прорыв. Наконец, в мае 1874 года Бунзен закончил писать свою монументальную рукопись. С чувством облегчения он, наконец, отправился в местный паб на обед.
Для своего времени это был спектроскопический прорыв. Наконец, в мае 1874 года Бунзен закончил писать свою монументальную рукопись. С чувством облегчения он, наконец, отправился в местный паб на обед.
Представьте себе ужас бедняги, когда он вернулся в лабораторию, а рукопись исчезла.Круглодонная фляга с водой на столе сфокусировала весеннее солнце из окна и подожгла всю кучу. Годы работы превратились в пепел. Выразив свое отчаяние в паре писем друзьям, Бунзен кропотливо переделал работу с нуля, заложив фундамент нашего понимания электронной структуры таких элементов, как эрбий.
Теперь мы понимаем, что валентные электроны эрбия, которых в его соединениях 11, находятся глубоко внутри ядра атома.Их расположение делает их удивительно нечувствительными к внешнему миру — вот почему цвета так постоянны от соединения к соединению.
Но Бунзен не мог знать, что существуют спектроскопические полосы в инфракрасной части спектра, и именно они делают эрбий таким ценным для нас сегодня. Как вы, наверное, знаете, большинство наших телефонных звонков и передачи данных через Интернет осуществляется по оптическим волокнам. Эти тонкие, как паутина, стеклянные нити обладают редким оптическим совершенством.Но подобно свету, проходящему через атмосферу, происходит рассеяние — фотоны света время от времени сталкиваются со стеклянными цепями в волокне, и свет ослабляется, ограничивая длину волокна, которое можно использовать. Это явление, называемое рэлеевским рассеянием, является тем же, что делает дневное небо голубым, а закаты — красными. Чем короче длина волны, тем больше рассеяние. Эрбиевый свет — на длине волны 1,55 микрон, в ближней инфракрасной области спектра — падает именно там, где рэлеевское рассеяние минимально, но вдали от того места, где колебания связи стекла поглощают инфракрасный свет.Таким образом, эрбиевые лазеры и усилители являются центром, вокруг которого вращаются все наши современные телекоммуникации. Так что в следующий раз, когда вы позвоните другу и скажете ему: «Это прекрасный день.
Как вы, наверное, знаете, большинство наших телефонных звонков и передачи данных через Интернет осуществляется по оптическим волокнам. Эти тонкие, как паутина, стеклянные нити обладают редким оптическим совершенством.Но подобно свету, проходящему через атмосферу, происходит рассеяние — фотоны света время от времени сталкиваются со стеклянными цепями в волокне, и свет ослабляется, ограничивая длину волокна, которое можно использовать. Это явление, называемое рэлеевским рассеянием, является тем же, что делает дневное небо голубым, а закаты — красными. Чем короче длина волны, тем больше рассеяние. Эрбиевый свет — на длине волны 1,55 микрон, в ближней инфракрасной области спектра — падает именно там, где рэлеевское рассеяние минимально, но вдали от того места, где колебания связи стекла поглощают инфракрасный свет.Таким образом, эрбиевые лазеры и усилители являются центром, вокруг которого вращаются все наши современные телекоммуникации. Так что в следующий раз, когда вы позвоните другу и скажете ему: «Это прекрасный день.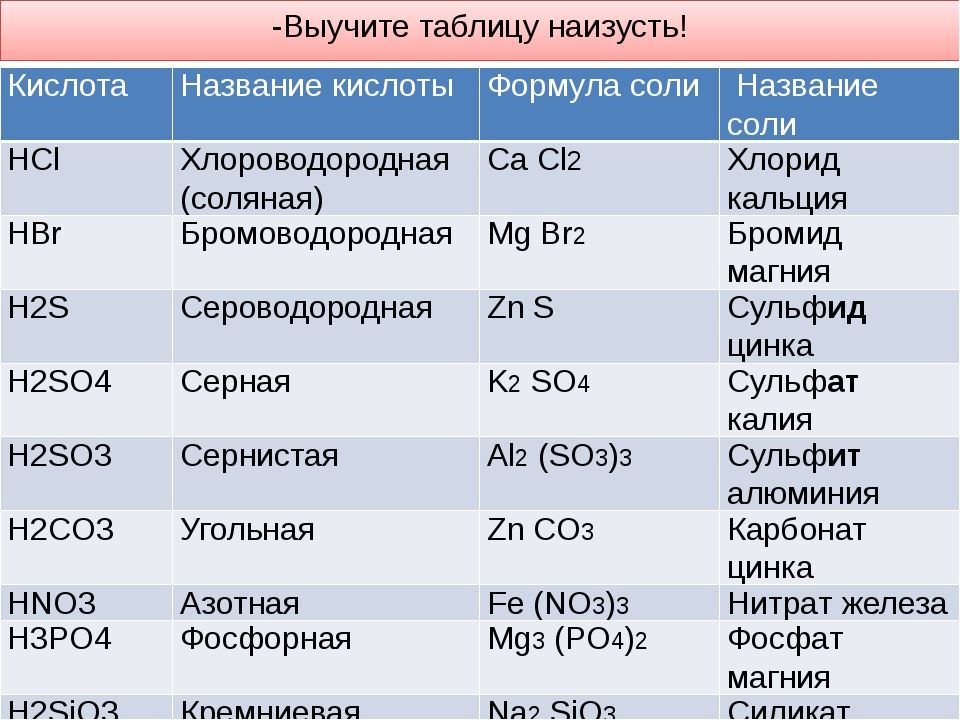 Пойдем в парк», подумайте об Erbium. Это может быть только 44 90 623 th 90 624 самый распространенный элемент на нашей планете. Но он бьет намного выше своего веса.
Пойдем в парк», подумайте об Erbium. Это может быть только 44 90 623 th 90 624 самый распространенный элемент на нашей планете. Но он бьет намного выше своего веса.
Крис Смит
Какая ирония в том, что человек, который изобрел горелку Бунзена, закончил тем, что его работа сгорела благодаря солнцу. Это химик UCL Андреа Селла рассказала историю Роберта Бунзена и элемента эрбия.В следующий раз к философскому камню и человеку, который кипятил мочу в надежде получить золото, а вместо этого нашел этот элемент.
Нина Нотман
Фосфор был впервые получен Хеннигом Брандтом в Гамбурге в Германии в 1669 году, когда он выпарил мочу и нагрел остаток до красна. Вырвались светящиеся пары фосфора, и он сконденсировал их под водой. И более 100 лет большая часть фосфора производилась таким образом. Так было до тех пор, пока люди не поняли, что кости являются отличным источником фосфора.Кость можно растворить в серной кислоте, чтобы получить фосфорную кислоту, которую затем нагревают с древесным углем, чтобы получить белый фосфор.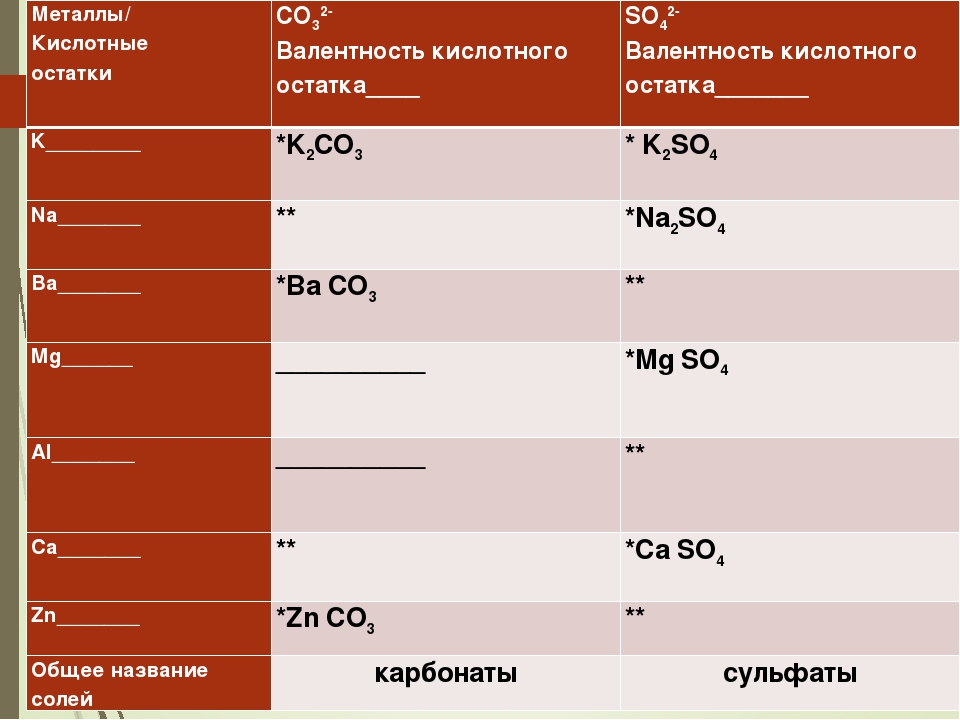
Крис Смит
Но что мы можем с этим сделать? Вы сможете узнать об этом в следующий раз, когда Нина Нотман расскажет историю о Фосфоре на следующей неделе в программе «Химия в ее элементах». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(Акция)
(Конец акции)
Глава 2: Основные аспекты биохимии — Органическая химия, Кислотно-основная химия, Аминокислоты, Структура и функция белков и Кинетика ферментов Карточки
Ответ C. У этого ребенка, вероятно, синдром Элерса-Данлоса, группа редких наследственных заболеваний, характеризующихся нарушением синтеза коллагена. Состояние может быть вызвано дефицитом пептидазы проколлагена, фермента, который отщепляет терминальные пропептиды от проколлагена во внеклеточном пространстве. Нарушение удаления пропептида приводит к образованию растворимого коллагена, который не сшивается должным образом.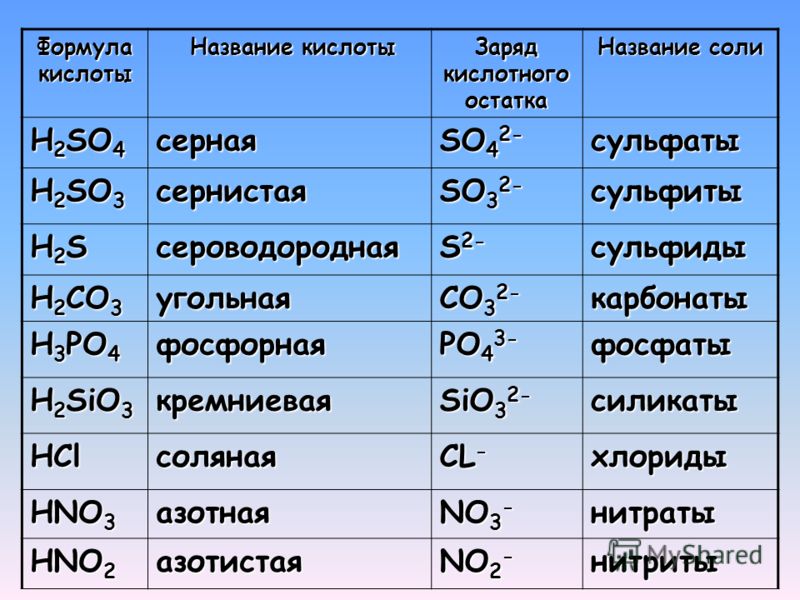 Следовательно, пациенты часто имеют вялость суставов, чрезмерно растяжимую кожу, хрупкие ткани с легкими синяками и плохое заживление ран.
Следовательно, пациенты часто имеют вялость суставов, чрезмерно растяжимую кожу, хрупкие ткани с легкими синяками и плохое заживление ран.
Каждая молекула коллагена состоит из 3-х полипептидных а-цепей, соединенных водородными связями, образуя тройную спираль. Коллаген принимает эту конформацию, потому что каждая из а-цепей имеет простую повторяющуюся аминокислотную последовательность, представленную как (Gly-X-Y). Самая маленькая аминокислота, глицин (Gly), необходима в каждом третьем положении, чтобы обеспечить компактное закручивание спирали. Многие аминокислоты, представленные X и Y, представляют собой остатки пролина, которые изгибают полипептидную цепь и повышают жесткость спиральной структуры благодаря своей кольцевой конфигурации.
Зрелый коллаген синтезируется фибробластами, остеобластами и хондробластами в ходе следующих стадий:
1. Когда трансляция начинается в цитоплазме, сигнальная последовательность аминокислот на N-конце α-цепи облегчает рибосомальное связывание с шероховатой эндоплазматический ретикулум (ЭРР) и переход растущей полипептидной цепи (пре-про-α-цепи) в РЭР.
2. Внутри RER гидрофобная сигнальная последовательность расщепляется с образованием про-α-цепи. Пролин и лизин в положении Y про-α-цепи гидроксилируются до гидроксипролина и гидроксилизина соответственно (выбор D).Гликозилирование некоторых остатков гидроксилизина также происходит в RER (выбор А).
3. Центральная спиральная область про-α-цепи окружена N- и С-концевыми пропептидами. Образование дисульфидной связи между С-концевой пропептидной областью 3 α-цепей приводит цепи в выравнивание, благоприятное для сборки в тройную спираль (молекула проколлагена (варианты B и E). 91–172 4. Затем молекулы проколлагена транспортируются через аппарат Гольджи. N-концевые С-концевые пропептиды расщепляются пептидазами проколлагена, превращая проколлаген в менее растворимый тропоколлаген.
5. Мономеры тропоколлагена самоорганизуются в коллагеновые фибриллы. Наконец, лизилоксидаза помогает создавать ковалентные поперечные связи между фибриллами коллагена для формирования прочных волокон коллагена.
Образовательная цель:
Синдром Элерса-Данлоса представляет собой группу редких наследственных заболеваний, характеризующихся нарушением синтеза коллагена. Это может быть вызвано дефицитом проколлагенпептидазы, что приводит к нарушению расщепления терминальных пропептидов во внеклеточном пространстве. Пациенты часто имеют дряблость суставов, чрезмерно растяжимую кожу и хрупкость тканей из-за образования растворимого коллагена, который не сшивается должным образом
Разделение фаз в биологии; функциональная организация высшего порядка | Клеточная связь и передача сигналов
Подобно разделению труда в человеческом обществе, клеточная «рабочая сила», макромолекулы, такие как белки, ДНК и РНК, пространственно организованы в клетке на основе функциональной специализации.Субклеточная организация макромолекул лежит в основе жизненно важных клеточных процессов, таких как развитие, деление и гомеостаз, нарушение этой организации часто связано с заболеванием.
Большая часть ферментативных и сигнальных реакций в биологии протекает в водном растворе. Липидные бислои, не смешивающиеся с водной фазой, окружают водорастворимые компоненты клетки. Плазматическая мембрана охватывает все внутренние компоненты клетки. Ограниченные мембраной органеллы обеспечивают физическое разделение, необходимое для протекания специализированных процессов в функционально оптимизированных компартментах внутри клетки.Таким образом, ядро содержит механизмы, предназначенные для синтеза ДНК и РНК, а в цитоплазме находятся компоненты, контролирующие синтез и деградацию белка. Эндоплазматический ретикулум, аппарат Гольджи и липидные везикулы представляют собой ограниченные мембраной компартменты, специализирующиеся на сортировке и транспортировке белков через клетку. Митохондрии обеспечивают энергетические потребности клетки в АТФ и заключены в двухслойную мембрану, в отличие от одиночного липидного двойного слоя, который окружает другие ограниченные мембраной органеллы.
С появлением электронной микроскопии, которая позволила визуализировать структуры нанометрового масштаба [1], и достижениями в области флуоресцентных красителей и световой микроскопии стало очевидным, что в ядре и цитозоле существует дальнейшее подразделение и локальная организация в форме не — мембранно-ограниченные макромолекулярные сборки.
Охарактеризованные в настоящее время безмембранные тельца или органеллы имеют размер от десятков нм до десятков мкм и были определены как высокодинамичные макромолекулярные сборки, компоненты которых быстро перемещаются между органеллой и окружающей средой [2–7].Ядрышки (обзор в [8]), ядерные спеклы (обзор в [3, 9]), параспеклы (обзор в [2, 10]), PML (обзор в [11, 12]) и тельца Кахаля (обзор в [ 4]) заключены в ядерную оболочку и специализируются на различных аспектах регуляции генов и метаболизма РНК. Гранулы цитоплазматического матричного рибонуклеопротеина (мРНП), такие как Р-тельца, зародышевые гранулы и стресс-гранулы (обзор в [13]), выполняют специфические роли в метаболизме мРНК и гомеостазе. Аналогичные формы гранул РНК недавно были идентифицированы в митохондриях и играют роль в биогенезе митохондриальных рибосом и процессинге РНК [14].
Аналогичные формы гранул РНК недавно были идентифицированы в митохондриях и играют роль в биогенезе митохондриальных рибосом и процессинге РНК [14].
В этом обзоре мы представим обзор современных знаний о структурной биологии безмембранных органелл и молекулярных механизмах, участвующих в регуляции их структуры и функции.
Обзор безмембранных органелл
Безмембранные органеллы были описаны как динамические структуры, которые часто обладают жидкостными физическими свойствами [5, 6]. Хотя хорошо известно, что они вовлечены в важные биологические процессы, их точная роль остается неясной, часто они связаны с более чем одним функциональным путем.Как будет более подробно описано в следующих разделах, белковый состав безмембранных органелл и их морфология изменяются в ответ на изменения в клеточной среде. Эта способность реагировать на сигналы окружающей среды может представлять собой механистическую основу для участия безмембранных органелл, обсуждаемых здесь, в восприятии стресса [2, 4, 9, 11, 13, 15].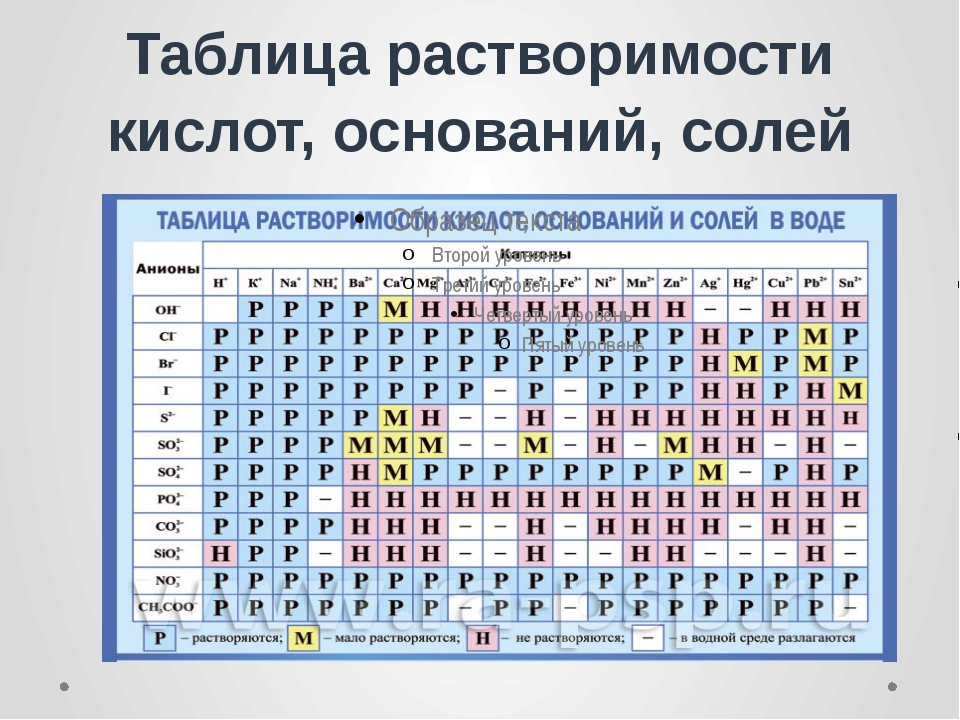 Отсутствие богатого липидами барьера для включения компонентов безмембранных органелл дает преимущество, заключающееся в том, что изменения в окружающей среде могут легко изменить их внутреннее равновесие.Высвобождение или секвестрация составляющих белков или РНК из или внутри безмембранных органелл изменяет их концентрацию в окружающем свободно диффундирующем пуле макромолекул, тем самым посылая сигналы, влияющие на пути ответа на стресс. Одним из примеров является накопление в ядрышке с последующим высвобождением в нуклеоплазму опухолевого супрессора р14 ARF в ответ на повреждение ДНК, что активирует путь опухолевого супрессора р53 [16]. Ядерный объем разделен на несколько безмембранных органелл, также называемых ядерными тельцами.Цитоплазматические тельца далее разделяют цитозольные компоненты. Ядерные и цитоплазматические тела представляют собой динамические структуры с четко определенным составом, способные обмениваться компонентами в ответ на изменения в окружающей среде.
Отсутствие богатого липидами барьера для включения компонентов безмембранных органелл дает преимущество, заключающееся в том, что изменения в окружающей среде могут легко изменить их внутреннее равновесие.Высвобождение или секвестрация составляющих белков или РНК из или внутри безмембранных органелл изменяет их концентрацию в окружающем свободно диффундирующем пуле макромолекул, тем самым посылая сигналы, влияющие на пути ответа на стресс. Одним из примеров является накопление в ядрышке с последующим высвобождением в нуклеоплазму опухолевого супрессора р14 ARF в ответ на повреждение ДНК, что активирует путь опухолевого супрессора р53 [16]. Ядерный объем разделен на несколько безмембранных органелл, также называемых ядерными тельцами.Цитоплазматические тельца далее разделяют цитозольные компоненты. Ядерные и цитоплазматические тела представляют собой динамические структуры с четко определенным составом, способные обмениваться компонентами в ответ на изменения в окружающей среде. В следующем разделе мы обсудим функциональные роли безмембранных органелл и уникальные особенности, которые их определяют.
В следующем разделе мы обсудим функциональные роли безмембранных органелл и уникальные особенности, которые их определяют.
Безмембранные тельца
Ядрышко
Крупнейшая и лучше всего изученная безмембранная органелла, ядрышко, функционирует как центр биогенеза рибосом в эукариотических клетках.Ядрышко демонстрирует сложную компартментальную организацию в интерфазе и разбирается в митозе. С помощью просвечивающей электронной микроскопии (ПЭМ) в интактных ядрышках можно наблюдать три отдельных участка: фибриллярные центры (FC), плотный фибриллярный компонент (DFC) и зернистый компонент (GC). Во время митоза GC растворяется, нарушая ядрышковую организацию, но компоненты FC и DFC поддерживают взаимодействие как диффундирующие субструктуры.
Сборка ядрышек (обзор в [8]) инициируется транскрипцией РНК-полимеразой I (РНК Pol I) кластерных генов рибосомной РНК (рРНК) (рДНК), связанных с фактором транскрипции UBF.Биогенез рибосом происходит векторно, начиная с ФК, где рДНК транскрибируется в рРНК.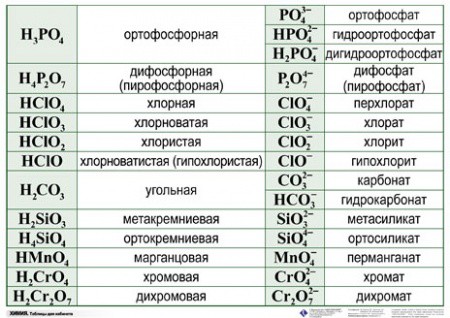 Молекулы пре-рРНК проходят через DFC, где происходит их сплайсинг и сборка малой субъединицы рибосомы, затем они перемещаются в GC, где собирается большая субъединица рибосомы. Затем прерибосомные частицы высвобождаются в нуклеоплазму и впоследствии экспортируются в цитоплазму, где собираются функциональные рибосомы.
Молекулы пре-рРНК проходят через DFC, где происходит их сплайсинг и сборка малой субъединицы рибосомы, затем они перемещаются в GC, где собирается большая субъединица рибосомы. Затем прерибосомные частицы высвобождаются в нуклеоплазму и впоследствии экспортируются в цитоплазму, где собираются функциональные рибосомы.
Р53-зависимые механизмы восприятия стресса интегрированы в ядрышко, что позволяет клетке приостановить энергозатратный процесс биогенеза рибосом в условиях, неблагоприятных для роста и пролиферации.Например, в ответ на онкогенный стресс (например, активацию Myc) Mdm2, убиквитинлигаза E3, ответственная за быстрый оборот p53, иммобилизуется в ядрышке за счет взаимодействия с p14 ARF , чтобы активировать p53 и нижестоящие клетки. Эффекторы остановки цикла [17].
Параспеклы
Параспеклы представляют собой ядерные тельца, расположенные в межхроматиновом пространстве, играющие роль в контроле экспрессии генов посредством удержания в ядре специфических молекул РНК, отмеченных аденозин-инозиновым редактированием [2]. Белки, входящие в состав параспеклов, связаны с транскрипцией и процессингом РНК РНК-полимеразой II (RNA Pol II). Семейство сплайсинговых белков DBHS, P54NRB/NONO, PSPC1, PSF/SFPQ [2, 10, 18, 19] и длинные некодирующие РНК (днРНК) NEAT1/Men ε/β и Ctn являются интегральными компоненты параспеклов [2]. Параспеклы реагируют на стресс и обмениваются компонентами с ядрышком в ответ на сигналы окружающей среды. Например, белок параспекл 1 (PSPC1) был впервые идентифицирован как ядрышковый белок; однако позднее было показано, что в условиях активной РНК-Пол II-зависимой транскрипции она разделяется на другое ядерное тело — параспеклы и ре-локализуется в ядрышко только при подавлении активности РНК-Пол II [10, 18]. ].Интересно, что эта релокализация происходит в периядрышковых чехликах, которые являются структурами, которые, по-видимому, физически связаны с ядрышками, но не интегрированы в ядрышковый матрикс [10]. Это указывает на то, что либо физические свойства PSPC1-содержащих телец и ядрышка различны, препятствуя слиянию, либо их динамическое поведение ограничено в ответ на сигналы, ингибирующие активность RNA Pol II.
Белки, входящие в состав параспеклов, связаны с транскрипцией и процессингом РНК РНК-полимеразой II (RNA Pol II). Семейство сплайсинговых белков DBHS, P54NRB/NONO, PSPC1, PSF/SFPQ [2, 10, 18, 19] и длинные некодирующие РНК (днРНК) NEAT1/Men ε/β и Ctn являются интегральными компоненты параспеклов [2]. Параспеклы реагируют на стресс и обмениваются компонентами с ядрышком в ответ на сигналы окружающей среды. Например, белок параспекл 1 (PSPC1) был впервые идентифицирован как ядрышковый белок; однако позднее было показано, что в условиях активной РНК-Пол II-зависимой транскрипции она разделяется на другое ядерное тело — параспеклы и ре-локализуется в ядрышко только при подавлении активности РНК-Пол II [10, 18]. ].Интересно, что эта релокализация происходит в периядрышковых чехликах, которые являются структурами, которые, по-видимому, физически связаны с ядрышками, но не интегрированы в ядрышковый матрикс [10]. Это указывает на то, что либо физические свойства PSPC1-содержащих телец и ядрышка различны, препятствуя слиянию, либо их динамическое поведение ограничено в ответ на сигналы, ингибирующие активность RNA Pol II.
Ядерные спеклы
Сходные по внешнему виду с параспеклами и локализованные рядом с нуклеоплазматическими интерхроматиновыми областями [3], ядерные спеклы, также называемые снурпосомами, представляют собой отдельный класс динамических органелл [1].Состав ядерных спеклов, обогащенных факторами сплайсинга пре-мРНК, такими как малые ядерные рибонуклеопротеины (мяРНП) и белки, богатые серином/аргинином (SR) [20], и поли(А) + РНК [21], как и а также их пространственная близость к сайтам активной транскрипции позволяют предположить, что они могут играть роль в регуляции экспрессии генов путем снабжения или хранения факторов, связанных со сплайсингом пре-мРНК [22].
Тельца Кахаля
Хотя роль телец Кахаля не полностью выяснена, она связана с регуляцией мяРНП и малых ядрышковых рибонуклеопротеиновых частиц (мяРНП) [4].Временные эксперименты, отслеживающие флуоресцентно меченный коилин и белки выживания моторных нейронов (SMN), два хорошо описанных маркера телец Кахаля, показали, что они представляют собой динамические структуры внутри ядра, которые подвергаются событиям слияния и деления [23].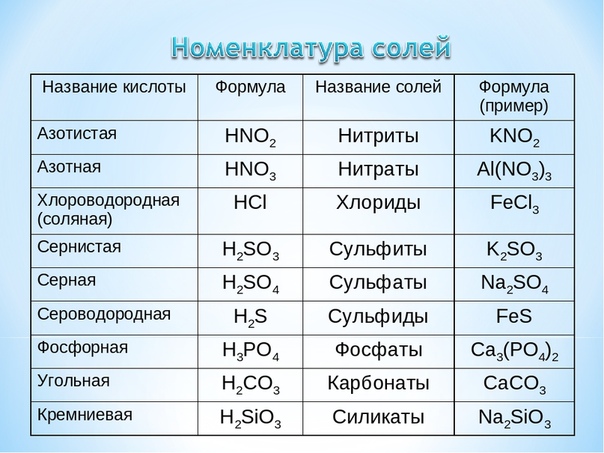 Подобно другим органеллам без ядерной мембраны, тельца Кахаля реагируют на стрессовые условия. Опухолевой супрессор р53 связывается с тельцами Кахаля в условиях УФ-облучения и хемотоксического стресса [24], а коилин ре-локализуется в ядрышковых колпачках вместе с фибрилларином и компонентами аппарата РНК Pol I [25].Кроме того, подобно ядрышку, структурная целостность телец Кахаля зависит от клеточного цикла; они интактны во время интерфазы и растворяются во время митоза [26].
Подобно другим органеллам без ядерной мембраны, тельца Кахаля реагируют на стрессовые условия. Опухолевой супрессор р53 связывается с тельцами Кахаля в условиях УФ-облучения и хемотоксического стресса [24], а коилин ре-локализуется в ядрышковых колпачках вместе с фибрилларином и компонентами аппарата РНК Pol I [25].Кроме того, подобно ядрышку, структурная целостность телец Кахаля зависит от клеточного цикла; они интактны во время интерфазы и растворяются во время митоза [26].
Тельца ПМЛ
Тельца ПМЛ локализованы преимущественно в ядре и характеризуются наличием белка промиелоцитарного лейкоза (ПМЛ). Являясь членом семейства белков TRIM, PML содержит RING-домен, два домена B-box и предсказанный спирально-спиральный домен, все из которых, как было показано, необходимы для правильной сборки тел PML.Точная роль этих органелл еще полностью не выяснена. Доказательства того, что регуляторы транскрипции, такие как p53, CBP и Daxx, являются временными мишенями и сохраняются в телах PML, позволяют предположить, что они функционируют как хранилище и, таким образом, регулируют пути, участвующие в подавлении опухоли, защите от вирусов и апоптозе [12]. Как и в случае с другими безмембранными органеллами, количество и структурная целостность телец PML зависят от фазы клеточного цикла и стрессовых стимулов [27]. В стареющих клетках тельца PML увеличиваются в размерах и ассоциируют с крышками ядрышек [28].Вновь синтезированная РНК накапливается на периферии телец ПМЛ, поддерживая роль в метаболизме РНК. Однако, в отличие от других безмембранных органелл, описанных здесь, РНК необязательна в отношении образования телец PML [29].
Как и в случае с другими безмембранными органеллами, количество и структурная целостность телец PML зависят от фазы клеточного цикла и стрессовых стимулов [27]. В стареющих клетках тельца PML увеличиваются в размерах и ассоциируют с крышками ядрышек [28].Вновь синтезированная РНК накапливается на периферии телец ПМЛ, поддерживая роль в метаболизме РНК. Однако, в отличие от других безмембранных органелл, описанных здесь, РНК необязательна в отношении образования телец PML [29].
Цитозольные безмембранные тельца
В цитоплазме также описаны динамические безмембранные органеллы. Их обычно называют гранулами мРНП, они участвуют в метаболизме мРНК и гомеостазе и включают такие структуры, как Р-тела, стрессовые гранулы и зародышевые гранулы (обзор в [13, 30]).Несколько различных типов гранул mRNP имеют общие белковые и мРНК компоненты, и было продемонстрировано, что они обладают способностью физически взаимодействовать друг с другом in vivo , подвергаясь событиям стыковки и слияния [13]. Эти наблюдения позволяют предположить, что эти безмембранные органеллы не только функционально родственны, но и при определенных условиях проявляют сходные физико-химические свойства, которые допускают их структурную смешиваемость. Основные типы гранул мРНП обсуждаются ниже.
Эти наблюдения позволяют предположить, что эти безмембранные органеллы не только функционально родственны, но и при определенных условиях проявляют сходные физико-химические свойства, которые допускают их структурную смешиваемость. Основные типы гранул мРНП обсуждаются ниже.
P-тела
Процессинговые или P-тела повсеместно распространены во всех типах клеток и содержат белки, участвующие в транспорте, модификации и трансляции мРНК (обзор в [31]). Исследования на дрожжах продемонстрировали, что делеции любого отдельного белкового компонента недостаточно для полной отмены сборки Р-тел [32], но подчеркнули важность взаимодействий, специфичных для партнеров, для накопления ряда белков в органелле [33, 34]. Например, рекрутирование фермента декапирования Dcp1 в органеллу опосредуется взаимодействиями с его кофактором Dcp2 [34], в то время как Dcp2 непосредственно взаимодействует с каркасным белком Edc3 [33, 34].Как и в случае с другими безмембранными органеллами, РНК играет центральную роль в сборке Р-телец. Повышенные уровни нетранслируемой мРНК, достигаемые ингибированием инициации трансляции или стрессом, коррелируют с увеличением размера и количества Р-телец [35]. Наоборот, захват мРНК в полисомы за счет ингибирования стадии элонгации или ферментативной деградации мРНК коррелирует с растворением Р-телец [31, 35].
Повышенные уровни нетранслируемой мРНК, достигаемые ингибированием инициации трансляции или стрессом, коррелируют с увеличением размера и количества Р-телец [35]. Наоборот, захват мРНК в полисомы за счет ингибирования стадии элонгации или ферментативной деградации мРНК коррелирует с растворением Р-телец [31, 35].
Стрессовые гранулы
Стрессовые гранулы, как следует из названия, собираются в ответ на сигналы стресса для секвестрации транскрипционно молчащих молекул мРНК и транскрипционных факторов (обзор в [30]).Факторы инициации трансляции и компоненты малой субъединицы рибосомы входят в число белков, содержащихся в стрессовых гранулах [13]. Удаление стрессовых сигналов и повторная инициация трансляции мРНК вызывает разборку стрессовых гранул [36]. Как и в случае с P-тельцами, секвестрация нетранслируемых молекул мРНК в полисомах ингибирует образование стрессовых гранул [36], что свидетельствует о том, что мРНК необходима для их сборки. P-тела и стрессовые гранулы в дрожжах демонстрируют широкое перекрытие по составу, но разные физические свойства [37]. Более того, штаммы дрожжей, дефицитные по образованию P-телец, также неспособны эффективно образовывать стрессовые гранулы. На формирование Р-тел дрожжей не влияли мутантные штаммы с дефицитом сборки стрессовых гранул. В совокупности эти наблюдения показали, что предварительная сборка комплексов мРНК/белок в P-тельцах является предпосылкой для образования стрессовых гранул [32], подчеркивая функциональную связь между двумя типами безмембранных органелл.
Более того, штаммы дрожжей, дефицитные по образованию P-телец, также неспособны эффективно образовывать стрессовые гранулы. На формирование Р-тел дрожжей не влияли мутантные штаммы с дефицитом сборки стрессовых гранул. В совокупности эти наблюдения показали, что предварительная сборка комплексов мРНК/белок в P-тельцах является предпосылкой для образования стрессовых гранул [32], подчеркивая функциональную связь между двумя типами безмембранных органелл.
Зародышевые гранулы
Термин зародышевые гранулы включает класс немембранных органелл, обнаруженных в специализированных зародышевых клетках, которые генерируют половые клетки при мейозе в развивающемся эмбрионе и называются Р-гранулами, зародышевыми тельцами или Nuage тела в зависимости от организма происхождения (обзор в [38]).Значительные успехи были достигнуты в понимании как биологии, так и биофизики Р-гранул у нематоды C. elegans. Р-гранулы обогащены мРНК, РНК-хеликазами и РНК-модифицирующими ферментами и участвуют в посттранскрипционной регуляции мРНК в примордиальных зародышевых клетках [38]. Например, РНК nos-2 асимметрично расщепляется во время развития личинок C. elegans [39]. P-тельца физически стыкуются, но не сливаются с зародышевыми гранулами у эмбрионов C. elegans .Эта физическая ассоциация между двумя типами органелл позволяет P-тельцам сегрегировать внутри бластомера зародышевой линии, свойство, заимствованное у зародышевых гранул. Более того, эти P-тельца, которые связаны с гранулами зародыша, не могут созревать в органеллы, которые разрушают мРНК [40]. В совокупности эти наблюдения иллюстрируют, как различные физико-химические свойства сохраняют целостность органелл, и предполагают взаимодействие между органеллами как новый механизм регуляции функции.
Например, РНК nos-2 асимметрично расщепляется во время развития личинок C. elegans [39]. P-тельца физически стыкуются, но не сливаются с зародышевыми гранулами у эмбрионов C. elegans .Эта физическая ассоциация между двумя типами органелл позволяет P-тельцам сегрегировать внутри бластомера зародышевой линии, свойство, заимствованное у зародышевых гранул. Более того, эти P-тельца, которые связаны с гранулами зародыша, не могут созревать в органеллы, которые разрушают мРНК [40]. В совокупности эти наблюдения иллюстрируют, как различные физико-химические свойства сохраняют целостность органелл, и предполагают взаимодействие между органеллами как новый механизм регуляции функции.
Гранулы мРНП при нейродегенеративных заболеваниях
Ослабляющие нейродегенеративные заболевания, такие как боковой амиотрофический склероз (БАС), мультисистемная протеинопатия (МСП) и лобно-височная долевая дегенерация (ЛВЛД), характеризуются образованием патологических включений мРНП и нарушением нормального метаболизма мРНК (рассмотрено в [41]).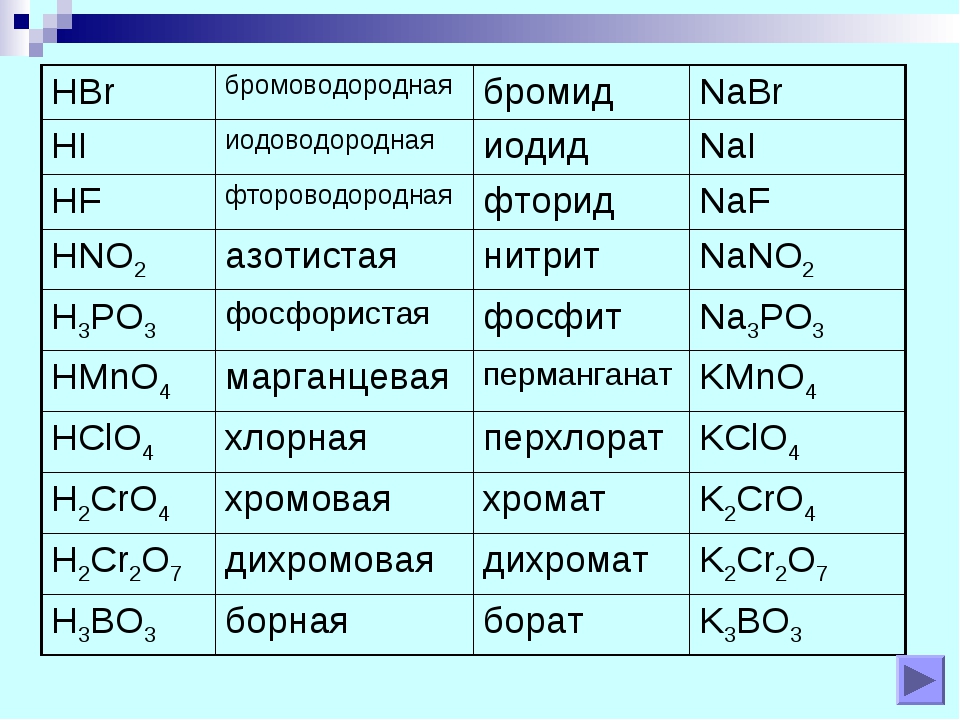 Эти патологические включения образуются за счет агрегации белков, находящихся в эндогенных гранулах мРНП. Интересно, что многие белки, ассоциированные с патологическими включениями, содержат в своей аминокислотной последовательности прионоподобный домен, который способствует их сборке в амилоидоподобные фибриллы.Несколько белков, о которых известно, что они локализуются внутри стрессовых гранул, включая FUS [42], hnRNPA1 [43–45] и hnRNPA2 [43], были обнаружены в патологических включениях, связанных с БАС. Интересно, что образование фибрилл этими белками способствует микроокружению стрессовых гранул, где достигаются высокие локальные концентрации белка [37, 42, 44, 45]. Более того, генетические мутации в прионоподобных доменах этих белков, которые, как известно, связаны с ALS, ускоряют образование амилоидоподобных фибрилл и ингибируют клиренс стрессовых гранул in vivo , тем самым нарушая гомеостаз мРНК [41-44].Эти находки предполагают, что очень плотное окружение гранул mRNP облегчает образование фибрилл белками, отмеченными выше, особенно когда их склонность к агрегации усиливается мутацией.
Эти патологические включения образуются за счет агрегации белков, находящихся в эндогенных гранулах мРНП. Интересно, что многие белки, ассоциированные с патологическими включениями, содержат в своей аминокислотной последовательности прионоподобный домен, который способствует их сборке в амилоидоподобные фибриллы.Несколько белков, о которых известно, что они локализуются внутри стрессовых гранул, включая FUS [42], hnRNPA1 [43–45] и hnRNPA2 [43], были обнаружены в патологических включениях, связанных с БАС. Интересно, что образование фибрилл этими белками способствует микроокружению стрессовых гранул, где достигаются высокие локальные концентрации белка [37, 42, 44, 45]. Более того, генетические мутации в прионоподобных доменах этих белков, которые, как известно, связаны с ALS, ускоряют образование амилоидоподобных фибрилл и ингибируют клиренс стрессовых гранул in vivo , тем самым нарушая гомеостаз мРНК [41-44].Эти находки предполагают, что очень плотное окружение гранул mRNP облегчает образование фибрилл белками, отмеченными выше, особенно когда их склонность к агрегации усиливается мутацией.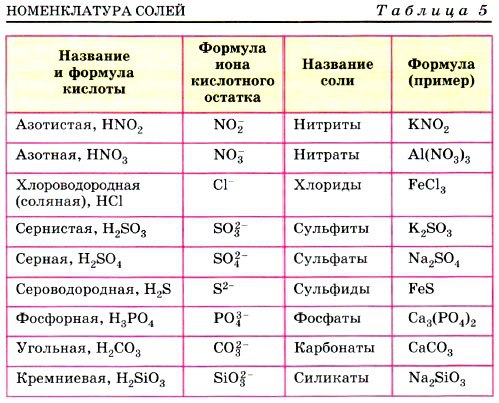 Кроме того, эти исследования устанавливают корреляцию между ассоциированными с БАС мутациями в белках гранул мРНП и повышенным образованием фибрилл и измененным метаболизмом мРНК. Однако необходимы дополнительные исследования, чтобы понять, как эти изменения в структуре и функции гранул мРНП связаны с нейропатогенезом.
Кроме того, эти исследования устанавливают корреляцию между ассоциированными с БАС мутациями в белках гранул мРНП и повышенным образованием фибрилл и измененным метаболизмом мРНК. Однако необходимы дополнительные исследования, чтобы понять, как эти изменения в структуре и функции гранул мРНП связаны с нейропатогенезом.
В следующем разделе мы обсудим общие физико-химические особенности безмембранных органелл и объединяющие механистические идеи, описывающие их сборку в многокомпонентные плотные фазы.
Общие черты безмембранных органелл
Отличительной особенностью безмембранных органелл, описанных выше, является то, что их состав и физические свойства варьируются в зависимости от клеточных факторов, таких как стадия клеточного цикла, стимулы роста и стрессовые условия. Кроме того, они обладают динамическими структурными особенностями.Brangwynne и коллеги продемонстрировали, что ядрышки [5] и P-гранулы [6] проявляют жидкоподобное поведение in vivo и что эта организация жидкости возникает из-за фазового разделения их молекулярных компонентов.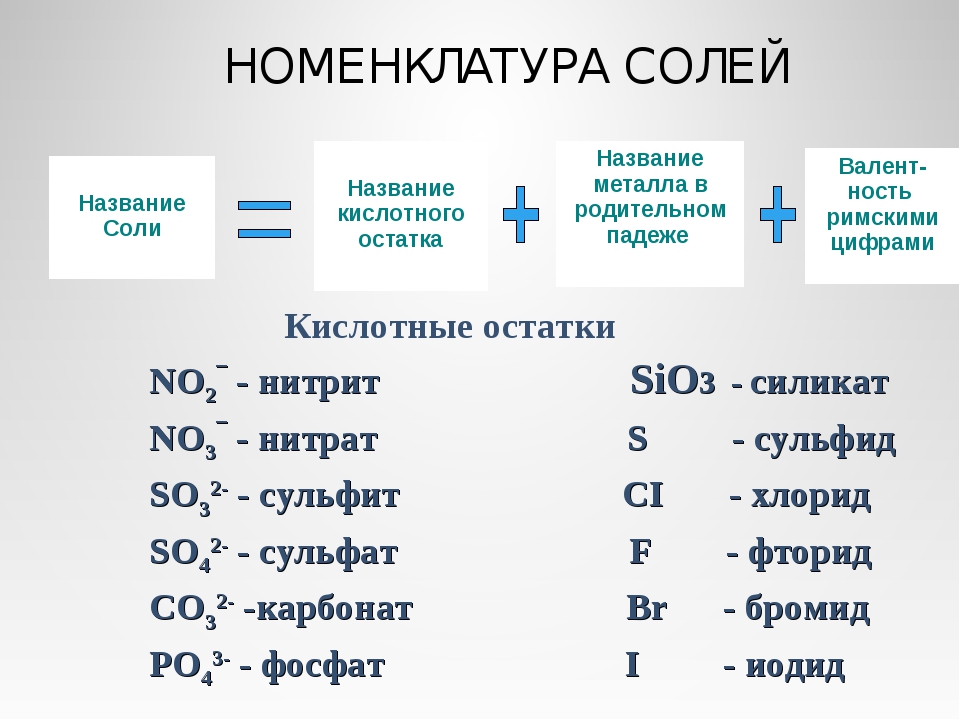 Эта концепция подтверждается растущим объемом данных, идентифицирующих белки, иногда смешанные с нуклеиновыми кислотами, которые разделяют in vitro на плотные жидкоподобные [46–49] или гидрогелевые [50, 51] структуры (обзор в [ 52]). Белки и нуклеиновые кислоты концентрируются ~ 10-100 раз в плотной фазе [46, 48], где они могут достигать концентрации в миллимолярном диапазоне [53]; разбавленную фазу поддерживают при критической концентрации разделения фаз.Экспериментально два физических состояния, жидкость и гидрогель, отличаются своей способностью течь, когда их поверхности подвергаются напряжению сдвига. Жидкоподобные свойства безмембранных органелл и in vitro разделенных фаз белков и капель белка/РНК были продемонстрированы на основе измерений их вязкоупругих свойств [5, 6, 44, 47, 54, 55]. Например, жидкоподобные Р-тельца [37] и Р-гранулы [6] принимали сферическую форму в цитоплазме, которая регулировалась поверхностным натяжением, сливались и сливались в более крупные капли, которые возвращались к сферической форме.
Эта концепция подтверждается растущим объемом данных, идентифицирующих белки, иногда смешанные с нуклеиновыми кислотами, которые разделяют in vitro на плотные жидкоподобные [46–49] или гидрогелевые [50, 51] структуры (обзор в [ 52]). Белки и нуклеиновые кислоты концентрируются ~ 10-100 раз в плотной фазе [46, 48], где они могут достигать концентрации в миллимолярном диапазоне [53]; разбавленную фазу поддерживают при критической концентрации разделения фаз.Экспериментально два физических состояния, жидкость и гидрогель, отличаются своей способностью течь, когда их поверхности подвергаются напряжению сдвига. Жидкоподобные свойства безмембранных органелл и in vitro разделенных фаз белков и капель белка/РНК были продемонстрированы на основе измерений их вязкоупругих свойств [5, 6, 44, 47, 54, 55]. Например, жидкоподобные Р-тельца [37] и Р-гранулы [6] принимали сферическую форму в цитоплазме, которая регулировалась поверхностным натяжением, сливались и сливались в более крупные капли, которые возвращались к сферической форме. Кроме того, Р-гранулы обратимо деформировались при столкновении с физическим барьером (, т.е. «капала» на поверхность ядра) [6]. Напротив, гидрогели не проявляют текучести в стационарных условиях [50, 51, 56]. Микрореологический анализ показал, что жидкоподобные безмембранные органеллы [5, 6] и капли белков и белков/РНК, приготовленные in vitro , характеризуются высокой вязкостью. Поразительно, но измеренные значения вязкости варьируются в широких пределах, в диапазоне трех порядков, от ~ 1 Па · с для P-гранул до ~ 10 3 Па · с для ядрышек [5, 6, 47, 54, 55]. ].Хотя это и не обязательно является прямым индикатором жидкоподобного поведения, макромолекулы внутри безмембранных органелл ([7, 37, 44, 46]) и жидкоподобные капли [42, 44, 46, 53, 55] восстанавливаются после фотообесцвечивания на шкала времени от секунд до десятков секунд. Это свидетельствует о быстром обмене молекулами внутри жидкоподобной фазы или с окружающей средой при фотообесцвечивании объекта частично или полностью соответственно.
Кроме того, Р-гранулы обратимо деформировались при столкновении с физическим барьером (, т.е. «капала» на поверхность ядра) [6]. Напротив, гидрогели не проявляют текучести в стационарных условиях [50, 51, 56]. Микрореологический анализ показал, что жидкоподобные безмембранные органеллы [5, 6] и капли белков и белков/РНК, приготовленные in vitro , характеризуются высокой вязкостью. Поразительно, но измеренные значения вязкости варьируются в широких пределах, в диапазоне трех порядков, от ~ 1 Па · с для P-гранул до ~ 10 3 Па · с для ядрышек [5, 6, 47, 54, 55]. ].Хотя это и не обязательно является прямым индикатором жидкоподобного поведения, макромолекулы внутри безмембранных органелл ([7, 37, 44, 46]) и жидкоподобные капли [42, 44, 46, 53, 55] восстанавливаются после фотообесцвечивания на шкала времени от секунд до десятков секунд. Это свидетельствует о быстром обмене молекулами внутри жидкоподобной фазы или с окружающей средой при фотообесцвечивании объекта частично или полностью соответственно.
Безмембранные органеллы имеют состав различной сложности.Например, Р-гранулы состоят примерно из 40 белков [57], в то время как масс-спектрометрия показала, что ядрышки человека содержат около 4500 белков [58]. Кроме того, белковый состав безмембранных органелл может варьироваться в зависимости от клеточных условий. Примечательно, что протеом ядрышка значительно изменяется в условиях стресса, и эти изменения специфичны для определенных форм стресса [59, 60]. Эти наблюдения поднимают два важных вопроса: (1) как достигается специфический молекулярный состав безмембранных органелл и (2) как регулируется их состав в ответ на стрессовые сигналы ? В следующем разделе мы рассмотрим молекулярные принципы, лежащие в основе фазового разделения и структурной организации безмембранных органелл.Мы также обсуждаем текущие данные, которые предполагают, как регулируются их динамическая структура и состав.
Структурные и композиционные особенности белков, находящихся в составе безмембранных органелл
Результаты исследований по нокдауну и нокауту [32, 39, 61–63] показали, что структурная целостность некоторых безмембранных органелл зависит от гетерогенных взаимодействий среди множества компонентов. Нокдаун или генетическая делеция отдельных белков, таких как NPM1 [61] или нуклеолин [62] в ядрышке или PGL-1 и PGL-3 [63] в гранулах зародыша, изменяет морфологию органеллы, но не предотвращает появление других, неизмененных органелл. компоненты от сборки в точечные структуры.Эти наблюдения согласуются с избыточностью признаков последовательности белков, обнаруженных в различных безмембранных органеллах (таблица 1).
Нокдаун или генетическая делеция отдельных белков, таких как NPM1 [61] или нуклеолин [62] в ядрышке или PGL-1 и PGL-3 [63] в гранулах зародыша, изменяет морфологию органеллы, но не предотвращает появление других, неизмененных органелл. компоненты от сборки в точечные структуры.Эти наблюдения согласуются с избыточностью признаков последовательности белков, обнаруженных в различных безмембранных органеллах (таблица 1).
Основные принципы разделения фаз полимерами; от химических полимеров к белкам
Разделение фаз органических полимеров в растворе широко изучалось и может быть описано с помощью упрощенных математических термодинамических моделей.Теория Флори-Хаггинса описывает свободную энергию смешивания полимера с растворителем, где полимеры рассматриваются как упрощенные массивы модулей, которые представляют их повторяющиеся сегменты. Разделение фаз жидкость-жидкость на богатую полимером фазу и фазу с низким содержанием полимера происходит при пересечении критического порога концентрации или температуры, после чего полимер становится лучшим растворителем для самого себя, чем буфер, в котором он растворен (обзор в [64]. ]; Рисунок 1).
]; Рисунок 1).
Конденсация макромолекул способствует образованию безмембранных органелл.Безмембранные органеллы представляют собой динамические структуры, образованные с помощью механизма разделения фаз, подобного полимерной конденсации, и зависящего от концентрации механизма разделения фаз. Порог критической концентрации ( серая линия ) для разделения фаз можно настроить в диапазоне концентраций ( заштрихованная зеленая рамка ) посредством физико-химических изменений в системе (, т.е. посттрансляционных модификаций доменов и/или мотивов, которые изменяют сродство их взаимодействий, изменения температуры, изменяют ионную силу и т. д.). Эти изменения могут привести к фазовому разделению и сборке безмембранных органелл или их разборке
Розен и его коллеги сообщили, что мультивалентные повторяющиеся домены двух сигнальных белков, регулирующих полимеризацию актина, NCK и N-WASP, разделяют фазы in vitro и что порог разделения фаз зависит от концентрации белка и валентности каждого отдельного партнера по взаимодействию [].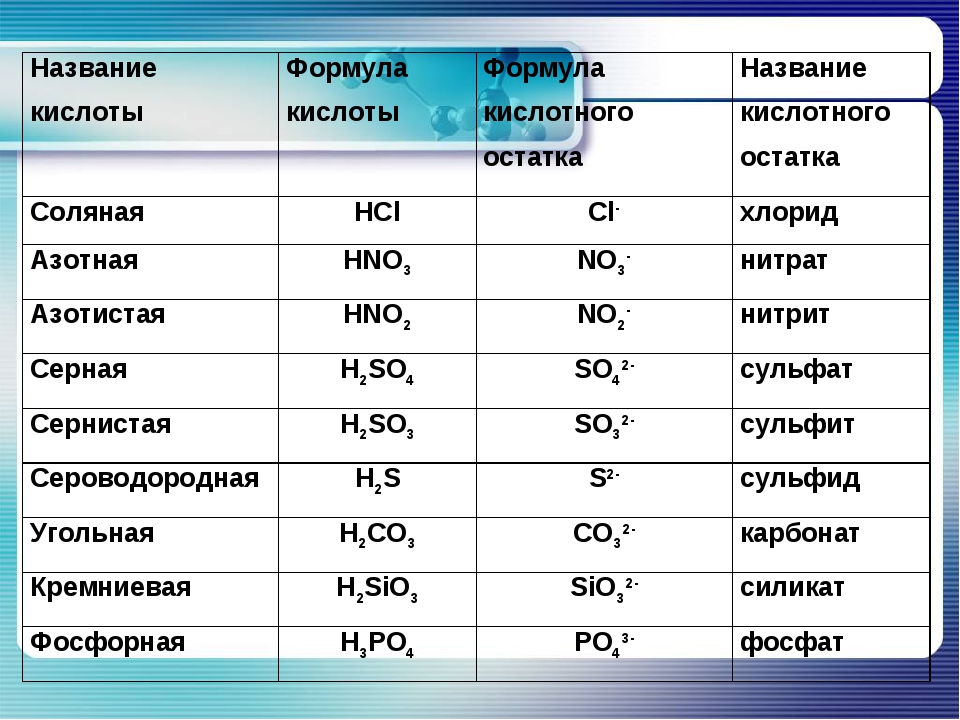 46]. Используя упрощенное представление белка, подобное тому, которое используется для органических полимеров, авторы использовали адаптацию формализма Флори-Хаггинса для описания поведения фазового перехода бинарной системы NCK/N-WASP.Модель включала четыре параметра: параметры ассоциации/диссоциации, коэффициенты диффузии и скученности. Качественно этот формализм, предполагающий структурную разобщенность между отдельными связывающими доменами, предсказал влияние различной валентности на концентрационный порог фазового разделения [46]. Подобная адаптация этой модели была использована для описания фазового разделения мономолекулярной РНК-хеликазы Ddx4 [48]. Хотя общая феноменология может быть описана с помощью этой упрощенной модели, недавний отчет о бинарной системе NCK/N-WASP продемонстрировал, что заряженные остатки в неупорядоченном линкере, соединяющем модули связывания домена Sh4, вызывают слабую самоассоциацию NCK и снижение критической концентрации. для разделения фаз [65] (рис.
46]. Используя упрощенное представление белка, подобное тому, которое используется для органических полимеров, авторы использовали адаптацию формализма Флори-Хаггинса для описания поведения фазового перехода бинарной системы NCK/N-WASP.Модель включала четыре параметра: параметры ассоциации/диссоциации, коэффициенты диффузии и скученности. Качественно этот формализм, предполагающий структурную разобщенность между отдельными связывающими доменами, предсказал влияние различной валентности на концентрационный порог фазового разделения [46]. Подобная адаптация этой модели была использована для описания фазового разделения мономолекулярной РНК-хеликазы Ddx4 [48]. Хотя общая феноменология может быть описана с помощью этой упрощенной модели, недавний отчет о бинарной системе NCK/N-WASP продемонстрировал, что заряженные остатки в неупорядоченном линкере, соединяющем модули связывания домена Sh4, вызывают слабую самоассоциацию NCK и снижение критической концентрации. для разделения фаз [65] (рис. 1). Таким образом, теория Флори-Хаггинса описывает основное поведение разделения фаз бимолекулярных и мономолекулярных белковых систем. Однако сложность последовательностей белковых полимеров, в отличие от композиционно более простых химических полимеров, дает возможность дополнительных межмолекулярных взаимодействий, способных «настроить» явление фазового разделения. Эти результаты обеспечивают основу для понимания поведения фазового разделения более сложных систем in vitro в будущем.Кроме того, они обеспечивают основу для углубленного изучения поведения безмембранных органелл в клетках.
1). Таким образом, теория Флори-Хаггинса описывает основное поведение разделения фаз бимолекулярных и мономолекулярных белковых систем. Однако сложность последовательностей белковых полимеров, в отличие от композиционно более простых химических полимеров, дает возможность дополнительных межмолекулярных взаимодействий, способных «настроить» явление фазового разделения. Эти результаты обеспечивают основу для понимания поведения фазового разделения более сложных систем in vitro в будущем.Кроме того, они обеспечивают основу для углубленного изучения поведения безмембранных органелл в клетках.
Белковые элементы, связанные с фазовым разделением; последовательности низкой сложности и складчатые домены
Белки, ассоциированные с безмембранными органеллами, часто проявляют поливалентные свойства, которые структурно проявляются по-разному. Свернутые домены представляют собой белковые сегменты, которые принимают дискретные и стабильные вторичные и третичные структуры. Неупорядоченные области, также называемые внутренне неупорядоченными белковыми областями (IDR), представляют собой белковые сегменты, которые не принимают стабильной вторичной и третичной структуры и являются конформационно гетерогенными и динамичными. Некоторые белки внутри безмембранных органелл содержат свернутые домены, но также могут содержать IDR, в то время как другие полностью неупорядочены (называемые внутренне неупорядоченными белками или IDP). Подмножество неупорядоченных белковых областей, называемых областями низкой сложности, демонстрируют композиционное смещение в сторону небольшого набора аминокислот. Интересно, что последовательности низкой сложности и беспорядок [47, 48, 50, 56] чрезмерно представлены в белках, которые, как показано, разделяют фазы in vitro . Эти особенности обеспечивают высокую степень конформационной гибкости, которая необходима для того, чтобы события связывания оставались несвязанными [46].ЯМР-анализ белков в жидкоподобной фазе после разделения фаз не дает доказательств фолдинга при связывании, что позволяет предположить, что неупорядоченные области низкой сложности сохраняют свою конформационную гибкость в жидкоподобной фазе [48, 53]. Однако детальная интерпретация этих данных осложняется возможностью организационной гетерогенности белковых молекул снаружи и, возможно, внутри жидкоподобных капель, а также влиянием межмолекулярных взаимодействий и кажущегося размера молекулы на ширину и интенсивность резонансных линий.
Некоторые белки внутри безмембранных органелл содержат свернутые домены, но также могут содержать IDR, в то время как другие полностью неупорядочены (называемые внутренне неупорядоченными белками или IDP). Подмножество неупорядоченных белковых областей, называемых областями низкой сложности, демонстрируют композиционное смещение в сторону небольшого набора аминокислот. Интересно, что последовательности низкой сложности и беспорядок [47, 48, 50, 56] чрезмерно представлены в белках, которые, как показано, разделяют фазы in vitro . Эти особенности обеспечивают высокую степень конформационной гибкости, которая необходима для того, чтобы события связывания оставались несвязанными [46].ЯМР-анализ белков в жидкоподобной фазе после разделения фаз не дает доказательств фолдинга при связывании, что позволяет предположить, что неупорядоченные области низкой сложности сохраняют свою конформационную гибкость в жидкоподобной фазе [48, 53]. Однако детальная интерпретация этих данных осложняется возможностью организационной гетерогенности белковых молекул снаружи и, возможно, внутри жидкоподобных капель, а также влиянием межмолекулярных взаимодействий и кажущегося размера молекулы на ширину и интенсивность резонансных линий.
Многовалентные взаимодействия, вероятно, вносят вклад в динамические, жидкоподобные свойства мономолекулярных ансамблей с разделением фаз [47, 48], а также более сложных ансамблей [46, 49]. Среди белков, связанных с фазовым разделением в безмембранных органеллах, мультивалентность достигается за счет повторяющегося отображения двух типов белковых модулей: i) складчатых доменов и ii) неупорядоченных сегментов низкой сложности (обобщено в таблицах 1 и 2; рис. 2). Исследования in vitro показали, что один из двух типов поливалентности необходим и достаточен для разделения белковых фаз.Концентрации белка, связанные с фазовым разделением, варьировались на несколько порядков для разных систем, от субмикромолярных [44, 47] до сотен микромолярных [44, 46, 48, 53]. Безмембранные органеллы представляют собой многокомпонентные системы, и их сборка, как показано для ядрышка, зависит от суммарной концентрации их составляющих [66]. Учитывая отмеченные выше наблюдения о том, что накопление компонентов с ядрышками носит временной характер (обзор в [8]) и происходит в заранее сформированных ядрышковых организующих областях (ЯОР), возникает важный вопрос. Являются ли некоторые компоненты более важными, чем другие, для инициирования процесса фазового разделения с образованием безмембранных органелл? Учитывая большие различия в критической концентрации, измеренной для различных систем, один из возможных ответов состоит в том, что компоненты с самой низкой критической концентрацией фазы разделяются первыми, таким образом увеличивая локальную концентрацию выше критической концентрации для фазового разделения других компонентов, которые впоследствии включаются в плотную фазу. фаза. Сообщалось, что как свернутые домены, так и неупорядоченные/низкосложные области инициируют фазовое разделение in vitro и in cellulo. Свернутые домены часто участвуют в специфических взаимодействиях белок-нуклеиновая кислота [67-69] и белок-белок [19, 70] и могут служить организационным каркасом для сборки безмембранной органеллы. С другой стороны, домены низкой сложности предоставляют средства для более динамичного взаимодействия с потенциально более широким кругом партнеров по связыванию (рис.
Являются ли некоторые компоненты более важными, чем другие, для инициирования процесса фазового разделения с образованием безмембранных органелл? Учитывая большие различия в критической концентрации, измеренной для различных систем, один из возможных ответов состоит в том, что компоненты с самой низкой критической концентрацией фазы разделяются первыми, таким образом увеличивая локальную концентрацию выше критической концентрации для фазового разделения других компонентов, которые впоследствии включаются в плотную фазу. фаза. Сообщалось, что как свернутые домены, так и неупорядоченные/низкосложные области инициируют фазовое разделение in vitro и in cellulo. Свернутые домены часто участвуют в специфических взаимодействиях белок-нуклеиновая кислота [67-69] и белок-белок [19, 70] и могут служить организационным каркасом для сборки безмембранной органеллы. С другой стороны, домены низкой сложности предоставляют средства для более динамичного взаимодействия с потенциально более широким кругом партнеров по связыванию (рис. 2). Об убедительном примере такого синергетического взаимодействия между поливалентными уложенными доменами и их соответствующими соединяющими гибкими линкерами сообщили Bajade et al., по системе Nck/N-WASP/нефрин [65]. Конструкции Nck, которые являются двухвалентными в мотивах Sh4, связываются с мотивами PRM в N-WASP с микромолярной или миллимолярной аффинностью и подвергаются фазовому разделению. Посредством слабых, в основном электростатических взаимодействий, неупорядоченный линкер, соединяющий домены Sh4 в Nck, способствует самосборке, эффективно снижая критическую концентрацию для разделения фаз. Кроме того, добавление неупорядоченной области Nephrin, содержащей несколько остатков фосфотирозина, которые связываются со свернутым доменом Sh3 в Nck, усиливает мультивалентные взаимодействия и дополнительно снижает критическую концентрацию для разделения фаз.Таким образом, многовалентное отображение свернутых доменов и последовательностей низкой сложности с неупорядоченными областями внутри белков обеспечивает синергизм между различными компонентами сложных жидкоподобных капель.
2). Об убедительном примере такого синергетического взаимодействия между поливалентными уложенными доменами и их соответствующими соединяющими гибкими линкерами сообщили Bajade et al., по системе Nck/N-WASP/нефрин [65]. Конструкции Nck, которые являются двухвалентными в мотивах Sh4, связываются с мотивами PRM в N-WASP с микромолярной или миллимолярной аффинностью и подвергаются фазовому разделению. Посредством слабых, в основном электростатических взаимодействий, неупорядоченный линкер, соединяющий домены Sh4 в Nck, способствует самосборке, эффективно снижая критическую концентрацию для разделения фаз. Кроме того, добавление неупорядоченной области Nephrin, содержащей несколько остатков фосфотирозина, которые связываются со свернутым доменом Sh3 в Nck, усиливает мультивалентные взаимодействия и дополнительно снижает критическую концентрацию для разделения фаз.Таким образом, многовалентное отображение свернутых доменов и последовательностей низкой сложности с неупорядоченными областями внутри белков обеспечивает синергизм между различными компонентами сложных жидкоподобных капель. Подобная синергия между мультивалентными компонентами, вероятно, способствует образованию безмембранных органелл в клетках.
Подобная синергия между мультивалентными компонентами, вероятно, способствует образованию безмембранных органелл в клетках.
Молекулярная основа для сборки безмембранных органелл.Белки, обогащенные матрицами безмембранных органелл, обычно имеют множественные модули, которые создают мультивалентность, включая свернутые связывающие домены (, красный ) и области низкой сложности (, фиолетовый, ). Валентность часто усиливается доменами, которые обеспечивают гомо- или гетероолигомеризацию ( оранжевый ). Взаимодействия между белками, содержащими разные комбинации этих модулей взаимодействия, обеспечивают основу для построения гетерогенной, бесконечно расширяемой сети внутри безмембранных органелл.Формирование такого типа сети приводит к фазовому расслоению при достижении порога критической концентрации. Для многих обсуждаемых здесь примеров активная транскрипция РНК необходима для сборки безмембранных органелл. Мы предполагаем, что экспрессия РНК, превышающая порог критической концентрации, необходима для зародышеобразования взаимодействий со специфическими мультимодульными белками и для зародышеобразования безмембранных органелл. Сигналы стресса могут изменить мультивалентные взаимодействия, которые приводят к фазовому разделению и привести к частичной или полной разборке органеллы
Для многих обсуждаемых здесь примеров активная транскрипция РНК необходима для сборки безмембранных органелл. Мы предполагаем, что экспрессия РНК, превышающая порог критической концентрации, необходима для зародышеобразования взаимодействий со специфическими мультимодульными белками и для зародышеобразования безмембранных органелл. Сигналы стресса могут изменить мультивалентные взаимодействия, которые приводят к фазовому разделению и привести к частичной или полной разборке органеллы
События инициации сборки безмембранных органелл
Многие белки, участвующие в формировании безмембранных органелл, имеют сегменты с признаками последовательности низкой сложности, часто содержащие множественные мотивы, обогащенные аминокислотами аргинином, серином, глицином, глутамин, аспарагин и/или ароматические остатки (таблицы 1 и 2).Однако, несмотря на низкую сложность их последовательностей, эти белки часто связаны со специфическими безмембранными органеллами. Что лежит в основе включения конкретных белков и молекул нуклеиновых кислот в определенные безмембранные органеллы? Появляющееся решение этой головоломки, по крайней мере в некоторых случаях, заключается в том, что специфические взаимодействия белок-нуклеиновая кислота или белок-белок инициируют сборку безмембранных органелл, которые затем создают микроокружение, способствующее фазовому разделению дополнительных компонентов (рис. .2). Эта концепция была описана для ядрышка, который собирается вокруг NOR, стабильных ядрышковых предшественников, состоящих из сгруппированных массивов (, т.е. поливалентность ) генов рРНК, связанных с фактором транскрипции UBF [71]. Примечательно, что UBF содержит массив из шести бокс-доменов HMG, которые демонстрируют широкий диапазон аффинностей связывания с ДНК [69]. РНК Pol I рекрутируется на NOR для транскрипции пре-рРНК, которая инициирует сборку ядрышка. В случае зародышевых гранул [63] и телец PML [12] их образование инициируется самоассоциацией спиральных доменов белков PGL-1/3 и PML соответственно.
Что лежит в основе включения конкретных белков и молекул нуклеиновых кислот в определенные безмембранные органеллы? Появляющееся решение этой головоломки, по крайней мере в некоторых случаях, заключается в том, что специфические взаимодействия белок-нуклеиновая кислота или белок-белок инициируют сборку безмембранных органелл, которые затем создают микроокружение, способствующее фазовому разделению дополнительных компонентов (рис. .2). Эта концепция была описана для ядрышка, который собирается вокруг NOR, стабильных ядрышковых предшественников, состоящих из сгруппированных массивов (, т.е. поливалентность ) генов рРНК, связанных с фактором транскрипции UBF [71]. Примечательно, что UBF содержит массив из шести бокс-доменов HMG, которые демонстрируют широкий диапазон аффинностей связывания с ДНК [69]. РНК Pol I рекрутируется на NOR для транскрипции пре-рРНК, которая инициирует сборку ядрышка. В случае зародышевых гранул [63] и телец PML [12] их образование инициируется самоассоциацией спиральных доменов белков PGL-1/3 и PML соответственно. В этих примерах структурированные домены опосредуют специфические взаимодействия с образованием ансамблей, которые служат каркасами для дальнейшей сборки компонентов безмембранных органелл. Некоторые из белков, способствующих сборке, содержат как структурированные домены, так и сегменты низкой сложности, обеспечивающие мультивалентные взаимодействия. Таким образом, образование безмембранных органелл может включать иерархическую сборку специфических белково-нуклеиновых кислотных комплексов с более высоким сродством с последующим набором дополнительных компонентов посредством более слабых поливалентных взаимодействий.
В этих примерах структурированные домены опосредуют специфические взаимодействия с образованием ансамблей, которые служат каркасами для дальнейшей сборки компонентов безмембранных органелл. Некоторые из белков, способствующих сборке, содержат как структурированные домены, так и сегменты низкой сложности, обеспечивающие мультивалентные взаимодействия. Таким образом, образование безмембранных органелл может включать иерархическую сборку специфических белково-нуклеиновых кислотных комплексов с более высоким сродством с последующим набором дополнительных компонентов посредством более слабых поливалентных взаимодействий.
Сборочное поведение белков, ассоциированных с параспеклами, дает еще один пример того, как события инициации могут обеспечивать рекрутирование компонентов внутри безмембранной органеллы. Бонд и его коллеги использовали рентгеновскую кристаллографию и малоугловое рассеяние рентгеновских лучей (SAXS) для изучения полимеризации семейства факторов сплайсинга DBHS, локализованных и обогащенных параспеклами [19, 70]. Мотивы удлиненного спирального взаимодействия в домене полимеризации этих белков обеспечивают структурную основу для образования удлиненных полимеров неопределенной длины.Слабые полярные контакты стабилизируют взаимодействие спираль-спираль и считаются полезными для поддержания растворимости непарных вытянутых спиральных структур [70]. Валентность молекулярной сборки повышается за счет дополнительного домена димеризации, который обеспечивает гомо- и гетеродимеризацию между белками семейства DBHS, такими как PSPC1 и NONO [19] или SFPQ и NONO [70]. Кроме того, поливалентные взаимодействия с РНК опосредованы тандемными доменами RRM, присутствующими в NONO, PSPC1 и SFPQ [19, 70].Эти исследования иллюстрируют, как модульные поливалентные белки могут опосредовать образование гетерогенных динамических молекулярных ансамблей, тем самым обеспечивая структурную основу для образования безмембранной органеллы (рис. 2).
Мотивы удлиненного спирального взаимодействия в домене полимеризации этих белков обеспечивают структурную основу для образования удлиненных полимеров неопределенной длины.Слабые полярные контакты стабилизируют взаимодействие спираль-спираль и считаются полезными для поддержания растворимости непарных вытянутых спиральных структур [70]. Валентность молекулярной сборки повышается за счет дополнительного домена димеризации, который обеспечивает гомо- и гетеродимеризацию между белками семейства DBHS, такими как PSPC1 и NONO [19] или SFPQ и NONO [70]. Кроме того, поливалентные взаимодействия с РНК опосредованы тандемными доменами RRM, присутствующими в NONO, PSPC1 и SFPQ [19, 70].Эти исследования иллюстрируют, как модульные поливалентные белки могут опосредовать образование гетерогенных динамических молекулярных ансамблей, тем самым обеспечивая структурную основу для образования безмембранной органеллы (рис. 2).
Силы, опосредующие взаимодействия, связанные с фазовым разделением белков
Как обсуждалось выше, белки, подвергающиеся фазовому разделению, обычно содержат сегменты с низкой сложностью последовательности. Кроме того, эти области часто обогащены заряженными и ароматическими аминокислотами, что подчеркивает важность электростатических и гидрофобных взаимодействий в процессе фазового разделения.Например, неупорядоченные сегменты хеликаз DEAD-box Ddx4 [48] и LAF-1 [47], а также hnRNPA1 [44], которые опосредуют разделение фаз, обогащены остатками аргинина в их доменах RGG box и RRM низкой сложности. Из-за их общего положительного заряда образование жидкообразных капель этими белками очень чувствительно к ионной силе окружающего раствора. Многочисленные другие белки, связанные с ядерными тельцами и гранулами мРНП, обогащены остатками аргинина (900–43 e.г. домена RGG и SR; см. Таблицу 1). Например, SR-повторы низкой сложности, общие для SR-семейства факторов сплайсинга, были идентифицированы как сигналы-мишени для локализации ядерных спеклов [72, 73]. Эти наблюдения убедительно свидетельствуют о том, что электростатические взаимодействия играют ключевую роль в фазовом разделении подмножества белков (рис.
Кроме того, эти области часто обогащены заряженными и ароматическими аминокислотами, что подчеркивает важность электростатических и гидрофобных взаимодействий в процессе фазового разделения.Например, неупорядоченные сегменты хеликаз DEAD-box Ddx4 [48] и LAF-1 [47], а также hnRNPA1 [44], которые опосредуют разделение фаз, обогащены остатками аргинина в их доменах RGG box и RRM низкой сложности. Из-за их общего положительного заряда образование жидкообразных капель этими белками очень чувствительно к ионной силе окружающего раствора. Многочисленные другие белки, связанные с ядерными тельцами и гранулами мРНП, обогащены остатками аргинина (900–43 e.г. домена RGG и SR; см. Таблицу 1). Например, SR-повторы низкой сложности, общие для SR-семейства факторов сплайсинга, были идентифицированы как сигналы-мишени для локализации ядерных спеклов [72, 73]. Эти наблюдения убедительно свидетельствуют о том, что электростатические взаимодействия играют ключевую роль в фазовом разделении подмножества белков (рис. 1).
1).
Однако электростатические взаимодействия не являются единственными взаимодействиями, которые способствуют формированию состояния разделения фаз, богатого белком. Области низкой сложности, богатые ароматическими остатками ( i.е. фенилаланин, тирозин) сверхпредставлены в белках, которые находятся в безмембранных органеллах [48, 74] и других матриксах, разделенных фазами, как в случае с белком FUS в гранулах мРНП [50, 53] и FG-Nups в ядерно-поровый комплекс [51]. Интересно, что мутации F на Y, но не F на S, в домене повторов FG сохраняли образования гидрогелей in vitro дрожжевым нуклеопорином Nsp1p [51], демонстрируя важность ароматических остатков в явлениях сборки, связанных с комплексом ядерных пор. .Кроме того, критическая концентрация для образования капель жидкости in vitro FUS была снижена за счет увеличения ионной силы раствора, что согласуется с интерпретацией того, что высаливание гидрофобных взаимодействий снижает порог растворимости белка в буфере [53]. Nott et al. отметили, что для фазового разделения конструкции Ddx4 необходимы эволюционно консервативная кластеризация аминокислотных остатков с одинаковым зарядом и регулярное расстояние между мотивами RG и FG [48].Эти исследования подчеркивают роль катион-π [48] и π-π [50, 51] взаимодействий в явлениях фазового разделения.
Nott et al. отметили, что для фазового разделения конструкции Ddx4 необходимы эволюционно консервативная кластеризация аминокислотных остатков с одинаковым зарядом и регулярное расстояние между мотивами RG и FG [48].Эти исследования подчеркивают роль катион-π [48] и π-π [50, 51] взаимодействий в явлениях фазового разделения.
В отсутствие липидного мембранного барьера движение молекул в безмембранные органеллы и из них ограничивается диффузией [1], и их накопление в основном зависит от удерживания, основанного на взаимодействии с матриксом органеллы. Интересно, что диффузионный барьер для экзогенных макромолекул, таких как декстраны, определяется физическими свойствами матрикса безмембранных органелл [1].ДФК ядрышка менее склонен к накоплению декстранов по сравнению с окружающим ГК, что согласуется с наблюдениями, что ДФК более плотный, чем ГК [1]. Кроме того, динамические характеристики компонентов, специфически удерживаемых внутри безмембранных органелл, варьируются в зависимости от характера их взаимодействия с другими составляющими матрикса [7, 23]. Вместе эти результаты показывают, что различные вклады различных типов межмолекулярных взаимодействий, которые способствуют фазовому разделению, определяют избирательное накопление специфических белков в специфических типах безмембранных органелл.
Вместе эти результаты показывают, что различные вклады различных типов межмолекулярных взаимодействий, которые способствуют фазовому разделению, определяют избирательное накопление специфических белков в специфических типах безмембранных органелл.
Механизмы, участвующие в достижении локальной организации и композиционной сложности в безмембранных органеллах
Локализация определенных макромолекул в определенных безмембранных органеллах достигается за счет специфических взаимодействий с молекулярной сетью, которая простирается от области зародышеобразования. Как обсуждалось выше, большая часть белков, которые, как известно, связаны с безмембранными органеллами, проявляют поливалентность благодаря отображению повторяющихся мотивов низкой сложности (например,g., мотивы SR, RGG или FG) и/или множественных копий свернутых доменов, таких как домены RRM. Таким образом, за счет комбинаторного использования конечного числа модулей межмолекулярного взаимодействия сложные смеси белков и нуклеиновых кислот могут быть рекрутированы в конденсированную фазу. Например, образование P-гранул инициируется самоассоциацией спирально-скрученных доменов белков PGL-1 и PGL-3, которые дополнительно связывают мРНК через свои домены RGG низкой сложности. Связанные с Vasa хеликазы GLH-1, 2, 3 и 4, которые содержат повторы FG, затем включаются, чтобы облегчить ассоциацию P-гранул с ядрами посредством взаимодействия и расширения матрикса гидрогеля комплекса ядерных пор [74].Наличие доменов гомо- и гетероолигомеризации дополнительно повышает степень поливалентности и способствует интеграции в безмембранные органеллы (рис. 2). Белок PML образует гомо- и гетероолигомеры через свой спирально-спиральный домен, но валентность может быть увеличена за счет гомодимеризации через домен RING. Мутации либо в спиральных, либо в доменах RING приводили к разрушению телец PML [12]. Компоненты механизма декэпирования мРНК, обнаруженные в P-тельцах, включая Pdc1, Dcp2 и Edc3, собираются в жидкоподобные капли in vitro. Два домена LSm в димерном Edc3 взаимодействуют с Dcp2 и Pdc1, которые оба содержат мультивалентные мотивы HLM.
Например, образование P-гранул инициируется самоассоциацией спирально-скрученных доменов белков PGL-1 и PGL-3, которые дополнительно связывают мРНК через свои домены RGG низкой сложности. Связанные с Vasa хеликазы GLH-1, 2, 3 и 4, которые содержат повторы FG, затем включаются, чтобы облегчить ассоциацию P-гранул с ядрами посредством взаимодействия и расширения матрикса гидрогеля комплекса ядерных пор [74].Наличие доменов гомо- и гетероолигомеризации дополнительно повышает степень поливалентности и способствует интеграции в безмембранные органеллы (рис. 2). Белок PML образует гомо- и гетероолигомеры через свой спирально-спиральный домен, но валентность может быть увеличена за счет гомодимеризации через домен RING. Мутации либо в спиральных, либо в доменах RING приводили к разрушению телец PML [12]. Компоненты механизма декэпирования мРНК, обнаруженные в P-тельцах, включая Pdc1, Dcp2 и Edc3, собираются в жидкоподобные капли in vitro. Два домена LSm в димерном Edc3 взаимодействуют с Dcp2 и Pdc1, которые оба содержат мультивалентные мотивы HLM. Edc3 связывается с различными мотивами HLM с аффинностью в пределах от низкого микромолярного до миллимолярного диапазона [49]. Валентность мотивов HLM в Pdc1 увеличивается за счет олигомеризации через центральный спиральный домен [49, 75]. Эти примеры иллюстрируют, как мультивалентные взаимодействующие модули и домены олигомеризации могут взаимодействовать, чтобы инициировать фазовое разделение в контексте различных типов безмембранных органелл.Дополнительные домены внутри этих белков, не участвующие непосредственно в механизме фазового разделения, могут способствовать привлечению дополнительных компонентов в жидкую фазу. Например, геликаза Ddx6/Dhh2 и мРНК могут быть рекрутированы в P-тельца через FDF-домен Edc3 и РНК-связывающий домен хеликазы, соответственно [49]. Таким образом, мы различаем два основных типа компонентов безмембранных органелл: (i) поливалентные макромолекулы, непосредственно участвующие во взаимодействиях в процессе фазового разделения и лежащие в основе структурных особенностей жидкой фазы, и (ii) другие макромолекулы, рекрутируемые посредством специфических взаимодействий с фазово-разделенной сборкой, в которой отсутствуют многовалентные элементы взаимодействия, но которые выполняют специализированные функции в жидкой фазе ( i.
Edc3 связывается с различными мотивами HLM с аффинностью в пределах от низкого микромолярного до миллимолярного диапазона [49]. Валентность мотивов HLM в Pdc1 увеличивается за счет олигомеризации через центральный спиральный домен [49, 75]. Эти примеры иллюстрируют, как мультивалентные взаимодействующие модули и домены олигомеризации могут взаимодействовать, чтобы инициировать фазовое разделение в контексте различных типов безмембранных органелл.Дополнительные домены внутри этих белков, не участвующие непосредственно в механизме фазового разделения, могут способствовать привлечению дополнительных компонентов в жидкую фазу. Например, геликаза Ddx6/Dhh2 и мРНК могут быть рекрутированы в P-тельца через FDF-домен Edc3 и РНК-связывающий домен хеликазы, соответственно [49]. Таким образом, мы различаем два основных типа компонентов безмембранных органелл: (i) поливалентные макромолекулы, непосредственно участвующие во взаимодействиях в процессе фазового разделения и лежащие в основе структурных особенностей жидкой фазы, и (ii) другие макромолекулы, рекрутируемые посредством специфических взаимодействий с фазово-разделенной сборкой, в которой отсутствуют многовалентные элементы взаимодействия, но которые выполняют специализированные функции в жидкой фазе ( i. э., фермента, катализирующего специфические биохимические реакции). Однако способность к сборке/разделению фаз и биохимическая функциональность могут быть воплощены в одном белке, как это видно с Ddx4, который содержит геликазный домен и мультивалентный домен RGG низкой сложности, который обеспечивает разделение фаз [48].
э., фермента, катализирующего специфические биохимические реакции). Однако способность к сборке/разделению фаз и биохимическая функциональность могут быть воплощены в одном белке, как это видно с Ddx4, который содержит геликазный домен и мультивалентный домен RGG низкой сложности, который обеспечивает разделение фаз [48].
РНК в составе безмембранных органелл
Несмотря на то, что много внимания уделялось пониманию роли поливалентных белков в формировании безмембранных органелл, основные функции многих из этих органелл связаны с различными аспектами метаболизма РНК и, следовательно, РНК также участвует в их сборке и структурной целостности.Сборка ядрышка на выходе из митоза инициируется транскрипционной активацией РНК Pol I [8, 76], а структурная целостность параспеклов зависит от транскрипционной активности РНК Pol II [2]. Белки, способные к фазовому разделению, часто содержат сходные наборы складчатых и поливалентных доменов низкой сложности, что приводит к структурной избыточности и способности при определенных условиях беспорядочно локализоваться внутри более чем одного типа безмембранных органелл. Напротив, различные типы органелл обычно содержат определенные типы РНК (обобщенные в таблице 1), что позволяет предположить, что компоненты РНК являются основными детерминантами идентичности органелл. В подтверждение этой гипотезы нарушение транскрипции РНК вызывает релокализацию белковых компонентов различных ядерных и цитоплазматических телец [25, 59]. Например, Mao et al. продемонстрировали, что lncRNA Mem ε/β необходима для рекрутирования специфических белков и молекул РНК в параспеклы [77].Кроме того, иммобилизация PSP1, модульного белка параспекл, способного к гомо- и гетероолигомеризации [18], была способна рекрутировать некоторые компоненты белка параспекл, но не могла воспроизвести полную сборку органеллы [77]. Рекрутирование полного набора белковых и РНК-компонентов параспеклов в сочетании с исключением макромолекул, ассоциированных с ядерными спеклами, достигается только в условиях активной транскрипции днРНК Mem ε/β. Хотя обобщенные выше наблюдения ясно указывают на доминирующую роль РНК в молекулярном составе некоторых безмембранных органелл, другие факторы также могут влиять на их структурную целостность.
Напротив, различные типы органелл обычно содержат определенные типы РНК (обобщенные в таблице 1), что позволяет предположить, что компоненты РНК являются основными детерминантами идентичности органелл. В подтверждение этой гипотезы нарушение транскрипции РНК вызывает релокализацию белковых компонентов различных ядерных и цитоплазматических телец [25, 59]. Например, Mao et al. продемонстрировали, что lncRNA Mem ε/β необходима для рекрутирования специфических белков и молекул РНК в параспеклы [77].Кроме того, иммобилизация PSP1, модульного белка параспекл, способного к гомо- и гетероолигомеризации [18], была способна рекрутировать некоторые компоненты белка параспекл, но не могла воспроизвести полную сборку органеллы [77]. Рекрутирование полного набора белковых и РНК-компонентов параспеклов в сочетании с исключением макромолекул, ассоциированных с ядерными спеклами, достигается только в условиях активной транскрипции днРНК Mem ε/β. Хотя обобщенные выше наблюдения ясно указывают на доминирующую роль РНК в молекулярном составе некоторых безмембранных органелл, другие факторы также могут влиять на их структурную целостность. Например, сигналы стресса, индуцированные DRB, небольшой молекулой, которая селективно ингибирует РНК Pol II, вызывали растворение параспеков до того, как можно было измерить значительное снижение общего уровня Mem ε/β lncRNA [77]. Это открытие предполагает, что неизвестный в настоящее время регуляторный механизм контролирует структурную целостность параспеклов и что существует резкий и чувствительный порог для восприятия клеточного стресса и ответа на него. В связи с этим возникает важный общий вопрос: как изменения условий окружающей среды, например, в ответ на различные виды стресса, передаются на безмембранный матрикс органелл и проявляются в изменениях структуры и функции ? Эта тема обсуждается в следующем разделе.
Например, сигналы стресса, индуцированные DRB, небольшой молекулой, которая селективно ингибирует РНК Pol II, вызывали растворение параспеков до того, как можно было измерить значительное снижение общего уровня Mem ε/β lncRNA [77]. Это открытие предполагает, что неизвестный в настоящее время регуляторный механизм контролирует структурную целостность параспеклов и что существует резкий и чувствительный порог для восприятия клеточного стресса и ответа на него. В связи с этим возникает важный общий вопрос: как изменения условий окружающей среды, например, в ответ на различные виды стресса, передаются на безмембранный матрикс органелл и проявляются в изменениях структуры и функции ? Эта тема обсуждается в следующем разделе.
Структурная и динамическая регуляция фазово-разделенных структур
Отсутствие липидного бислойного барьера между безмембранными органеллами и их окружением устраняет необходимость в активном транспорте макромолекул через мембраны и обеспечивает быструю передачу сигнала. Сигналы стресса влияют на структурную целостность безмембранных органелл, обеспечивая механизм опосредованных органеллами стрессовых реакций. Далее мы обсудим различные факторы, влияющие на структуру и функцию безмембранных органелл.
Сигналы стресса влияют на структурную целостность безмембранных органелл, обеспечивая механизм опосредованных органеллами стрессовых реакций. Далее мы обсудим различные факторы, влияющие на структуру и функцию безмембранных органелл.
Химические и другие факторы окружающей среды
Изменения температуры [27, 48], ионной силы [47, 48], хемотоксичность и повреждение ДНК [27, 59, 60, 78, 79] являются изменениями окружающей среды, которые, как известно, нарушают фазовое разделение клеточные тела и капли жидкости in vitro . Жесткость ядрышек, выделенных из клеток HeLa, уменьшалась или увеличивалась при ингибировании РНК-полимеразы или протеасомы, соответственно, на основании измерений атомно-силовой микроскопии [79]. Таким образом, сигналы стресса влияют на вязкоупругие свойства ядрышек и, следовательно, модулируют их функции.
Безмембранные органеллы формируются, разбираются и функционируют во внутриклеточной среде, насыщенной макромолекулами. Высокая кумулятивная концентрация макромолекул в клетке, коррелирующая с высоким процентом исключенного объема (~20–30 % от общего объема клетки), влияет на кинетику и термодинамику большинства биохимических процессов [80]. In vitro агента молекулярного краудинга способствуют сборке рекомбинантного hnRNPA1 в белково-плотные жидкоподобные капли при более низких критических концентрациях, чем наблюдаемые только в буфере [44, 45].Таким образом, увеличение исключенного объема, вызванное скоплением макромолекул, увеличивает локальную концентрацию отдельных белковых видов, тем самым снижая порог эффективной концентрации для разделения фаз (рис. 1).
In vitro агента молекулярного краудинга способствуют сборке рекомбинантного hnRNPA1 в белково-плотные жидкоподобные капли при более низких критических концентрациях, чем наблюдаемые только в буфере [44, 45].Таким образом, увеличение исключенного объема, вызванное скоплением макромолекул, увеличивает локальную концентрацию отдельных белковых видов, тем самым снижая порог эффективной концентрации для разделения фаз (рис. 1).
Изменения морфологии и вязкоупругих свойств гранул мРНП из-за мутаций в резидентных белках (, например, hnRNPA1, FUS) связаны с изнурительными нейродегенеративными заболеваниями [13, 42, 44, 45]. In vitro , фазы FUS и hnRNPA1 разделяются на жидкоподобные капли [42, 44, 45, 53] или гидрогели [42, 44, 50], в зависимости от концентрации белка и условий эксперимента.Области низкой сложности в двух белках вместе с доменами RRM [44, 45, 53] способствуют разделению фаз. Мутации в Q/N-богатых областях низкой сложности, называемых прионоподобными доменами, связаны с дефектами в гранулах мРНП и нейропатогенезом [42, 44]. Эти дефекты связаны с кинетически медленной стадией (время от десятков минут до часов), которая происходит в плотной жидкоподобной фазе, называемой «капельным старением» [42], при которой жидкоподобная фаза превращается в твердую. как государство.Феноменологические наблюдения предполагают, что это физическое превращение является результатом медленной структурной реорганизации плотной жидкообразной фазы. Реорганизация приводит к уменьшению динамики внутри фазово-разделенного состояния и завершается переходом из жидкоподобного состояния в гидрогелевое или твердоподобное состояние. Переход между двумя физическими состояниями сопровождается морфологическими изменениями: от почти сферических капель, сформированных за счет поверхностного натяжения, к удлиненным фибрилоподобным структурам [42, 44, 45].Аналогичный переход наблюдали in vitro и in vivo капель, содержащих Whi3, белок, кодирующий полиQ-тракт [55]. Потенциальный лежащий в основе механизм заключается в том, что в условиях высокой локальной концентрации белка в плотной жидкоподобной фазе возникают новые, менее динамичные взаимодействия, возможно, между прионоподобными доменами низкой сложности.
Эти дефекты связаны с кинетически медленной стадией (время от десятков минут до часов), которая происходит в плотной жидкоподобной фазе, называемой «капельным старением» [42], при которой жидкоподобная фаза превращается в твердую. как государство.Феноменологические наблюдения предполагают, что это физическое превращение является результатом медленной структурной реорганизации плотной жидкообразной фазы. Реорганизация приводит к уменьшению динамики внутри фазово-разделенного состояния и завершается переходом из жидкоподобного состояния в гидрогелевое или твердоподобное состояние. Переход между двумя физическими состояниями сопровождается морфологическими изменениями: от почти сферических капель, сформированных за счет поверхностного натяжения, к удлиненным фибрилоподобным структурам [42, 44, 45].Аналогичный переход наблюдали in vitro и in vivo капель, содержащих Whi3, белок, кодирующий полиQ-тракт [55]. Потенциальный лежащий в основе механизм заключается в том, что в условиях высокой локальной концентрации белка в плотной жидкоподобной фазе возникают новые, менее динамичные взаимодействия, возможно, между прионоподобными доменами низкой сложности. Со временем эти взаимодействия могут стать доминирующими над более динамичными, многовалентными электростатическими взаимодействиями, которые приводят к возникновению жидкоподобного состояния.Мы предполагаем, что баланс термодинамической благоприятности этих двух типов взаимодействий может влиять на физическую природу фазово-разделенного состояния (, т.е. жидкость, гидрогель/твердое тело) и определять различную склонность белков дикого типа и мутантных белков к претерпеванию. переход из жидкоподобного в твердоподобное структурное состояние.
Со временем эти взаимодействия могут стать доминирующими над более динамичными, многовалентными электростатическими взаимодействиями, которые приводят к возникновению жидкоподобного состояния.Мы предполагаем, что баланс термодинамической благоприятности этих двух типов взаимодействий может влиять на физическую природу фазово-разделенного состояния (, т.е. жидкость, гидрогель/твердое тело) и определять различную склонность белков дикого типа и мутантных белков к претерпеванию. переход из жидкоподобного в твердоподобное структурное состояние.
Энергозависимый контроль динамики безмембранных органелл
Мы подчеркивали, что физические свойства безмембранных органелл зависят от состава их белков и РНК.Вдобавок, однако, ядрышку требуется АТФ для поддержания своего жидкостного поведения, физического состояния, называемого «активной жидкостью» [5]. В настоящее время неясно, какие конкретные АТФ-зависимые процессы участвуют в поддержании этого активного жидкого состояния.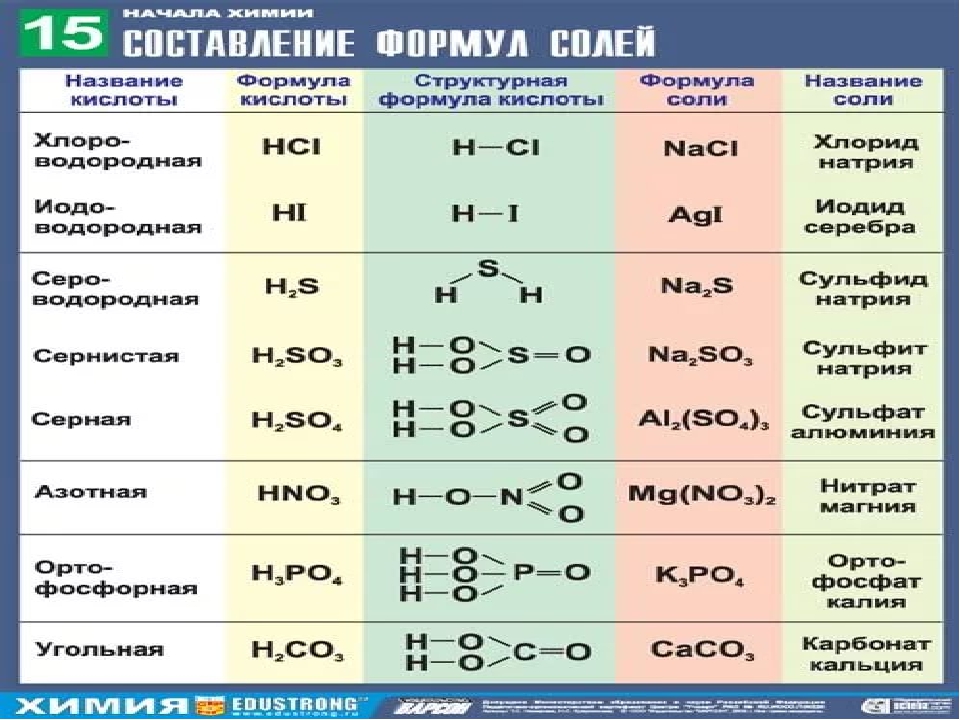 Кроме того, активность АТФ-зависимых шаперонов, таких как Hsp70/Hsp40, которые накапливаются внутри стрессовых гранул, необходима для их разборки при восстановлении после стресса [81]. Эти наблюдения позволяют предположить, что АТФ-гидролизующие ферменты регулируют динамику макромолекул внутри безмембранных органелл.Сходным образом несколько других типов АТФ-зависимых ферментов, включая киназы и хеликазы DEAD-box [47-49, 78], которые включены в эти органеллы, могут участвовать в поддержании их жидкоподобных физических свойств. Геликазы могут модулировать структуру РНК, а также взаимодействия белок-РНК и, таким образом, активно контролировать вязкоупругие свойства безмембранных органелл.
Кроме того, активность АТФ-зависимых шаперонов, таких как Hsp70/Hsp40, которые накапливаются внутри стрессовых гранул, необходима для их разборки при восстановлении после стресса [81]. Эти наблюдения позволяют предположить, что АТФ-гидролизующие ферменты регулируют динамику макромолекул внутри безмембранных органелл.Сходным образом несколько других типов АТФ-зависимых ферментов, включая киназы и хеликазы DEAD-box [47-49, 78], которые включены в эти органеллы, могут участвовать в поддержании их жидкоподобных физических свойств. Геликазы могут модулировать структуру РНК, а также взаимодействия белок-РНК и, таким образом, активно контролировать вязкоупругие свойства безмембранных органелл.
Роль посттрансляционных модификаций в регуляции структуры и динамики безмембранных органелл
Сборка компонентов во многих системах с фазовым разделением, которые мы обсуждали, управляется электростатически.Следовательно, посттрансляционные модификации, которые изменяют особенности заряда аминокислот в доменах и сегментах белков низкой сложности, предоставляют средства для модуляции их многовалентных взаимодействий и поведения при разделении фаз (рис. 1).
1).
Важность электростатических взаимодействий иллюстрируется фазовым разделением LAF-1 [47], hnRNPA1 [44, 45] и Ddx4 [48], чья способность образовывать жидкоподобные капли сильно зависит от концентрации соли в окружающий буфер.Концентрационный порог фазового разделения для обоих линейно масштабируется с ионной силой по мере увеличения концентрации NaCl. Кроме того, метилирование остатков аргинина в RGG-домене Ddx4 увеличивает порог фазового разделения in vitro [48].
Фосфорилирование играет решающую роль во многих путях передачи сигнала, а также модулирует структурную целостность и динамику безмембранных органелл. Например, тирозиновое фосфорилирование нефрина стимулирует фазовое разделение тройной системы нефрин/NCK/N-WASP [46].Интересно, что общей чертой некоторых хорошо охарактеризованных безмембранных органелл является то, что они включают киназы и фосфатазы в свой матрикс [39, 78, 82]. Активные циклы фосфорилирования/дефосфорилирования связаны с регуляцией структурной целостности органелл. Активность ядрышковой киназы CK2 контролирует структурную связь между участками GC и DFC внутри ядрышка [78] и увеличивает динамику обмена NPM1 между ядрышковым и нуклеоплазматическим компартментами [83].Кроме того, фосфорилирование белков MEG-3 и MEG-4 киназой MBK-2/DYRK и дефосфорилирование фосфатазой PP2A PPTR-1/PPTR2 регулирует разборку и сборку P-гранул, соответственно, во время митоза у C. elegans у связь с эмбриогенезом [39].
Активность ядрышковой киназы CK2 контролирует структурную связь между участками GC и DFC внутри ядрышка [78] и увеличивает динамику обмена NPM1 между ядрышковым и нуклеоплазматическим компартментами [83].Кроме того, фосфорилирование белков MEG-3 и MEG-4 киназой MBK-2/DYRK и дефосфорилирование фосфатазой PP2A PPTR-1/PPTR2 регулирует разборку и сборку P-гранул, соответственно, во время митоза у C. elegans у связь с эмбриогенезом [39].
Сборка и разборка безмембранных органелл обеспечивает механизм контроля концентрации и связанного с этим сигнального поведения свободно диффундирующих молекул в ограниченных мембраной компартментах клетки.Например, динамические свойства стрессовых гранул связаны с передачей сигналов mTORC1 за счет иммобилизации mTORC1 внутри гранул, в то время как опосредованное фосфорилированием растворение этих органелл высвобождает mTORC1, активируя нижестоящую передачу сигналов [82]. В качестве другого примера Wippich et al. [82] продемонстрировали, что киназа DYRK3 конденсируется в цитоплазматических гранулах через свой N-концевой домен низкой сложности в зависимости от концентрации и локализуется в стрессовых гранулах при осмотическом и окислительном стрессе. Неактивный DYRK3 конденсируется в стрессовые гранулы вместе с компонентами пути mTORC1. Активация DYRK3 и последующее фосфорилирование PRAS40, ингибитора mTORC1, приводит к растворению стрессовых гранул и нарушению ингибирующего взаимодействия PRAS40/mTORC1.
Неактивный DYRK3 конденсируется в стрессовые гранулы вместе с компонентами пути mTORC1. Активация DYRK3 и последующее фосфорилирование PRAS40, ингибитора mTORC1, приводит к растворению стрессовых гранул и нарушению ингибирующего взаимодействия PRAS40/mTORC1.
Дальнейшее доказательство роли посттрансляционных модификаций в регуляции свойств безмембранных органелл обеспечивается наблюдением, что аминокислоты аргинин, серин и тирозин чрезмерно представлены в низкосложных последовательностях белков внутри них.Эти аминокислоты могут быть посттрансляционно модифицированы, аргинины — путем метилирования, а серины и тирозины — путем фосфорилирования, обеспечивая общие механизмы для модулирования порогов конденсации белков и, следовательно, сигнальные пути ниже по течению от компонентов, секвестрированных внутри фазово-разделенной фракции.
Концентрация компонентов как фактор сборки/разборки безмембранных органелл
Другим важным фактором зависимого от фазового разделения образования безмембранных органелл является локальная концентрация компонентов (рис.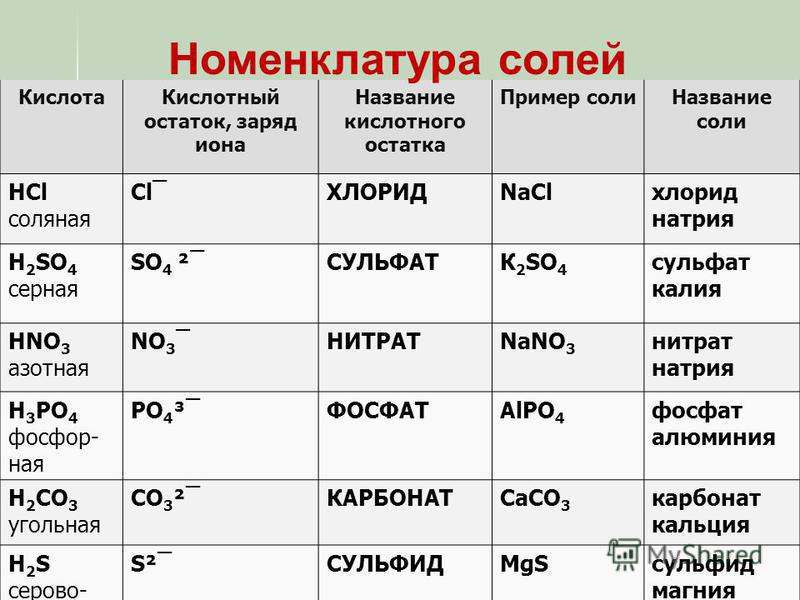 1). Например, регуляция Р-гранул при переходе от ооцита к эмбриону, когда они переходят из перинуклеарной области в цитоплазму, регулируется градиентом концентрации, что вызывает растворение перинуклеарных капель и реконденсацию в цитоплазме. Аналогичный механизм используется во время асимметричной сегрегации Р-гранул в клетку-основатель зародышевой линии [6]. Недавно Brangwynne и его коллеги продемонстрировали, что уровни РНК в каплях LAF-1, минималистичной модели in vitro P-гранул, настраивают вязкость и молекулярную динамику в жидкоподобной фазе [47].Вязкоупругие свойства жидкоподобных капель, содержащих Whi3, также модулируются концентрацией РНК. В то время как Whi3 способен к мономолекулярному фазовому разделению при определенных условиях, присутствие РНК необходимо для того, чтобы процесс происходил при физиологических концентрациях солей. Кроме того, увеличение концентрации РНК коррелирует с увеличением вязкости капель и снижением динамики восстановления Whi3 после фотообесцвечивания [55].
1). Например, регуляция Р-гранул при переходе от ооцита к эмбриону, когда они переходят из перинуклеарной области в цитоплазму, регулируется градиентом концентрации, что вызывает растворение перинуклеарных капель и реконденсацию в цитоплазме. Аналогичный механизм используется во время асимметричной сегрегации Р-гранул в клетку-основатель зародышевой линии [6]. Недавно Brangwynne и его коллеги продемонстрировали, что уровни РНК в каплях LAF-1, минималистичной модели in vitro P-гранул, настраивают вязкость и молекулярную динамику в жидкоподобной фазе [47].Вязкоупругие свойства жидкоподобных капель, содержащих Whi3, также модулируются концентрацией РНК. В то время как Whi3 способен к мономолекулярному фазовому разделению при определенных условиях, присутствие РНК необходимо для того, чтобы процесс происходил при физиологических концентрациях солей. Кроме того, увеличение концентрации РНК коррелирует с увеличением вязкости капель и снижением динамики восстановления Whi3 после фотообесцвечивания [55]. Кроме того, сборка ядрышек и параспеклов зависит от концентраций составляющих их РНК, которые контролируются транскрипционной активностью РНК-полимераз [2, 8], что позволяет предположить, что транскрипционный контроль концентрации РНК может быть общим механизмом настройки физических свойств. безмембранных органелл (рис.1).
Кроме того, сборка ядрышек и параспеклов зависит от концентраций составляющих их РНК, которые контролируются транскрипционной активностью РНК-полимераз [2, 8], что позволяет предположить, что транскрипционный контроль концентрации РНК может быть общим механизмом настройки физических свойств. безмембранных органелл (рис.1).
Многие безмембранные органеллы участвуют в клеточных реакциях на различные типы стресса, и чувствительность их структурной целостности к концентрациям белков и РНК обеспечивает механизм быстрого ответа на сигналы стресса, влияющие на эти уровни. Например, ингибирование Pol I-, II- и III-зависимой транскрипции РНК с помощью Actinomycin D было связано с реорганизацией компонентов как ядерных, так и цитоплазматических органелл без мембран [59]. После обработки актиномицином D NPM1, основной компонент GC ядрышка, становится делокализованным в нуклеоплазме и цитоплазме из-за ингибирования РНК Pol I-зависимой транскрипции рРНК.В этих условиях было обнаружено, что цитоплазматический NPM1 взаимодействует с компонентами стрессовых гранул, такими как мРНК и белки hnRNPU и hnRNPA1 [84].
Также в условиях лечения актиномицином D белковые и РНК-компоненты, связанные с параспеклами, а также PML и тельцами Кахаля, повторно локализуются в крышках ядрышек. Интересно, что в то время как белки из GC выбрасываются из ядрышка, белки из DFC, такие как fibrillarin, повторно локализуются в крышках ядрышек [25]. Эти наблюдения предполагают, что изменения окружающей среды могут изменять равновесие, поддерживающее целостность безмембранных органелл, тем самым изменяя концентрации их компонентов в свободно диффундирующих пулах макромолекул внутри нуклеоплазмы и цитоплазмы и позволяя их перераспределению внутри различных других органелл.
Новые методы изучения фазово-разделенных структур
Детальный анализ структурных особенностей безмембранных органелл и лежащих в их основе макромолекулярных ансамблей представляет собой проблему, не встречающуюся в других областях структурной биологии. Взаимодействия, имеющие отношение к явлению фазового разделения, происходят в нескольких масштабах длины, от субнанометров до десятков микрометров, что делает какой-либо отдельный аналитический метод недостаточным для изучения макромолекулярных ансамблей с разделенными фазами. Например, хотя жидкоподобные капли превышают ограничения по размеру, связанные с анализом с помощью ЯМР-спектроскопии, структурные и динамические особенности гибких компонентов внутри них были охарактеризованы [53]. Однако динамические особенности этих систем несовместимы с рентгеновской кристаллографией. Хотя образовавшиеся макромолекулярные сборки легко наблюдать с помощью обычных методов микроскопии, взаимодействия, ответственные за сборку, происходят на масштабах длин, которые ниже предела разрешения обнаружения.Кроме того, эти системы очень неоднородны, и поэтому для понимания их структурных особенностей необходимы интеграционные решения, сочетающие взаимодополняющие методы.
Например, хотя жидкоподобные капли превышают ограничения по размеру, связанные с анализом с помощью ЯМР-спектроскопии, структурные и динамические особенности гибких компонентов внутри них были охарактеризованы [53]. Однако динамические особенности этих систем несовместимы с рентгеновской кристаллографией. Хотя образовавшиеся макромолекулярные сборки легко наблюдать с помощью обычных методов микроскопии, взаимодействия, ответственные за сборку, происходят на масштабах длин, которые ниже предела разрешения обнаружения.Кроме того, эти системы очень неоднородны, и поэтому для понимания их структурных особенностей необходимы интеграционные решения, сочетающие взаимодополняющие методы.
Методы определения структуры с атомарным разрешением
Несколько исследований с использованием классических структурных методов, включая ЯМР в растворе [46, 48, 49, 67–69] и рентгеновскую кристаллографию [19, 70], позволили получить детальное представление о молекулярных взаимодействиях которые опосредуют сетевую структуру, которая управляет фазовым разделением модульных белков внутри безмембранных органелл. Однако из-за технологических ограничений эти исследования проводились с укороченными формами белков и нуклеиновых кислот, соответствующих отдельным модулям взаимодействия. Эти традиционные методы будут полезны в будущем для определения структурных основ взаимодействий между свернутыми доменами внутри многодоменных белков, склонных к фазовому расслоению, и их партнерами по взаимодействию, включая пептиды, соответствующие коротким линейным мотивам и сегментам РНК. Однако, поскольку многие белки, склонные к фазовому разделению, обладают низкой сложностью и особенностями неупорядоченной последовательности, эти методы определения дискретной структуры белка, вероятно, получат ограниченное применение в этой новой области.
Однако из-за технологических ограничений эти исследования проводились с укороченными формами белков и нуклеиновых кислот, соответствующих отдельным модулям взаимодействия. Эти традиционные методы будут полезны в будущем для определения структурных основ взаимодействий между свернутыми доменами внутри многодоменных белков, склонных к фазовому расслоению, и их партнерами по взаимодействию, включая пептиды, соответствующие коротким линейным мотивам и сегментам РНК. Однако, поскольку многие белки, склонные к фазовому разделению, обладают низкой сложностью и особенностями неупорядоченной последовательности, эти методы определения дискретной структуры белка, вероятно, получат ограниченное применение в этой новой области.
ЯМР-спектроскопия; универсальный инструмент для изучения белков, склонных к фазовому разделению
ЯМР-спектроскопия предлагает уникальные возможности для изучения неупорядоченных белков, позволяя получить представление о конформациях и динамике отдельных аминокислот по всей полипептидной цепи. Измерения значений химического сдвига для ядер атомов основной цепи сообщают о склонностях и динамике вторичной структуры, которые можно исследовать в масштабах времени от пс до нс и от мкс до мс с использованием различных методов релаксации [85].Кроме того, дальнодействующая структура в неупорядоченных белках может быть изучена с использованием методов усиления парамагнитной релаксации (PRE) и путем измерения остаточных диполярных взаимодействий [86]. Однако первый метод требует, чтобы белки были сконструированы таким образом, чтобы они включали отдельные остатки цистеина для мечения парамагнитным зондом. Ограничением этих подходов ЯМР является то, что быстрые конформационные флуктуации неупорядоченных полипептидов вызывают усреднение по ансамблю параметров ЯМР. Второе ограничение заключается в том, что структурная и динамическая информация позволяет получить отчеты об особенностях отдельных сайтов в белке в очень ограниченном масштабе длины (Å или десятки Å в случае измерений PRE).Исключением является использование методов градиента импульсного поля для изучения диффузии белков [87], но они еще не применялись в исследованиях белков внутри жидкоподобных капель.
Измерения значений химического сдвига для ядер атомов основной цепи сообщают о склонностях и динамике вторичной структуры, которые можно исследовать в масштабах времени от пс до нс и от мкс до мс с использованием различных методов релаксации [85].Кроме того, дальнодействующая структура в неупорядоченных белках может быть изучена с использованием методов усиления парамагнитной релаксации (PRE) и путем измерения остаточных диполярных взаимодействий [86]. Однако первый метод требует, чтобы белки были сконструированы таким образом, чтобы они включали отдельные остатки цистеина для мечения парамагнитным зондом. Ограничением этих подходов ЯМР является то, что быстрые конформационные флуктуации неупорядоченных полипептидов вызывают усреднение по ансамблю параметров ЯМР. Второе ограничение заключается в том, что структурная и динамическая информация позволяет получить отчеты об особенностях отдельных сайтов в белке в очень ограниченном масштабе длины (Å или десятки Å в случае измерений PRE).Исключением является использование методов градиента импульсного поля для изучения диффузии белков [87], но они еще не применялись в исследованиях белков внутри жидкоподобных капель. Обширная динамика, которая характеризует IDP, часто является преимуществом для исследований ЯМР, поскольку они вызывают сужение резонанса и улучшают обнаружение. Однако некоторые IDP испытывают движения во временных масштабах, которые вызывают уширение резонанса и могут затруднить исследования ЯМР. Несмотря на эти ограничения, уже было продемонстрировано, что ЯМР дает уникальное представление о конформационных и динамических особенностях IDP, склонных к фазовому разделению, как до, так и после фазового разделения; несколько иллюстративных исследований обсуждаются ниже в разделе «Интегративные подходы к пониманию молекулярной основы фазового разделения».
Обширная динамика, которая характеризует IDP, часто является преимуществом для исследований ЯМР, поскольку они вызывают сужение резонанса и улучшают обнаружение. Однако некоторые IDP испытывают движения во временных масштабах, которые вызывают уширение резонанса и могут затруднить исследования ЯМР. Несмотря на эти ограничения, уже было продемонстрировано, что ЯМР дает уникальное представление о конформационных и динамических особенностях IDP, склонных к фазовому разделению, как до, так и после фазового разделения; несколько иллюстративных исследований обсуждаются ниже в разделе «Интегративные подходы к пониманию молекулярной основы фазового разделения».
Методы изучения молекулярных взаимодействий, связанных с разделением фаз
Классические методы характеристики биомолекулярных взаимодействий, такие как ITC [49] и SPR [68, 69], использовались для характеристики широкого диапазона аффинностей связывания, связанных с различными типы взаимодействий, которые происходят внутри жидкоподобных капель и/или безмембранных органелл. ЯМР также можно использовать для характеристики макромолекулярных взаимодействий, и он особенно хорошо подходит для изучения слабых взаимодействий, которые представляют трудности для других методов.Например, возмущения химического сдвига, наблюдаемые во время титрования немеченого партнера по связыванию в меченый изотопом белок, можно количественно проанализировать, чтобы сообщить о специфичных для остатков и глобальных значениях K d для взаимодействий, связанных с фазовым разделением [NPM1 интегрируется в ядрышко через множественные -модальные взаимодействия с белками, демонстрирующими R-богатые линейные мотивы и рРНК: Mitrea DM, et al., в обзоре]. Однако многовалентные свойства белков, склонных к фазовому разделению, могут привести к сложным, многоступенчатым механизмам взаимодействия, которые усложняют анализ данных, полученных с помощью методов, обсуждавшихся выше.Поэтому часто проводят эксперименты с укороченными макромолекулами пониженной поливалентности и поэтому не рассматривают взаимодействия в условиях фазового разделения.
ЯМР также можно использовать для характеристики макромолекулярных взаимодействий, и он особенно хорошо подходит для изучения слабых взаимодействий, которые представляют трудности для других методов.Например, возмущения химического сдвига, наблюдаемые во время титрования немеченого партнера по связыванию в меченый изотопом белок, можно количественно проанализировать, чтобы сообщить о специфичных для остатков и глобальных значениях K d для взаимодействий, связанных с фазовым разделением [NPM1 интегрируется в ядрышко через множественные -модальные взаимодействия с белками, демонстрирующими R-богатые линейные мотивы и рРНК: Mitrea DM, et al., в обзоре]. Однако многовалентные свойства белков, склонных к фазовому разделению, могут привести к сложным, многоступенчатым механизмам взаимодействия, которые усложняют анализ данных, полученных с помощью методов, обсуждавшихся выше.Поэтому часто проводят эксперименты с укороченными макромолекулами пониженной поливалентности и поэтому не рассматривают взаимодействия в условиях фазового разделения. Несмотря на эти ограничения, эти биофизические методы дают важную информацию о свойствах связывания отдельных элементов в мультивалентных макромолекулах, которые подвергаются фазовому разделению.
Несмотря на эти ограничения, эти биофизические методы дают важную информацию о свойствах связывания отдельных элементов в мультивалентных макромолекулах, которые подвергаются фазовому разделению.
Методы рассеяния для изучения структурных особенностей до и после разделения фаз
Динамическое рассеяние света и малоугловое рассеяние рентгеновских лучей (МУРР) [19, 46] использовались для получения информации об общих размерах и форме макромолекулярных ансамблей.В частности, SAXS использовался для характеристики форм (например, радиуса вращения) ансамблей неупорядоченных белков [88]. Однако методы рассеяния также могут обнаруживать дальний порядок в так называемых мягких материалах и уникальным образом давать представление о структурном составе этих материалов. Малоугловое рассеяние нейтронов (МУРН) ранее использовалось для структурного анализа смесей полимеров [89–91] и полимерных мягких наноматериалов [92] и имеет большой потенциал в исследованиях безмембранных органелл для получения информации о пространственной организации макромолекулы в конденсированном состоянии. Одно недавнее исследование использовало SANS для характеристики регулярного расстояния между молекулами в каплях, состоящих из ядрышкового белка, нуклеофосмина (NPM1) и пептида, полученного из рибосомного белка, rpL5, в масштабах длины от 5,5 до 11,9 нм [NPM1 интегрируется в ядрышке]. посредством мультимодальных взаимодействий с белками, демонстрирующими линейные мотивы, богатые R, и рРНК: Mitrea DM и др., в обзоре]. Преимущество МУРН заключается в том, что он позволяет обнаруживать рассеяние от конкретных компонентов в гетерогенных фазово-разделенных состояниях посредством селективного протонирования и/или дейтерирования и подбора контраста растворителя [93].Кроме того, SANS с временным разрешением использовался в прошлом в исследованиях разделения фазы мутантного экзона 1 гентингтина на амилоидные волокна для определения механизма сборки макромолекул и геометрии упаковки мономеров в фибриллах [94]. Мы полагаем, что SAXS и SANS смогут выявить расстояние между частично упорядоченными макромолекулами в жидкообразной структуре капель, приготовленных in vitro , и, возможно, в безмембранных органеллах, если удастся решить технические проблемы, связанные с подготовкой образцов.
Одно недавнее исследование использовало SANS для характеристики регулярного расстояния между молекулами в каплях, состоящих из ядрышкового белка, нуклеофосмина (NPM1) и пептида, полученного из рибосомного белка, rpL5, в масштабах длины от 5,5 до 11,9 нм [NPM1 интегрируется в ядрышке]. посредством мультимодальных взаимодействий с белками, демонстрирующими линейные мотивы, богатые R, и рРНК: Mitrea DM и др., в обзоре]. Преимущество МУРН заключается в том, что он позволяет обнаруживать рассеяние от конкретных компонентов в гетерогенных фазово-разделенных состояниях посредством селективного протонирования и/или дейтерирования и подбора контраста растворителя [93].Кроме того, SANS с временным разрешением использовался в прошлом в исследованиях разделения фазы мутантного экзона 1 гентингтина на амилоидные волокна для определения механизма сборки макромолекул и геометрии упаковки мономеров в фибриллах [94]. Мы полагаем, что SAXS и SANS смогут выявить расстояние между частично упорядоченными макромолекулами в жидкообразной структуре капель, приготовленных in vitro , и, возможно, в безмембранных органеллах, если удастся решить технические проблемы, связанные с подготовкой образцов. Мы предполагаем, что эти методы рассеяния станут мощными инструментами для характеристики биологических структур, возникающих в результате разделения фаз в будущем.
Мы предполагаем, что эти методы рассеяния станут мощными инструментами для характеристики биологических структур, возникающих в результате разделения фаз в будущем.
Световая микроскопия
Методы световой микроскопии (обзор в [95]) широко использовались для визуализации субклеточной локализации флуоресцентно меченых молекул. Визуализация в реальном времени в сочетании с восстановлением флуоресценции после фотообесцвечивания (FRAP) или методами потери флуоресценции при фотообесцвечивании (FLIP) исследуют динамику макромолекул внутри безмембранных органелл внутри живых клеток [7, 46, 48, 77] и фазово-разделенные состояния, восстановленные in vitro [46–48, 50].
Информация, полученная методами структурной биологии, представлена в масштабах длин 10 −10 –10 −9 м, в то время как классические методы световой микроскопии дают информацию в гораздо больших масштабах длин, от 10 −7 до 10 −3 м. Эта ситуация создает пробел, соответствующий двум порядкам по шкале длины, в нашем понимании структурных и динамических особенностей безмембранных органелл микронного размера. Макромолекулярные взаимодействия, которые происходят в масштабе длины этого промежутка, ответственны за структурную организацию, которая приводит к фазовому разделению и жидкоподобным и/или гелеобразным свойствам безмембранных органелл и родственных структур.Далее мы обсудим структурные методы, которые могут заглянуть в этот разрыв в масштабе длины.
Макромолекулярные взаимодействия, которые происходят в масштабе длины этого промежутка, ответственны за структурную организацию, которая приводит к фазовому разделению и жидкоподобным и/или гелеобразным свойствам безмембранных органелл и родственных структур.Далее мы обсудим структурные методы, которые могут заглянуть в этот разрыв в масштабе длины.
Высокое разрешение и микроскопия одиночных молекул
Электронная микроскопия может охватывать промежуток между двумя наборами методов, описанных выше, и широко используется для изучения клеточной ультраструктуры [1]. Существенным ограничением этого метода является низкая достоверность, с которой можно идентифицировать конкретные молекулы на основе контраста изображений в оттенках серого [96]. Возникающая область коррелированной световой и электронной микроскопии (CLEM; обзор в [96]) предоставляет возможность прямого соединения динамической информации, полученной с помощью методов живой флуоресцентной микроскопии, с ультраструктурными деталями, полученными с помощью электронной микроскопии.
Значительные успехи были достигнуты за последнее десятилетие в методах микроскопии сверхвысокого разрешения (обзор в [97]) и были успешно применены для расшифровки хромосомной архитектуры [98]. Для изучения ультраструктурной организации зародышевых гранул у C. elegans была применена решетчатая листовая микроскопия в сочетании со структурированной микроскопией освещения, методом, который возвращает трехмерные изображения с разрешением ~ 200 нм x 200 нм в плоскости x/z, превышающим дифракционный предел. [39]. Внутренняя структура, наблюдаемая в нескольких безмембранных органеллах, предполагает, что конденсированные макромолекулы не распределены гомогенно, а далее разделяются на фазы, разделенные на фракции с различными физическими свойствами.Эти методы дают возможность выявить гетерогенную ультраструктуру безмембранных органелл в будущем.
Флуоресцентная микроскопия одиночных молекул обладает большим потенциалом для анализа белков в жидкообразных каплях in vitro и безмембранных органелл в клетках. Например, корреляционная спектроскопия флуоресценции одиночных молекул (FCS) [99] и резонансный перенос энергии Фёрстера (smFRET) [100] использовались для изучения структурных и динамических особенностей склонных к агрегации внутренне неупорядоченных белков in vitro (обзор в [101]).Кроме того, одномолекулярный FRET и другие методы были применены к широкому кругу неупорядоченных белков с различным составом и распределением заряженных остатков (обзор в [102]). Мы предполагаем, что в будущем эти методы будут применяться к неупорядоченным белкам в жидкообразных каплях, чтобы выявить их структурные и динамические особенности. Кроме того, smFRET и флуоресцентная визуализация времени жизни выявили конформационные особенности неупорядоченного белка в клетках HeLa [103], предоставляя возможности в будущем для изучения склонных к фазовому разделению белков в безмембранных органеллах в их естественной клеточной среде.
Например, корреляционная спектроскопия флуоресценции одиночных молекул (FCS) [99] и резонансный перенос энергии Фёрстера (smFRET) [100] использовались для изучения структурных и динамических особенностей склонных к агрегации внутренне неупорядоченных белков in vitro (обзор в [101]).Кроме того, одномолекулярный FRET и другие методы были применены к широкому кругу неупорядоченных белков с различным составом и распределением заряженных остатков (обзор в [102]). Мы предполагаем, что в будущем эти методы будут применяться к неупорядоченным белкам в жидкообразных каплях, чтобы выявить их структурные и динамические особенности. Кроме того, smFRET и флуоресцентная визуализация времени жизни выявили конформационные особенности неупорядоченного белка в клетках HeLa [103], предоставляя возможности в будущем для изучения склонных к фазовому разделению белков в безмембранных органеллах в их естественной клеточной среде.
Дополнительные методы определения физических характеристик
Плотность [1], вязкость [5, 6, 47] и жесткость [79] — это лишь некоторые из физических свойств, которые были измерены для добросовестных безмембранных органелл или in vitro. восстановленных жидких капель. Интерферометрическую микроскопию использовали для измерения плотности ядерных безмембранных органелл в изолированных Xenopus laevis зародышевых пузырьках, ядрах ооцитов [1]. Этот метод дал важную информацию о физических свойствах тугоплавких субклеточных тел в квазиестественной среде.Однако при интерпретации этих данных следует учитывать несколько соображений: результаты основаны на упрощенных предположениях о том, что органеллы имеют сферическую форму и состоят исключительно из гомогенно смешанной воды, белков и низкомолекулярных растворенных веществ [1].
восстановленных жидких капель. Интерферометрическую микроскопию использовали для измерения плотности ядерных безмембранных органелл в изолированных Xenopus laevis зародышевых пузырьках, ядрах ооцитов [1]. Этот метод дал важную информацию о физических свойствах тугоплавких субклеточных тел в квазиестественной среде.Однако при интерпретации этих данных следует учитывать несколько соображений: результаты основаны на упрощенных предположениях о том, что органеллы имеют сферическую форму и состоят исключительно из гомогенно смешанной воды, белков и низкомолекулярных растворенных веществ [1].
Атомно-силовая микроскопия позволяет выполнять сканирование поверхности безмембранных органелл, что позволяет получать топологические карты с разрешением в нанометровом диапазоне. Кроме того, этот метод предоставляет средства для измерения других ключевых биофизических свойств, таких как структурная жесткость, как это делается для ядрышек [79].
Методы микрореологии, традиционно используемые для характеристики вязкоупругих свойств полимеров и сложных жидкостей [104], были применены для характеристики безмембранных органелл [5, 6, 42, 105] и in vitro образующихся белков и белков Капли жидкости -РНК [47, 55]. В частности, технология трассирующих шариков позволила получить важную информацию о влиянии РНК на вязкоупругие свойства капель жидкости in vitro [47, 55].
В частности, технология трассирующих шариков позволила получить важную информацию о влиянии РНК на вязкоупругие свойства капель жидкости in vitro [47, 55].
Вычислительные и теоретические подходы
По мере того, как мы получаем больше знаний о типах макромолекул, которые претерпевают фазовое разделение с образованием жидкоподобных структур как in vitro , так и в клетках, необходимы вычислительные модели для анализа структурных и динамических характеристик, закодированных по их аминокислотным последовательностям, чтобы понять их поведение при разделении фаз.Большая часть белков или белковых областей, которые, как показано, подвергаются фазовому разделению, по своей природе неупорядочены, что создает множество вычислительных проблем, в частности выборку конформации и физическую точность. Для удовлетворения потребности в выборке обширного конформационного пространства, исследуемого IDP/IDR, используется широкий спектр методов, включая методы молекулярной динамики, часто дополняемые такими подходами, как обмен репликами и родственными методами [106, 107], а также методами выборки Монте-Карло. [108, 109].Доступно множество различных силовых полей и их вариантов [110–112], и некоторые из них были недавно протестированы и сравнены [113]. Расчеты часто выполняются без экспериментальных ограничений, и поэтому они зависят от основных силовых полей для создания физически точных молекулярных ансамблей. Проблема в прошлом заключалась в том, что вычислительные модели IDP были слишком компактными [114], но эта проблема решается путем уточнения метода [112, 115–117] и учета данных ЯМР, SAXS и smFRET [110, 113, 118]. .Другая группа подходов использует экспериментальные ограничения (например, данные ЯМР и/или SAXS) для выбора конформеров для включения в ансамбли IDP — так называемые методы «выборки и выбора» [88, 119–121]. Были разработаны дополнительные вычислительные методы для создания ансамблей IDP на основе данных SAXS [122]. Разработка физически точных молекулярных ансамблей с атомистической детализацией для ИДП важна, поскольку, за исключением методов флуоресценции одиночных молекул, экспериментальные методы, используемые для характеристики ИДП, подлежат усреднению по ансамблю.
[108, 109].Доступно множество различных силовых полей и их вариантов [110–112], и некоторые из них были недавно протестированы и сравнены [113]. Расчеты часто выполняются без экспериментальных ограничений, и поэтому они зависят от основных силовых полей для создания физически точных молекулярных ансамблей. Проблема в прошлом заключалась в том, что вычислительные модели IDP были слишком компактными [114], но эта проблема решается путем уточнения метода [112, 115–117] и учета данных ЯМР, SAXS и smFRET [110, 113, 118]. .Другая группа подходов использует экспериментальные ограничения (например, данные ЯМР и/или SAXS) для выбора конформеров для включения в ансамбли IDP — так называемые методы «выборки и выбора» [88, 119–121]. Были разработаны дополнительные вычислительные методы для создания ансамблей IDP на основе данных SAXS [122]. Разработка физически точных молекулярных ансамблей с атомистической детализацией для ИДП важна, поскольку, за исключением методов флуоресценции одиночных молекул, экспериментальные методы, используемые для характеристики ИДП, подлежат усреднению по ансамблю. Таким образом, сгенерированные компьютером ансамблевые модели IDP позволяют исследовать особенности большого количества отдельных молекул. Однако эти подходы только начинают применяться к белкам, подвергающимся фазовому разделению.
Таким образом, сгенерированные компьютером ансамблевые модели IDP позволяют исследовать особенности большого количества отдельных молекул. Однако эти подходы только начинают применяться к белкам, подвергающимся фазовому разделению.
Ключевой задачей вычислительных исследований белков, склонных к фазовому разделению, является понимание межмолекулярных взаимодействий, которые являются основой для самоассоциации и фазового разделения. Что касается этой цели, область находится в зачаточном состоянии. Тем не менее, методологии, применяемые для понимания агрегации белков и образования фибрилл, могут быть использованы для понимания типов взаимодействий, которые управляют разделением белковых фаз и, возможно, в будущем фазовым разделением белков и нуклеиновых кислот.В области агрегации белков были применены многоуровневые вычислительные методы для понимания агрегации полиглутаминовых трактов, связанных с болезнью Гентингтона [123], и атомистические методы для понимания агрегации бета-амилоида [124]. Ясно, что необходимы дополнительные усилия в этой области, чтобы понять молекулярную основу фазового разделения.
Ясно, что необходимы дополнительные усилия в этой области, чтобы понять молекулярную основу фазового разделения.
В то время как вычислительные подходы сталкиваются с проблемами при решении проблемы разделения белковых фаз, в последние годы был достигнут значительный прогресс в понимании взаимосвязей между характеристиками последовательности IDP и IDR и общими конформационными характеристиками ансамблей IDP [125–127].Результаты ЯМР, флуоресценции одиночных молекул и вычислительных подходов показали, что характеристики заряда IDP влияют на форму их динамических ансамблей. Паппу и его коллеги расширили эти данные, используя как вычислительные, так и экспериментальные методы, чтобы показать, что не только доля заряженных остатков и суммарный заряд на остаток в IDP и IDR влияют на их общие конформационные характеристики, но и на распределение противоположно заряженных остатков в последовательностях. существенно влияет на компактизацию ансамблей IDP [128].Эти достижения привели к разработке новой фазовой диаграммы, основанной на суммарных значениях положительного и отрицательного заряда на остаток для классификации последовательностей IDP и IDR [129]. Эти разработки обеспечивают концептуальную основу для установления отношений между характеристиками заряда IDP и IDR, их конформационными характеристиками и их склонностью к фазовому разделению. Особенности заряда, безусловно, являются важными факторами, определяющими поведение белковых фаз при разделении фаз; например, остатки аргинина преобладают в областях низкой сложности, которые, как известно, образуют жидкоподобные капли in vitro и внутри белковых компонентов безмембранных органелл [44, 47].Однако эти последовательности часто обогащены ароматическими и другими нейтральными аминокислотами, что указывает на то, что, хотя электростатические взаимодействия могут играть важную роль в некоторых случаях, в других случаях играют роль другие типы молекулярных взаимодействий [48, 50, 53]. Это подтвердилось в недавнем исследовании García Quiroz и Chilkoti [130], в котором они определили особенности последовательности сконструированных белков, которые могут подвергаться фазовому разделению либо из-за повышения температуры (так называемые последовательности LCST), либо из-за снижения (так называемые последовательности UCST).
Эти разработки обеспечивают концептуальную основу для установления отношений между характеристиками заряда IDP и IDR, их конформационными характеристиками и их склонностью к фазовому разделению. Особенности заряда, безусловно, являются важными факторами, определяющими поведение белковых фаз при разделении фаз; например, остатки аргинина преобладают в областях низкой сложности, которые, как известно, образуют жидкоподобные капли in vitro и внутри белковых компонентов безмембранных органелл [44, 47].Однако эти последовательности часто обогащены ароматическими и другими нейтральными аминокислотами, что указывает на то, что, хотя электростатические взаимодействия могут играть важную роль в некоторых случаях, в других случаях играют роль другие типы молекулярных взаимодействий [48, 50, 53]. Это подтвердилось в недавнем исследовании García Quiroz и Chilkoti [130], в котором они определили особенности последовательности сконструированных белков, которые могут подвергаться фазовому разделению либо из-за повышения температуры (так называемые последовательности LCST), либо из-за снижения (так называемые последовательности UCST). Последовательности LCST были обогащены гидрофобными остатками, тогда как последовательности UCST были обогащены остатками заряда [131]. Это исследование, включающее теоретические соображения, а также экспериментальных измерений in vitro, служит моделью для будущих исследований физических основ фазового разделения растущего списка белков и молекул РНК, которые, как показано, разделяются на жидкости или гели. -подобная фаза безмембранных органелл и других клеточных тел.
Последовательности LCST были обогащены гидрофобными остатками, тогда как последовательности UCST были обогащены остатками заряда [131]. Это исследование, включающее теоретические соображения, а также экспериментальных измерений in vitro, служит моделью для будущих исследований физических основ фазового разделения растущего списка белков и молекул РНК, которые, как показано, разделяются на жидкости или гели. -подобная фаза безмембранных органелл и других клеточных тел.
Интегративные подходы к пониманию молекулярной основы фазового разделения
Ни один из рассмотренных выше отдельных методов или подходов сам по себе не раскрывает молекулярную основу фазового разделения белков и смесей белок-нуклеиновые кислоты; следовательно, необходимо применять несколько дополнительных методов и интегрировать результаты для углубления понимания механизмов.Интеграция необходима для охвата широких масштабов длины, относящихся к безмембранным органеллам, от атомного масштаба (единицы Å), относящиеся к конформациям аминокислот и их межмолекулярным взаимодействиям, до общего размера in vitro жидкоподобных капель.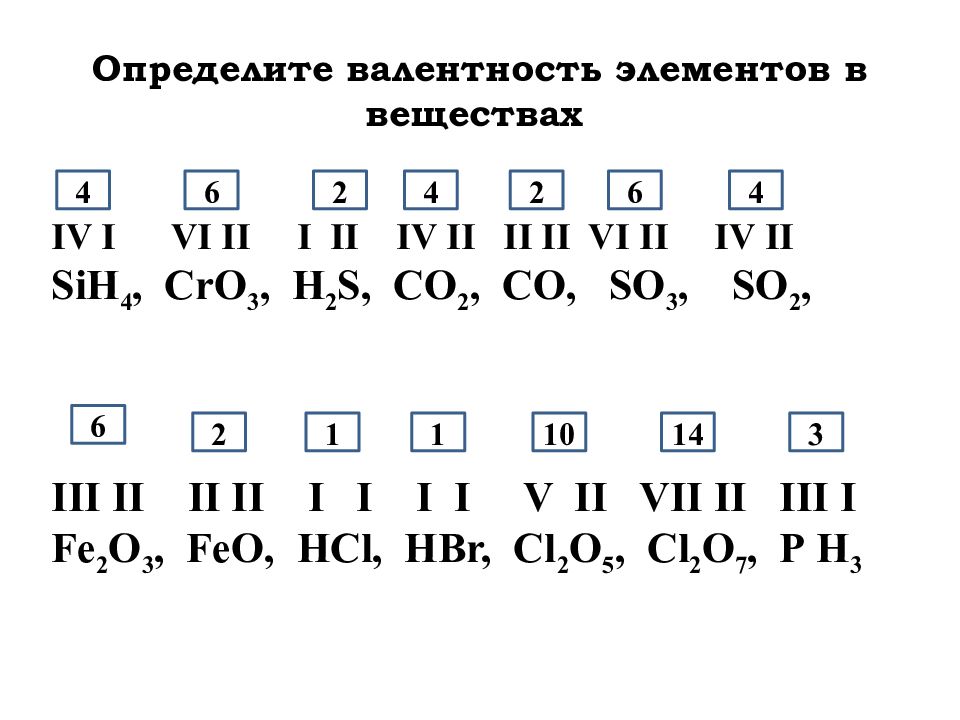 и клеточные безмембранные органеллы (единицы микрометров). Интеграция также необходима в широком диапазоне соответствующих временных масштабов, включая движения аминокислот и их полипептидных цепей, которые опосредуют их конформационную гетерогенность и межмолекулярные взаимодействия во временном масштабе от нс до мкс, диффузию макромолекул внутрь и наружу, а внутри — жидкоподобные структуры на временной шкале от секунд до десятков секунд.Основная задача состоит в том, чтобы понять взаимосвязь между конформационными характеристиками и движениями аминокислот в атомном масштабе и макроскопическими свойствами этих структур (например, вязкостью, поверхностным натяжением, скоростью диффузии макромолекул и т. д.).
и клеточные безмембранные органеллы (единицы микрометров). Интеграция также необходима в широком диапазоне соответствующих временных масштабов, включая движения аминокислот и их полипептидных цепей, которые опосредуют их конформационную гетерогенность и межмолекулярные взаимодействия во временном масштабе от нс до мкс, диффузию макромолекул внутрь и наружу, а внутри — жидкоподобные структуры на временной шкале от секунд до десятков секунд.Основная задача состоит в том, чтобы понять взаимосвязь между конформационными характеристиками и движениями аминокислот в атомном масштабе и макроскопическими свойствами этих структур (например, вязкостью, поверхностным натяжением, скоростью диффузии макромолекул и т. д.).
Несколько исследований начали решать проблемы, связанные с охватом этих широких масштабов длины и времени. Например, в недавнем отчете были рассмотрены конформационные особенности белка FG-Nup, Nup153, и то, как эти особенности опосредуют сверхбыстрые взаимодействия с ядерным транспортным рецептором, Importin β [132]. Хотя это исследование не связано с разделением фаз как таковым , это исследование дает объяснение того, как импортин β-связанный груз может быстро диффундировать через конденсированную фазу внутри ядра комплекса ядерной поры, который состоит из нескольких белков FG-Nup, в том числе НУП153. Спектроскопию ЯМР использовали для понимания усредненных по ансамблю конформационных и динамических характеристик амидных групп основной цепи в неупорядоченном Nup153 в отсутствие и в присутствии Importin-β, а также для создания конформационного ансамбля с использованием подхода «образец и выбор».Этот ансамбль был подтвержден обратным расчетом профиля рассеяния рентгеновских лучей и сравнением с экспериментальными данными SAXS, иллюстрирующими шкалу длины от аминокислот до всего неупорядоченного белка. Чтобы дополнить эту информацию, данные smFRET и измерения времени жизни флуоресценции использовались для понимания конформационных особенностей многих отдельных молекул в тех же условиях, в то время как корреляционная спектроскопия флуоресценции использовалась для сравнения свойств молекулярной диффузии Nup153 без импортина β и с ним.
Хотя это исследование не связано с разделением фаз как таковым , это исследование дает объяснение того, как импортин β-связанный груз может быстро диффундировать через конденсированную фазу внутри ядра комплекса ядерной поры, который состоит из нескольких белков FG-Nup, в том числе НУП153. Спектроскопию ЯМР использовали для понимания усредненных по ансамблю конформационных и динамических характеристик амидных групп основной цепи в неупорядоченном Nup153 в отсутствие и в присутствии Importin-β, а также для создания конформационного ансамбля с использованием подхода «образец и выбор».Этот ансамбль был подтвержден обратным расчетом профиля рассеяния рентгеновских лучей и сравнением с экспериментальными данными SAXS, иллюстрирующими шкалу длины от аминокислот до всего неупорядоченного белка. Чтобы дополнить эту информацию, данные smFRET и измерения времени жизни флуоресценции использовались для понимания конформационных особенностей многих отдельных молекул в тех же условиях, в то время как корреляционная спектроскопия флуоресценции использовалась для сравнения свойств молекулярной диффузии Nup153 без импортина β и с ним. Кроме того, были использованы вычислительные методы молекулярной динамики и броуновской динамики, чтобы связать результаты вышеупомянутых биофизических методов с механизмом взаимодействия Nup153 / Importin β при атомистическом разрешении. Наконец, эти различные фрагменты молекулярных данных были связаны с Importin-β-зависимым транспортом через NPCs в живых клетках с использованием отслеживания объемной и одночастичной флуоресценции.
Кроме того, были использованы вычислительные методы молекулярной динамики и броуновской динамики, чтобы связать результаты вышеупомянутых биофизических методов с механизмом взаимодействия Nup153 / Importin β при атомистическом разрешении. Наконец, эти различные фрагменты молекулярных данных были связаны с Importin-β-зависимым транспортом через NPCs в живых клетках с использованием отслеживания объемной и одночастичной флуоресценции.
Другим примером является недавнее исследование белка, ассоциированного с БАС, FUS, проведенное Fawzi с соавторами, которое использовало ЯМР и различные методы флуоресцентной микроскопии для изучения молекулярных особенностей FUS в in vitro жидкоподобных каплях и его взаимодействия с РНК и С-концевым доменом РНК Pol II.Последний пример представлен недавним исследованием широко распространенного ядрышкового белка NPM1, который, как было показано, разделяется на фазы, образуя жидкоподобные капли с другими ядрышковыми белками и рибосомной РНК [NPM1 интегрируется в ядрышко посредством мультимодальных взаимодействий с белками, проявляющими R-богатые линейные мотивы и рРНК: Mitrea DM и др. , в обзоре]. ЯМР, smFRET и SANS использовались для понимания конформационных и динамических особенностей NPM1 до и после фазового разделения с пептидом, полученным из рибосомного белка, rpL5, и выявили молекулярную организацию, простирающуюся до ~ 10 нм внутри жидкоподобных капель.Кроме того, анализ делеций идентифицировал домены NPM1, необходимые для фазового разделения in vitro и для локализации внутри ядрышек в клетках.
, в обзоре]. ЯМР, smFRET и SANS использовались для понимания конформационных и динамических особенностей NPM1 до и после фазового разделения с пептидом, полученным из рибосомного белка, rpL5, и выявили молекулярную организацию, простирающуюся до ~ 10 нм внутри жидкоподобных капель.Кроме того, анализ делеций идентифицировал домены NPM1, необходимые для фазового разделения in vitro и для локализации внутри ядрышек в клетках.
Три исследования, рассмотренные выше, иллюстрируют подходы к соотнесению молекулярных характеристик склонных к фазовому расслоению белков, изучаемых с атомарным разрешением, с макроскопическими характеристиками жидкоподобных структур, которые они образуют. Важно отметить, что два исследования также объединили результаты клеточных анализов, что позволило связать молекулярные особенности с биологической функцией.Мы только начинаем понимать физические свойства белков, склонных к фазовому разделению, которые связаны с их локализацией в безмембранных органеллах, и с нетерпением ждем результатов таких же авантюрных интегративных исследований, чтобы расширить наши знания об этих особенностях и, что важно, о том, как они вносят свой вклад.



 Слайд 25.
Слайд 25. ).
). Расположите их в таком порядке, чтобы внизу получилось название индикатора.
Расположите их в таком порядке, чтобы внизу получилось название индикатора. А. Каверина. – М.АСТ,2002. – 190 с.
А. Каверина. – М.АСТ,2002. – 190 с. У меня есть ш и ЗСа + 2н3р04 — > — СА3 (P04) 2-ф — 3h3t
У меня есть ш и ЗСа + 2н3р04 — > — СА3 (P04) 2-ф — 3h3t Типичным примером является реакция нейтрализации(<;. 73). Учитывая летучесть, прочность и растворимость кислот (нерастворимая кремниевая кислота h3Si03), их обычно можно расположить в порядке отделения друг от друга солей. Эта строка равна 1. h3S04, HC1, HN03, h4P04, h3S03,h3C03, h3S, h3Si03 Аналог.
Типичным примером является реакция нейтрализации(<;. 73). Учитывая летучесть, прочность и растворимость кислот (нерастворимая кремниевая кислота h3Si03), их обычно можно расположить в порядке отделения друг от друга солей. Эта строка равна 1. h3S04, HC1, HN03, h4P04, h3S03,h3C03, h3S, h3Si03 Аналог.

 Он часто используется в медицинских исследованиях и консервации. Этот элемент нерадиоактивен и поэтому иногда может использоваться в сельскохозяйственной практике.Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку в отличие от азота-14 (ядерный спин 1) он имеет ядерный спин 1/2, что имеет преимущества, когда дело доходит до наблюдения за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не увидели его полного потенциала для использования в исследованиях мозга.
Он часто используется в медицинских исследованиях и консервации. Этот элемент нерадиоактивен и поэтому иногда может использоваться в сельскохозяйственной практике.Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку в отличие от азота-14 (ядерный спин 1) он имеет ядерный спин 1/2, что имеет преимущества, когда дело доходит до наблюдения за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не увидели его полного потенциала для использования в исследованиях мозга.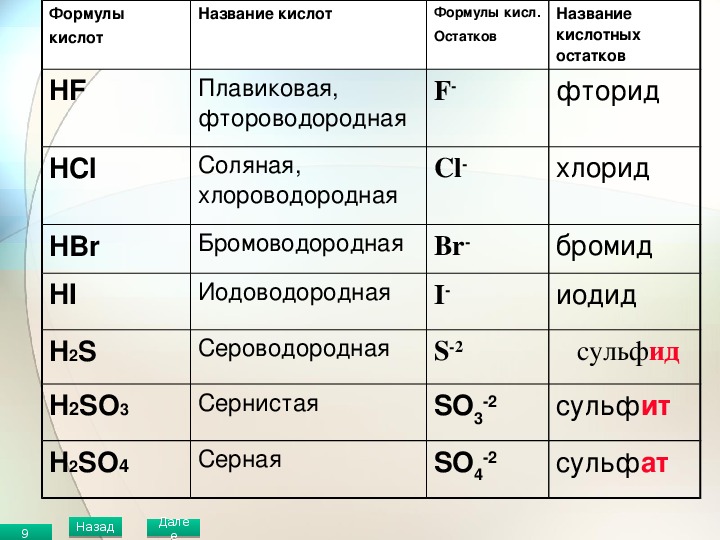

 …
…