Восстановительная способность металлов — Справочник химика 21
I. Восстановительная способность металлов [c.71]В ряду металлы расположены в порядке возрастания алгебраической величины их стандартных электродных потенциалов в водных растворах при 25 С. Буквами —пе указано число электронов, отдаваемых атомом, а +ле— число электронов, принимаемых его ионом. Стрелками указано усиление восстановительной способности металлов и усиление окислительной способности их ионов. [c.157]
Увеличение восстановительной способности металлов [c.155]
Как изменяется восстановительная способность металлов в главных подгруппах 1 и II групп сверху вниз [c.293]
Ряд напряжений характеризует химические свойства металлов. Он используется при рассмотрении последовательности разряда ионов при электролизе, а также при описании общих свойств металлов. При этом величины стандартных электродных потенциалов дают количественную характеристику восстановительной способности металлов и окислительной способности их ионов.
Следует также подчеркнуть, что ряд напряжений характеризует восстановительную способность металлов и окислительную способность их ионов только в водных растворах. Так, например, в реакции [c.145]
Как уже отмечалось, при погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающая между металлом и окружающей его жидкой средой, называется электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы. Заметим, что у изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
[c.79]При переходе от лантана к лютецию восстановительная способность металла. .. (уменьшается, возрастает). Самый сильный восстановитель среди лантаноидов —. … [c.372]
Взаимодействие металлов с простыми веществами. Наиболее энергично восстановительные способности металлов проявляются в их реакциях с галогенами и кислородом [c.97]
Положение некоторых элементов, например Ы, N3, в ряду напряжений может показаться неожиданным. Оно прежде всего свидетельствует о недопустимости отождествления восстановительной способности металлов в водных растворах с восстановительной активностью соответствующих металлических элементов. [c.197]
Ряд стандартных электродных потенциалов характеризует химические свойства металлов. Он используется для определения последовательности разряда нонов при электролизе, а также для описания общих свойств металлов. При этом величины стандартных электродных потенциалов количественно характеризуют восстановительную способность металлов и окислительную способность их ионов.
I металла можно воспользоваться гальваническим элемен- том — системой из двух электродов, одним из которых служит нормальный водородный электрод, а другим — электрод испытуемого металла, погруженный в раствор его соли с активностью катиона 1 г-ион/л. Электродвижущая сила такого гальванического элемента характеризует окисли- тельно-восстановительную способность металла относи-, тельно стандартного водородного электрода и представляет собой, таким образом, его стандартный потенциал. [c.182]
Как уже отмечалось, при погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы.
[c.141]ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ 6. Восстановительная способность металлов [c.258]
Мерой прочности связи электронов в атомах является величина энергии ионизации, или ионизационного потенциала (гл. II, 17). Очевидно, что восстановительная способность металлов связана с величиной энергии ионизации их атомов. Наименьшие значения ионизационного потенциала у щелочных металлов, которые и являются самыми энергичными восстановителями. [c.258]
Чем легче атомы металла отдают валентные электроны, тем сильнее выражена восстановительная способность металла, тем легче он окисляется (см. 3, гл. IX). [c.246]
С повышением температуры восстановительная способность металлов возрастает. Например, алюминий при высокой температуре восстанавливает железо из его окислов по уравнению
Восстановительная способность металла в данном растворе зависит от количества металла, перешедшего в раствор под действием ионов водорода, кислорода, индикаторных ионов и т. д., а также от количества, имеющегося в реактивах, применяемых для приготовления растворов. Во всех случаях концентрация ионов металла, несомненно. Ограничена, в противном случае окислительный потенциал имел бы неограниченно большое значение. [c.138]
Положение элементов в электрохимическом ряду напряжений отличается от их последовательности в периодической системе. Например, начинается он самым неактивным из щелочных металлов— литием. Это означает, что восстановительная способность металлов в водных растворах определяется иными причинами. Общая электродная реакция (У.ИТ) состоит из ряда последовательных стадий [c.156]
Надо иметь в виду, что ряд напряжений позволяет судить о восстановительной способности металлов, об их химической активности лишь в окислительно-восстано-вительных реакциях, протекающих в водной среде. В сухих реакциях цезий значительно активней лития. Например, на воздухе цезий самовоспламеняется, а с литием этого не происходит. В реакциях натрий более активен, чем кальций. Это находится в соответствии с их положением в периодической системе. Однако в водной сред
www.chem21.info
Общие свойства металлов исправл
2
Лабораторная работа
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Цель работы: исследование восстановительной способности металлов в воде, а также в водных растворах щелочей и различных кислот.
Металлы и их сплавы широко используются во многих отраслях промышленности, они являются основными конструкционными материалами в машиностроении.
Металлы составляют около 80 % от всех известных химических элементов. К металлам относятся элементы s, d и f -электронных семейств, а также р-элементы главных подгрупп: III (кроме В), IV (Ge, Sn, Pb), V (Sb, Bi), VI (Po).
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Особое строение кристаллических решеток металлов обусловливает их общие свойства. К общим физическим свойствам металлов относят их высокую электропроводность, теплопроводность, пластичность, ковкость, металлический блеск.
Общность химических свойств металлов обусловлена особенностям строения их атомов: сравнительно большими размерами атомов, значительной удаленностью внешних электронов от ядра и слабой связью с ним. В химическом отношении все металлы, имея на внешнем электронном уровне небольшое количество валентных электронов, характеризуются сравнительной легкостью их отдачи и способностью образовывать положительно заряженные ионы, проявляя при этом восстановительные свойства:
Me — nē → Men+.
При определении химической активности металла кроме энергии ионизации (энергии отрыва электрона от атома) необходимо учитывать энергию, которая тратится на разрушение кристаллической решетки, а также энергию, которая выделяется при гидратации ионов.
Характеристикой восстановительной способности (химической активности) металлов может служить величина стандартного электродного потенциала металла. Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов (табл.1).
Закономерности, отраженные в этой схеме, условны. Однако схема помогает ориентироваться в некоторых химических процессах. Металлы размещены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Этот ряд характеризует химическую активность
Таблица 1
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
Способность атомов отдавать электроны
(окисляться)
Возрастает

Взаимодействие с кислородом
воздуха
Быстро окисляются при обычной температуре
Медленно окисляются при обычной
температуре или при нагревании
Не окисляются
Взаимодействие
с водой
При обычной температуре выделяется Н2 и образуется гидроксид
При нагревании выделяется Н2 и образуются оксиды
Н2 из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с конц. и разб. HNO3 и с конц. H2SO4 при нагревании
С кислотами не реагируют, растворяются в царской водке
Нахождение в природе
Только в соединениях
В соединениях и в свободном виде
Главным образом в свободном виде
Способы получения
Электролиз расплавов
Восстановление углем, оксидом углерода (II), алюминотермия или электролиз водных растворов солей
Способность ионов присоединять электроны (восстановливаться)
Li+ K+ Ca2+ Na+ Mg2+ Al3+ Mn2+ Zn2+ Cr3+ Fe2+ Ni2+ Sn2+ Pb2+ (H+) Cu2+ Hg2+ Ag+ Pt2+ Au3+
В
 озрастает
озрастает
металлов только в окислительно-восстановительных реакциях, протекающих в водной среде. Чем меньше алгебраическая величина потенциала металла, тем более сильным восстановителем он является.
Как восстановители металлы взаимодействуют с простыми и сложными окислителями. К простым окислителям относятся элементарные неметаллы, к сложным – вода, водные растворы и расплавы щелочей, кислоты.
Взаимодействие металлов с элементарными окислителями. Как правило, металлы окисляются элементами, электроотрицательность которых выше, чем у металла. Однако на химическую активность металла оказывают влияние химическая активность самого элементарного окислителя, а также энергия диссоциации молекул элементарного окислителя.
Взаимодействие металлов с водой. Чтобы реакция с металлами протекала с водой необходимо выполнение следующих условий:
а) Потенциал металла в нейтральной среде должен быть меньше потенциала окислителя (воды): ЕМеn+/Мe < Еокисл.. Теоретически водород из воды могут вытеснять только те металлы, потенциалы которых более отрицательны, чем -0,414В, т. е. стоящие вряду напряжений до кадмия:
2Na + 2H2O = 2NaOH + H2
б) Продукты реакции взаимодействия металла со средой (могут быть, оксиды, гидроксиды) должны быть растворимы в реакционной среде. В случае образования малорастворимых соединений, а большинство гидроксидов металлов являются именно таковыми, они пассивируют поверхность металла, и реакция, едва начавшись, тут же прекращается или протекает крайне медленно.
Рассматривая взаимодействие металлов с водой, нельзя не учитывать, что большинство металлов имеют на своей поверхности прочную оксидную пленку, обладающую защитными функциями. Чаще всего именно она является причиной невозможности протекания реакции между достаточно активным металлом и водой.
Взаимодействие металлов с кислотами. При взаимодействии металлов с разбавленными кислотами (за исключением разбавленной азотной кислоты) окислителем является ион водорода H+. К числу таких кислот, содержащих в качестве окислителя ион H+, относятся кислоты, не содержащие кислорода в анионе (бескислородные кислоты): HF, HCl, HBr, HJ, H2S, H2Se, H2Te или кислоты с устойчивыми анионами, имеющие низкие окислительно-восстанови-тельные потенциалы (H2СO3, H3ВO3, H3РO4 и др.), а также разбавленная серная кислота H2SO4. Разбавленные кислоты, содержащие в качестве окислителя только ионы водорода H+, могут взаимодействовать с относительно сильными восстановителями. В таких кислотах растворяются только металлы, окислительно-восстановительный потенциал которых ниже потенциала водородного электрода 2H+ /H2, то есть с металлами, стоящими в ряду стандартных потенциалов левее водорода:
Fe + H2SO4(разб) = FeSO4 + H2
Однако те металлы, электродные потенциалы которых имеют положительные значения, окисляются аэрированными растворами кислот:
2Cu + O2 + 4HCl = 2CuCl2+ 2H2O.
Окислительные свойства кислот, обусловленные анионом кислоты, проявляются более сложно, так как в большинстве случаев элемент, образующий анион кислоты, может восстанавливаться до разных степеней окисления.
В концентрированной серной кислоте роль окислителя выполняет ион – SO42- Степень восстановления серы из иона SO42- зависит от природы восстановителя: 4Mg + 5H2SO4(конц) = 4MgSO4 + H2S + 4H2O.
В азотной кислоте любой концентрации окислителем будет анион- NO3− в силу значительно большего потенциала нитрат-иона по сравнению с потенциалом водородного электрода. Степень восстановления нитрат-иона зависит как от концентрации кислоты, так и от окислительно-восстановительного потенциала металла.Чем выше концентрация кислоты, тем менее глубоко восстанавливается ион NO3−: 4Mg + 10HNO3(разб) = 4Mg(NO3)2 + NH4NO3 +3H2O.
Сu + 4НNО3(конц.)= Сu(NО3)2 + 2NО2 + 2Н2О
Таким образом, в результате взаимодействия кислоты с металлом образуются соответствующая соль, вода и какой либо из продуктов восстановления аниона (табл.2).
Таблица 2.
Основные продукты восстановления азотной и серной кислоты металлами**¶
Металлы | Li, Cs, Rb, K, Ba, Ca, Na, Mg, Al* Активные | Mn*, Zn, Cr*, Fe*, Cd, Co*, Ni*, Sn, Pb* Средней активности | Bi*, Cu, Ru, Hg, Ag, Rh, Pd Малоактивные | Ir, Pt, Au Благородные |
Концентрация HNO3, % мас. | ||||
больше 80% (очень конц. р-ры) | NO2 | NO2 | NO2 | − |
45 – 75 % (конц. р-ры) | N2O | NO | NO2 | − |
10 – 40 % (разбав. р-ры) | N2 | N2O | NO | |
меньше 5% (очень разбавл. р-ры) | NH4NO3 | N2 | − | − |
H2SO4 (конц.) | H2S (S) | S (SO2) | SO2 |
*Металлы, которые пассивируются в кислоте при комнатной температуре
**Обычно одновременно образуются несколько продуктов восстановления кислотного остатка.
Со щелочами будут взаимодействовать металлы, склонные к образованию гидроксокомплексов типа [Me(OH)4 ]x−, то есть металлы, чьи гидроксиды являются амфотерными Ве(OH)2, (Al(OH)3, Zn(OH)2, Sn(OH)2, Рb(OH)2, Cr(OH)3 и др.: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
При взаимодействии металлов с растворами солей должны соблюдаться следующие условия: а) металл должен находиться в ряду напряжений левее металла, образующего соль;
Fe0+Cu2+Cl2– —>Fe2+Cl2– +Cu0
б) в результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
в) для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе соли.
Экспериментальная часть
Опыт 1. Взаимодействие алюминия с водой.
Тщательно зачистите два кусочка алюминия, опустите один из них в пробирку с нитратом ртути Hg(NO3)2. Что наблюдаете? Поместите затем оба кусочка алюминия в пробирки с водой. Отметьте выделение водорода в одной из пробирок. Напишите уравнения реакций.
Опыт 2. Взаимодействие металлов с разбавленными кислотами.
Испытайте действие 2 н растворов соляной, серной и азотной кисло на металлы. Во всех ли случаях протекает реакция на холоду? Осторожно нагрейте пробирки. Что наблюдаете? Результаты занесите в таблицу.
Основные продукты взаимодействия разбавленных кислот с металлами, условия протекания реакций
Металлы | 2 н HCl | 2 н H2SO4 | 2 н HNO3 |
Cd | |||
Sn | |||
Pb | |||
Bi |
Напишите уравнения реакций, составьте электронные схемы реакций. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Опыт 3. Взаимодействие металлов с концентрированными кислотами.
Испытайте действие концентрированных растворов соляной, серной и азотной кисло на металлы. Во всех ли случаях протекает реакция на холоду? Осторожно нагрейте пробирки. Что наблюдаете? Результаты занесите в таблицу.
Основные продукты взаимодействия концентрированных кислот с металлами, условия протекания реакций
Металлы | HCl, конц. | H2SO4, конц. | HNO3, конц. |
Cd | |||
Sn | |||
Pb | |||
Bi |
Напишите уравнения реакций, составьте электронные схемы реакций. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Опыт 4. Взаимодействие олова раствором щелочи
В пробирку поместите один кусочек предварительно зачищенного олова прибавьте 5-6 капель концентрированного раствора NaOH и нагрейтепробирку. Отметьте медленное выделение водорода. Запишите уравнение реакции, учитывая, что получается гексагидроксостаннат(II) щелочного металла [Sn(OH)4]2ˉ.
Опыт 5. Взаимодействие металлов растворами солей
В шесть пробирок попарно внести по 2 мл растворов солей сульфата цинка, сульфата железа (II), сульфата меди (II). В две пробирки с солями железа и меди опустите по кусочку цинка, в две пробирки с солями цинка и меди по кусочку железа, в две пробирки с солями цинка и железа опустите по кусочку меди. Металлы предварительно зачистите наждачной бумагой. Наблюдайте, в каких случаях происходит вытеснение металлов из растворов их солей.
Выпишите из таблицы электродные потенциалы окислителя и восстановителя. Рассчитайте э.д.с. каждой реакции, сделайте вывод о возможности их протекания. Запишите уравнения реакций. Расположите исследуемые металлы в ряд по убыванию их восстановительной способности.
Контрольные вопросы.
Какие элементы периодической системы можно отнести к металлам?
Укажите особенности строения атомов металлов.
Перечислите основные физические характеристики, отличающие металлы от неметаллов.
Какое химическое свойство характерно для всех металлов?
Особенности взаимодействия металлов с разбавленными соляной и серной кислотами.
Особенности взаимодействия металлов с азотной кислотой, концентрированной серной кислотой.
Что такое пассивация? Каковы причины пассивации металлов?
Какой из предложенных металлов Мg, Al, Ni, Cu будет растворяться в водном растворе щелочи?
Основные продукты восстановления азотной и серной кислот металлами**¶
Металлы | Li, Cs, Rb, K, Ba, Ca, Na, Mg, Al* Активные | Mn*, Zn, Cr*, Fe*, Cd, Co*, Ni*, Sn, Pb* Средней активности | Bi*, Cu, Ru, Hg, Ag, Rh, Pd Малоактивные | Ir, Pt, Au Благородные |
Концентрация HNO3, % мас. | ||||
больше 80% (очень конц. р-ры) | NO2 | NO2 | NO2 | − |
45 – 75 % (конц. р-ры) | N2O | NO | NO2 | − |
10 – 40 % (разбав. р-ры) | N2 | N2O | NO | |
меньше 5% (очень разбавл. р-ры) | NH4NO3 | N2 | − | − |
H2SO4 (конц.) | H2S (S) | S (SO2) | SO2 |
*Металлы, которые пассивируются в кислоте при комнатной температуре
Основные продукты восстановления азотной и серной кислот металлами**¶
Металлы | Li, Cs, Rb, K, Ba, Ca, Na, Mg, Al* Активные | Mn*, Zn, Cr*, Fe*, Cd, Co*, Ni*, Sn, Pb* Средней активности | Bi*, Cu, Ru, Hg, Ag, Rh, Pd Малоактивные | Ir, Pt, Au Благородные |
Концентрация HNO3, % мас. | ||||
больше 80% (очень конц. р-ры) | NO2 | NO2 | NO2 | − |
45 – 75 % (конц. р-ры) | N2O | NO | NO2 | − |
10 – 40 % (разбав. р-ры) | N2 | N2O | NO | |
меньше 5% (очень разбавл. р-ры) | NH4NO3 | N2 | − | − |
H2SO4 (конц.) | H2S (S) | S (SO2) | SO2 |
*Металлы, которые пассивируются в кислоте при комнатной температуре
2
studfile.net
Восстановительная способность — Справочник химика 21
Водород проявляет и восстановительные, и окислительные свойства. В обычных условиях благодаря прочности молекул он сравнительно мало активен и непосредственно взаимодействует лишь со фтором. При нагревании же вступает во взаимодействие с многими неметаллами — хлором, бромом, кислородом и пр. Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галидов [c.274]Как уже отмечалось, при погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающая между металлом и окружающей его жидкой средой, называется электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы. Заметим, что у изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома. [c.79]
Весьма важным является определение самой возможности протекания окислительно-восстановительной реакции и установление ее продуктов даже при наличии двух веществ, из которых одно может выполнить функцию восстановителя или окислителя по отношению к другому, ii связи с этим необходимо подчеркнуть, что мерой окислительно-восстановительной способности веществ служат их окислительно-восстановительные потенциалы, значение которых зависит от многих факторов, в том числе и от реакции среды. Однако во многих случаях полезно и без предварительного теоретического обо- [c.146]
Для изучения влияния добавки комплексообразователя на окислительно-восстановительную способность исследуемых систем, добавить в составленные смеси 5—10 мл насыщенного раствора фторида [c.308]
Последние величины иллюстрируют уменьшение химической активности элементов V, VI и VII групп и,как следствие, рост неустойчивости ЭНз, ЭНг и ЭН с увеличением порядкового номера Э в то же время они свидетельствуют об усилении восстановительной активности соединений в этих вертикальных рядах. Изменение восстановительной способности для ряда НГ можно показать и на примере следующих реакций [c.259]
Энтальпия гидратации ионов лития существенно больше, чем ионов калия, и перекрывает различия в энтальпии атомизации и ионизации (рис. 93). Поэтому литий обладает в водном растворе большей восстановительной способностью, чем калий. [c.173]
В табл. 56 приведены значения реакционной восстановительной способности различных коксов, определенной следующим методом [51]. Через измельченный кокс (фракции 0,5— [c.221]
Для оценки содержания в различных целлюлозных препаратах карбонильных фупп (альдегидных, кетонных) существует ряд методов. Первая фуппа методов определения карбонильных Фупп основана на использовании их восстановительной способности (так называемые «медные» и «ионные» числа), вторая ФУппа — на получении оксимов и фенилгидразонов. Первая Фуппа способов позволяет оценить — содержание преимущественно альдегидных фупп, вторая — суммарное количество карбонилов в целлюлозе. Очевидно, что по разности можно вычислить содержание в целлюлозном препарате кетонных Фупп. [c.300]
Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность. [c.81]
Окислительно-восстановительный потенциал. Для количествен ной характеристики окислительно-восстановительной способности веществ, находящихся в растворах или соприкасающихся с ними, используют электродные (окислительно-восстановительные) потенциалы [c.164]
Очевидно, что при гидролизе уменьшается молекулярная масса целлюлозы и возрастает ее восстановительная способность в результате увеличения количества глюкозидных гидроксилов (скрытых альдегидных групп). Гидроцеллюлоза (в отличие от исходной целлюлозы) способна растворяться в щелочах. [c.296]
Ниже приведены значения медного числа (по Швальбе), характеризующие восстановительную способность различных образцов целлюлозы [c.301]
Для определения стандартного потенциала какого-лйбо металла можно воспользоваться гальваническим элементом — системой из двух электродов, одним из которых служит нормальный водородный электрод, а другим — электрод испытуемого металла, погруженный в раствор его соли с активностью катиона 1 моль л . Электродвижущая сила такого гальванического элемента характеризует окислительно-восстановительную способность металла относительно стандартного водородного электрода и представляет собой, таким образом, его стандартный потенциал. [c.159]
Выше говорилось о влиянии замены кокса другим топливом на энергетику шахтной печи. Технологическое влияние этой замены всегда благоприятно, так как указанная замена приводит к увеличению восстановительной способности газовой фазы (см. табл. 4). — [c.157]
Формальдегид обладает большой склонностью к полимеризации. Его наиболее устойчивым полимером является а-т р и о к с и м е т и л е н (1,3,5-триоксан) —кристаллическое вещество, которое перегоняется без разложения, не обладает восстановительной способностью и по своему [c.210]
Из рассматриваемых оксидов наиболее отрицательное значение АС имеет Л12О3. Следовательно, алюминий может выступать в качестве восстановителя любого из этих оксидов. Восстановительная способность водорода более ограничена. Он может быть применен для восстановления Си О и Н 0. [c.244]
Восстановительная способность углерода с увеличением температуры резко возрастает (кривая АС идет вниз). Поэтому углерод при соответствующих высоких температурах может быть потенциальным восстановителем почти всех оксидов. Так, его восстановительная активность по отношению к ТЮ 2 и Н 2О может проявиться при температурах выше 1600 и 750 К соответственно, т. е. когда вследствие усиления энтропийного фактора значение АС для СО становится более отрицательным, чем для Т102 и Н оО. [c.244]
Перекись — соединения железа — углеводы. Системы с участием сахаров применимы для инициирования полимеризации при температуре около 5 °С только в щелочных средах (pH = 10—11). Наиболее акт
www.chem21.info
Химические свойства металлов
Химические свойства металлов В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью образовывать положительно заряженные ионы. Следовательно, металлы в свободном состоянии являются восстановителями.Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов:
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt AuМеталлы размещены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Этот ряд характеризует химическую активность металлов только в окислительно-восстановительных реакциях, протекающих в водной среде.
Характерными свойствами для металлов являются следующие:
Восстановление неметаллов
Реакции с галогенами и кислородом воздуха протекают с различными скоростями и при различных температурах с разными металлами. Так, щелочные металлы легко окисляются кислородом воздуха и взаимодействуют с простыми веществами, железо и медь взаимодействуют с простыми веществами только при нагревании, золото и платиновые металлы не окисляются вообще. Многие металлы образуют
на поверхности оксидную пленку, которая защищает их от дальнейшего окисления.
2Мg + О2 = 2МgО
4Аl + ЗО2 = 2А12О3
2К + Сl2 = 2КСl
Менее энергично металлы взаимодействуют с серой:
Сu + S = СuS
Fе + S = FеS
Трудно вступают в реакцию с азотом и фосфором:
ЗМg + N2 = Мg3N2 (нитрид магния)
ЗСа + 2Р = Са3Р2 (фосфид кальция)
Активные металлы взаимодействуют с водородом:
Са + Н2 = СаН2 (гидрид кальция)
Взаимодействие с водой
Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода:
2Nа + 2Н2О == 2NаОН + Н2
Са + 2Н2О = Са(ОН)2 + Н2
2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2
Ссылки по теме:
Металлы — определение
Физические свойства металлов
Нахождение металлов в природе
Способы получения
allmetalls.ru
Алюминий восстановительная способность — Справочник химика 21
В производстве металлов алюминий занимает второе место после железа. Одно из важнейших применений алюминия в металлургии — получение с его помощью металлов из оксидов. В этом случае используется сильная восстановительная способность алюминия (см. алюминотермия, с. 167). Алюминотермия открыта русским химиком Н. Н. Бекетовым. При алюминотермии реакция протекает очень быстро, выделяется большое количество теплоты, а температура смеси достигает 3500 С. В этих условиях восстановленный металл получается в жидком состоянии, а на поверхность всплывает оксид алюминия в виде шлака. [c.186]В этой главе рассматриваются элементы трех групп периодической системы IПА-группы бора, IVA-группы углерода и группы VA — сурьма и висмут. Атомы их характеризуются застройкой электронами р-подуровня наружного уровня. У этих элементов, за исключением алюминия, восстановительная способность выражена сравнительно слабо. В свободном состоянии они характеризуются свойствами, отличающимися от свойств типичных металлов. Некоторые из соответствующих элементарных веществ (кремний, германий) являются полупроводниками, иные (бор, алмаз) отличаются большой твердостью. Значение в современной технике как элементарных веществ, так и некоторых соединений этих элементов очень велико. [c.170]
Металлический алюминий обладает очень сильной восстановительной способностью. Теплота образования AI2O3 из простых веществ А/ 298 = —400,0 ккал/моль (— 1670 кДж/моль). Впервые восстановительные свойства алюминия были показаны Н. Н. Бекетовым в 1859 г. Ныне алюминотермия используется для получения таких металлов, как Сг, Мп, V, из их оксидов. Порошкообразный алюминий в смеси с порошкообразными оксидами некоторых металлов при высокой темпе-. р ату ре способен энергично восстанавливать их с выделением большого количества теплоты. Такие смеси называются термитами. Реакция начинается после разжигания смеси с помощью специальных запальных составов. Так, смесь из оксидов железа и порошкообразного алюминия при разжигании реагирует по уравнению [c.78]
Из рассматриваемых оксидов наиболее отрицательное значение АС имеет АиОз. Следовательно, алюминий может выступать в качестве восстановителя любого из этих оксидов. Восстановительная способность водорода более ограничена. Он может быть применен для восстановления СпаО и HgO. [c.267]
Используя восстановительную способность алюминия, сплавляют ржавые стружки, рыхлую окалину с целью последующего использования этих отходов в мартеновских печах. [c.78]
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой [c.307]
Алюминотермия. Одно из важнейших применений алюминия в металлургии — получение с его помощью металлов из окислов. В этом случае используется сильная восстановительная способность алюминия. Он отнимает кислород у многих окислов металлов. [c.307]
Торий также образует галогениды низшей валентности. В 1949 г. были опубликованы сообщения о получении хлорида трехвалентного тория [619]. Он был получен синтезом элементов и восстановлением хлорида тория алюминием при 430° С. Хлорид тория (III) разлагает воду с выделением водорода, что свидетельствует о его сильной восстановительной способности. При нагревании свыше 630° С трихлорид диспропорционирует по реакции [c.269]
Восстановительная способность простых веществ по отношению к окислам определяется их химическим сродством к кислороду. Реакции восстановления окислов протекают в том случае, когда теплота образования окисла восстановителя больше по сравнению с теплотой образования восстанавливаемого окисла. Наиболее сильными восстановительными свойствами обладают кальций, магний и алюминий, но магний и кальций находят ограниченное применение, так как при их использовании нельзя получить металлы в виде жидкого слоя (из-за высокой температуры плавления окислов этих металлов). Алюминий, несмотря на более слабые восстановительные свойства, используется для металлотермии, так как окись алюминия плавится при более низкой температуре (2050° С) и образует верхний слой над слоем расплавленного металла. [c.150]
С повышением температуры восстановительная способность металлов возрастает. Например, алюминий при высокой температуре восстанавливает железо из его окислов по уравнению [c.246]
Так, восстановительная способность комплексов гидрида лития с гидридами элементов главной подгруппы III группы периодической системы возрастает при переходе от бора к алюминию и уменьшается при переходе от алюминия к таллию. [c.134]
Одно из важнейших применений алюминия в металлургии — получение с его помощью металлов из оксидов. В этом случае используется сильная восстановительная способность алюминия. Он отнимает кислород у многих оксидов металлов. Способ восстановления металлов из их оксидов с помощью металлического алюминия называется алюминотермией. Алюминотермия открыта русским химиком Н. Н. Бекетовым. [c.284]
С другой стороны, алюминий в алкоголяте А1(0К)з обладает только секстетом электронов и поэтому способен принимать еще два электрона с образованием устойчивой октетной оболочки. Это придает алкоголятам алюминия свойства кислот Льюиса большой заряд центрального атома делает их жесткими . Таким образом, алкоголяты алюминия приобретают способность присоединять слабоосновный атом кислорода карбонильных соединений с образованием комплексов, подобных изображенным выше. Окис-лительно-восстановительный процесс аналогичен альдольному присоединению с той лишь разницей, что в реакции Меервейна — Понндорфа — Верлея перемещающиеся к карбонильному углероду (т. е. восстанавливающие) электроны связаны не с атомом углерода, а с водородом (гидрид-анион) [c.363]
Флюсы для припоев. Кислая природа солей гидразина, с одной стороны, и сильная восстановительная способность гидразина, с другой, свидетельствуют о возможности использования этих солей в качестве флюсов для припоев [7]. Двойные соли галогенидов гидразина с хлоридами цинка и двухвалентного олова могут, повидимому, являться весьма эффективными флюсами для сплавов алюминия и магния. [c.220]
Из этих примеров окислительно-восстановительных реакций видно, что медь по своей химической активности, т. е. по восстановительной способности, уступает алюминию, но в то же время превосходит ртуть. [c.167]
Показать заполнение энергетических ячеек в атоме алюминия. Пользуясь составленной схемой, объяснить, почему алюмини
www.chem21.info
Ряд активности металлов — Знаешь как
Что такое ряд активности металлов и окислительно-восстановительные реакции
 Отправным пунктом при изучении ряда активности металлов следует взять периодическую систему элементов.
Отправным пунктом при изучении ряда активности металлов следует взять периодическую систему элементов.
Устанавливается, что активность металла определяется степенью лёгкости отдачи атомом электронов: чем легче атомы металла отдают электроны, тем металл является активнее.
Рис. Трубка для опытов по вытеснению металлов водородом под давлением
О сравнительной активности металлов можно судить по их положению в периодической системе: внутри периодов при передвижении справа налево нарастает активность металлов, и самые активные металлы (литий, натрий, калий, рубидий, цезий и франций) стоят в начале периодов. В главных подгруппах при передвижении сверху вниз тоже нарастает активность металлов, в чём можно убедиться на примере тех же щелочных металлов.
Ряд бекетова
Но если металлы стоят в разных периодах и в разных группах, как, например, цинк и свинец, то на основе положения их в периодической системе быстро и правильно охарактеризовать их сравнительную активность довольно трудно. Это можно выполнить на основе ряда активности металлов, установленного русским учёным Н. Н. Бекетовым и впервые названного им «вытеснительным рядом металлов». Наиболее выдающимся трудом Н. Н. Бекетова являются его «Исследования над явлениями вытеснения одних элементов другими» (Харьков, 1865).
Для наиболее важных металлов ряд активности металлов имеет следующий вид:

1. В этом ряду металлы расположены в определённой системе, а именно в порядке убывающей активности. Из двух металлов, стоящих рядом, легче отдают электроны атомы металла, стоящего левее.
2. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей, иначе говоря, каждый металл окисляется ионами всех следующих за ним металлов, например:
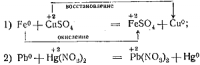
При этом, как видно из уравнений, металл переходит в состояние иона, а ион — в состояние металла.
3. Если в ряду двигаться слева направо, т. е. от калия к золоту, то способность атомов отдавать электроны будет убывать, т. е. будет убывать восстановительная способность атомов и нарастать окислительная способность ионов металлов. Таким образом, в приведённом ряду активности металлов атомы калия и натрия являются очень сильными восстановителями, а ионы серебра и золота — сильными окислителями.
4. Как следствие из изложенного вытекает, что водород из разбавленных кислот может вытеснять только металлы, которые в ряду стоят левее его. Металлы же, стоящие вправо от водорода, наоборот, вытесняются водородом, находящимся под давлением, из растворов их солей умеренных концентраций:
2Аl + 6НСl = 2АlСl3 + 3Н2;
H2+2AgNO3 = 2Ag + 2HNO3.
Для определения места водорода в ряду активности металлов Н. Н. Бекетов производил такие опыты:
В колена изогнутой стеклянной трубки (рис.) помещались раздельно соли металла, кислота и цинк. Трубка запаивалась, потом наклонялась так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли. По явлениям, происходящим в колене трубки с раствором соли, можно было судить о том, вытесняется ли металл водородом или нет.
На основании подобных опытов Н. Н. Бекетов пришёл к выводу, что в «вытеснительном ряду» водород должен занимать место после свинца, а за водородом идут медь, ртуть, серебро, золото и платиновые металлы.
5. Из двух металлов, образующих электроды гальванического элемента, отрицательным электродом, катодом, будет тот из них, который стоит левее в ряду, а положительным электродом, анодом, — тот, который стоит правее.
Окислительно-восстановительная реакция в гальваническом элементе протекает тем энергичнее, чем эти металлы дальше отстоят друг от друга в ряду активности металлов. Следует в заключение подчеркнуть, что ряд активности металлов нельзя рассматривать как абсолютную характеристику свойств металлов, действительную во всех случаях и при всяких условиях.
1) Так, например, в растворах цианистого калия он существенно отличается от обычного ряда, что видно из приводимого ниже сопоставления (при 10°):
а) Обычный ряд: Zn, Fe, Sn, Сu, Ag. Аu;
б) 0,6% раствор KCN: Zn, Сu, Sn, Ag, Аu, Fe;
в) 30% раствор KCN: Zn, Сu, Аu, Ag, Sn, Fe.
При изменившихся условиях активность, например, железа резко снижается, активность меди заметно повышается и т. д.
2) Хотя серебро в ряду активности стоит после водорода, но при нагревании металлического серебра в атмосфере хлористого водорода протекает обратимая реакция:
2Ag + 2HCl ⇄ 2AgCl + H2,
причём вытеснение водорода серебром сопровождается выделением тепла. Если эту реакцию проводить в замкнутом сосуде под атмосферным давлением, то при 600° газовая смесь содержит по объёму 92,8 % НСl и 7,2 Н2, а при 700° соответственно 95% и 5%. Подобным же образом протекает реакция при тех же условиях и с медью.
Несмотря на свой относительный характер и имеющиеся некоторые исключения, ряд активности металлов всё же очень важен в практическом отношении, так как в большинстве случаев он позволяет правильно ориентироваться в направлении окислительно-восстановительной реакции при взаимодействии металла с водным раствором того или иного электролита.
Статья на тему Ряд активности металлов
znaesh-kak.com
Ряд активности металлов, когда им пользоваться » HimEge.ru
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо.
- Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Катодный процесс
himege.ru

 озрастает
озрастает