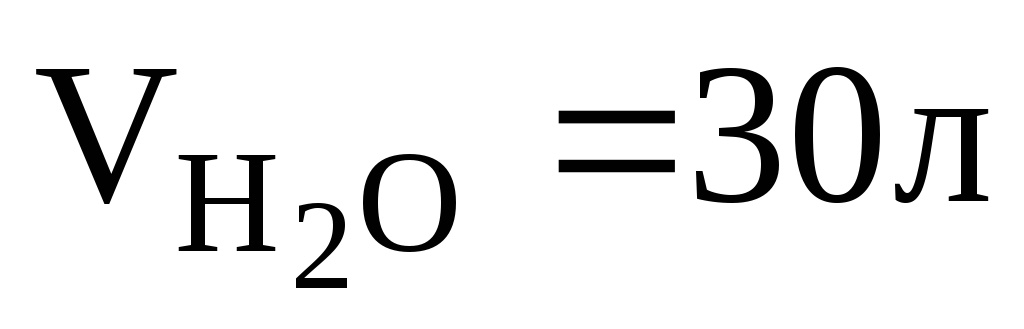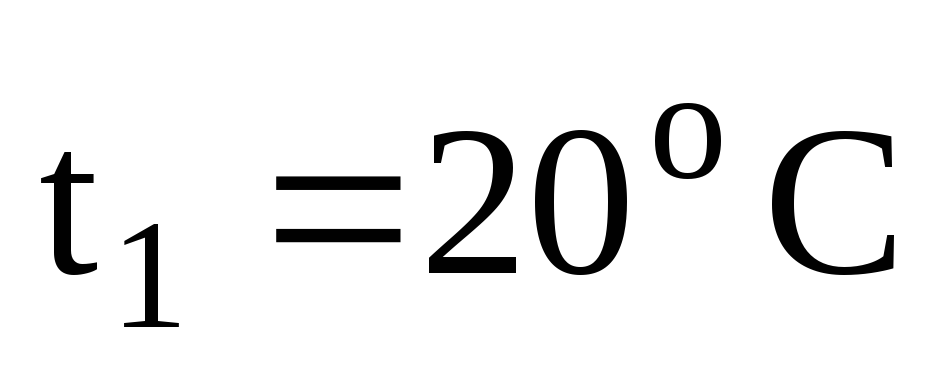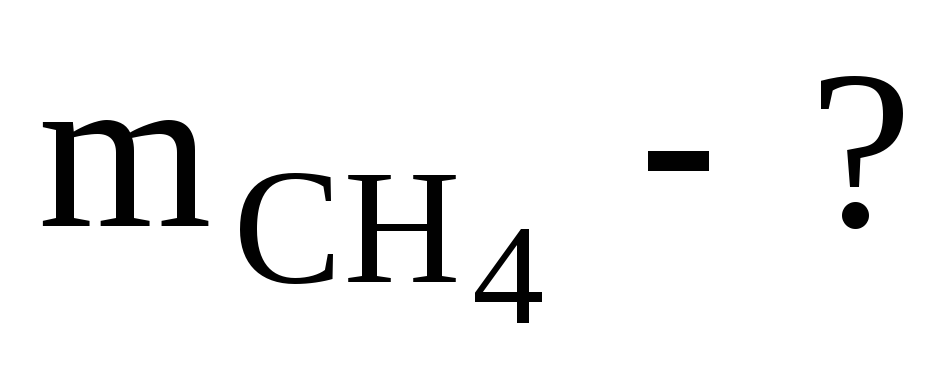CH4 C2H2 C2H4 C2H6 C6H6 C7H8 CH3OH C2H5OH C2H4(OH)2 C3H8(OH)3 C4H8O2 C4H10O CH3COOH | Метан Ацетилен Этилен Этан Бензол Толуол Метиловый спирт Этиловый спирт Этиленгликоль Глицерин Этилацетат Диэтиловый эфир Уксусная к-та | -890,31 -1299,63 -1410,97 -1559,88 -3910,28 -726,64 -1366,91 -1192,86 -1664,40 -2254,21 -2730,90 -873,79 | C7H6O2 C6H12O6 C12H22O11 C3H9N ССl4 С6H5O2N С6H7N (ж) С5Н10 H2S C С S Н2 | Бензойная к-та Глюкоза Сахароза Триметиламин Тетрахлорметан Нитробензол Анилин Циклопентан Сероводород Графит Алмаз Сера Водород | -3227,54 -2815,8 -5648,0 -2442,92 -260,65 -3057,01 -3396,2 -3319,54 -517 -393,51 -395,7 -296,9 -285,83 |
Решение:
Модуль №1 Основы химической термодинамики и кинетики, свойства растворов, редокс-процессы
ЗАНЯТИЕ № 1
Методическое указание для студентов
ТЕМА: Основы химической термодинамики и биоэнергетики. Химическое равновесие.
ЦЕЛЬ: Познакомиться с основами термодинамики и биоэнергетики, научиться прогнозировать направление химических и биологических процессов
Теоретические вопросы:
1. Предмет и методы химической термодинамики. Основные понятия термодинамики.
2. Параметры состояния (интенсивные и экстенсивные) Функция состояния.
3. Внутренняя энергия. Работа и теплота – две формы передачи энергии.
4. Типы термодинамических систем (изолированные, закрытые, открытые).
5. Типы термодинамических процессов (изотермические, изобарные, изохорные). Стандартное состояние.
6. Энтальпия. Стандартная энтальпия образования и сгорания вещества. Стандартная энтальпия реакции. I начало термодинамики.
7. Закон Гесса. Следствия из закона Гесса. Применение 1 начала термодинамики к биосистемам. Энергетическая ценность пищевых продуктов, обоснование рационов питания.
8. Обратимые и необратимые в термодинамическом смысле процессы. Второе начало термодинамики. Энтропия.
9. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Роль энтальпийного и энтропийного факторов.
10. Термодинамические условия равновесия. Стандартная энергия Гиббса образования и биологического окисления веществ. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов. Принцип энергетического сопряжения.
11. Обратимые и необратимые реакции. Термодинамические условия равновесия в изолированных и закрытых системах.
12. Закон действующих масс. Константа химического равновесия.
13. Уравнение изотермы и изобары химической реакции.
15. Понятие о гомеостазе и стационарном состоянии живого организма.
Лабораторная работа №1 «Химическое равновесие»
Обучающие задачи:
Задача 1 В организме человека реакция окисления этилового спирта протекает в две стадии. Первая — окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2H5OH + ½ O2 = CH3COH + H2O.
Рассчитайте DH0 реакции, используя первое следствие закона Гесса, если
DН0 обр.(C2H5OH) = — 278 кДж/моль;
DН0обр.(CH3СOH) = — 166 кДж/моль;
DН0
обр.(H2O) = — 286 кДж/моль.Решение: DH0 = å n DH0обр.пр.р. — å n DН0обр.исх.в.в; DH = (-166+ (-286)-(-278)) = — 174 кДж/моль
Ответ: тепловой эффект реакции DH = -174 кДж/моль, т.е. процесс экзотермический.
Задача 2. Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С6Н12О6= 2С2Н5ОН + 2СО2
Решение: Тепловой эффект данной реакции можно рассчитать, применяя второе следствие из закона Гесса:
DН = ån DН0 сгор. исход. веществ — å n DH0сгор. прод. реакции
DН = -2810 — 2 ∙(-1366) = — 78 кДж/моль
Ответ: тепловой эффект процесса брожения равен — 78 кДж/моль.
Задача 3. Рассчитайте стандартную энтропию реакции:
NH2 — CH2 — COOH + NH2 — CH2 — COOH → NH2 — CH2 — CO — NH — CH2 — COOH + H2O
глицин глицин глицилглицин
Если S0(глицилглицина) = 231 Дж/моль×К;
S0(глицина) = 159 Дж/ моль×К;
S0( H2O) = 70 Дж/моль×К;
DS = S0298(гл-гл) +S0298(H2O)– 2 S0 298 (глицина) = (231+70)-(159+159)= -17 Дж/моль×К
Ответ: DS0298
= — 17 Дж/моль×К, т.е. энтропия уменьшится.Задача 4. Теплота сгорания углеводов, белков и жиров составляет 17, 17 и 39 кДж
соответственно. Среднесуточная потребность в белках, жирах и углеводах для студентов — мужчин составляет 113, 106 и 451г. Какова суточная потребность студентов — мужчин в энергии?
Решение: Рассчитаем, какое количество энергии выделится при окислении углеводов, белков и жиров
DH = (451×17) + (113 × 17) + (106 × 39) = 13722 кДж.
Ответ: Суточная потребность в энергии равна 13722 кДж.
Задача 5. Почему процесс денатурации белка при 400С является самопроизвольным, если реакция эндотермическая и тепловой эффект составляет 2830 Дж/моль? Значение DS для данной реакции равно 288 Дж/моль∙К
Решение: Для определения
направления процесса необходимо знать
величину изменения энергии Гиббса,
рассчитываемой по уравнению: DG
Ответ: Поскольку DG < 0, то процесс денатурации белка при 400С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Задача 6. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях:С6H12О6 (р-р)® 2 С3H6О3(р-р) (молочная кислота).
Решение:
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G0(С6H12О6) = -917 кДж/моль; ∆G0(С3H6О3) = -539 кДж/моль. Используя 1 следствие из закона Гесса, вычислим энергию Гиббса:
ΔG0 = 2×ΔG0 (C3H6O3) — ΔG0 (C6H12O6)
ΔG0 = 2(-539) – (-917) = -161 кДж/моль
Ответ: т.к. ΔG0 < 0, то реакция протекает самопроизвольно в прямом направлении.
Задача 7. Вычислить изменение энергии Гиббса при 250С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО+ 2Н2 = СН3ОН
DН0обрСН3ОН = -293 кДж/моль S0(СН3ОН) = 127 Дж/моль×К
DН0обрСО = — 110 кДж/моль. S0(CO) = 198 Дж/моль×К
S
Решение: DG0 = DH0 — TDS0
DH0 = ånDH0обр. пр. реак. — ånDН0обр. исх. веществ
DН0 = — 293 — (-110) = — 183 кДж/моль
DS0 = å n S0прод. р — å n S0исход. веществ
DS0 = 127 — (198 + 2(131) = — 333 Дж/моль×К
DG0 = — 183,5 кДж/моль — (298К × 0,333 кДж/моль×К) = — 83,8 кДж/моль
Ответ: DG0 = — 83,8 кДж/моль
Задача 8. Рассчитайте константу равновесия при 310 К для реакции АТФ + АМФ ↔ 2АДФ, если свободная энергия Гиббса реакции ΔG°=-2,10кДж/моль.
Решение: в состоянии равновесия DG0 = — 2,3RT lg Кс
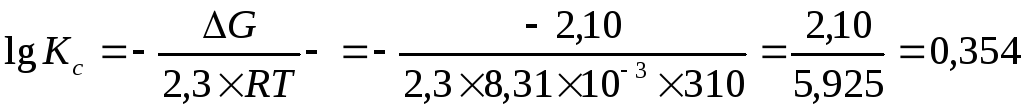
lgKc= 0,354
Kc= 100,354=2,26
Ответ: Kc = 2,26
Задача 9. Константа равновесия реакции: PCl5(г) « PCl3(г) + Cl2(г) при 2500С равна 2. В каком направлении идет реакция при следующих концентрациях: С(PCl5) = C(PCl3) = 2 моль/л; С(Сl2) = 4 моль/л ?
Решение: Для определения направления протекания
реакции воспользуемся уравнением
изотермы 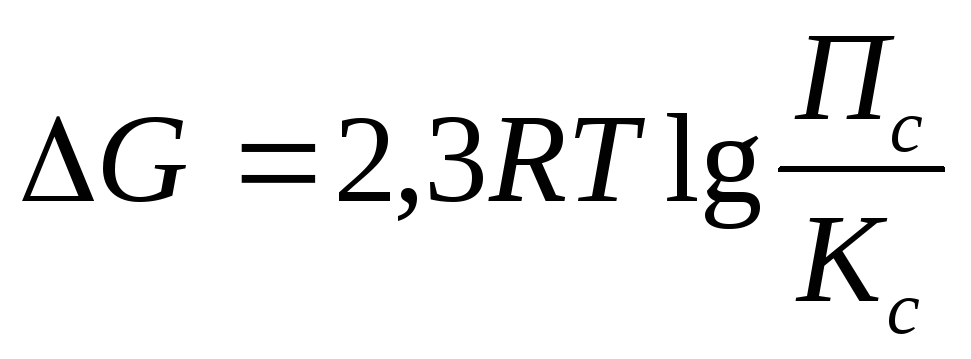
Рассчитаем Пс
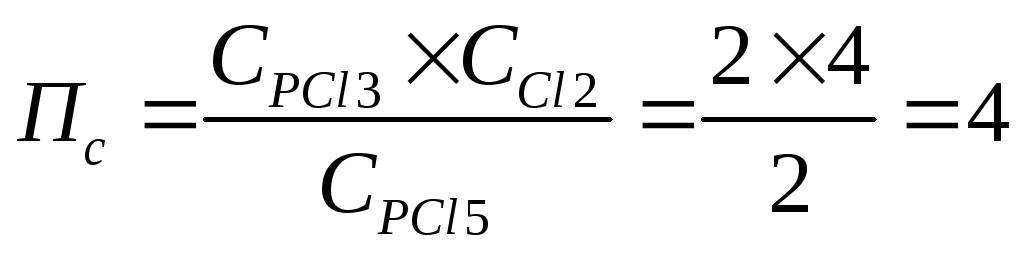

Т.к. Пс > Кс, то DG > 0
Вывод: реакция самопроизвольно протекать в прямом направлении не может, т.к. DG>0.
Задача 10. Константа равновесия реакции 2SO2 (г) + O2(г) Û 2SO3(г) при температуре 6270С равна 2,3∙10-7, DН0 = 376,5 кДж/моль. Рассчитайте константу равновесия при 7270С.
Решение: воспользуемся уравнением изобары химической реакции:
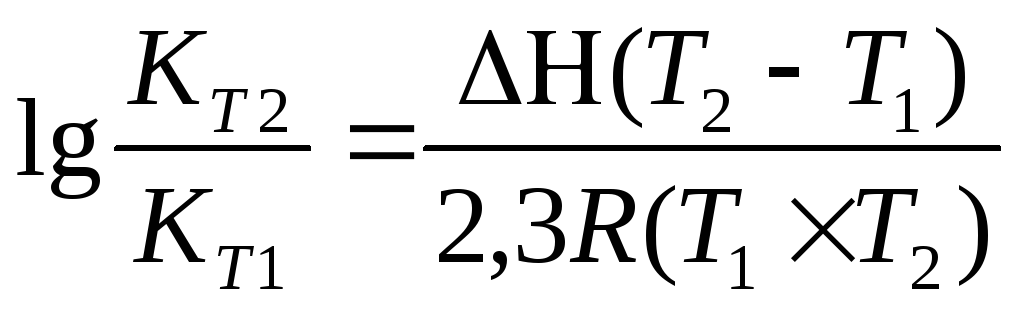 T1 = 273 + 627 = 900 K
T1 = 273 + 627 = 900 K
T2 = 273 + 727 = 1000K
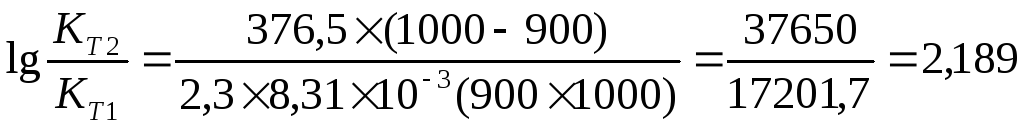
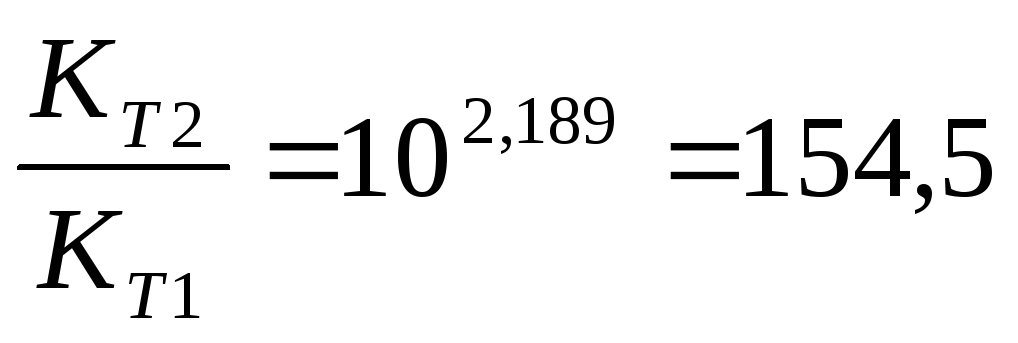

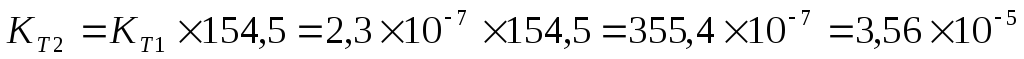
Ответ: Константа равновесия при 7270С равна 3,56 × 10-5 .
Задача 11. Для реакции Н2О(г) + СO(г) ® CO2(г) + H2(г) константы химического равновесия равны: при 8000С Кр = 2,87, при 10000С Кр = 1,39. Вычислите тепловой эффект этой реакции.
Решение: Применив, уравнение изобары химической реакции, рассчитаем DН
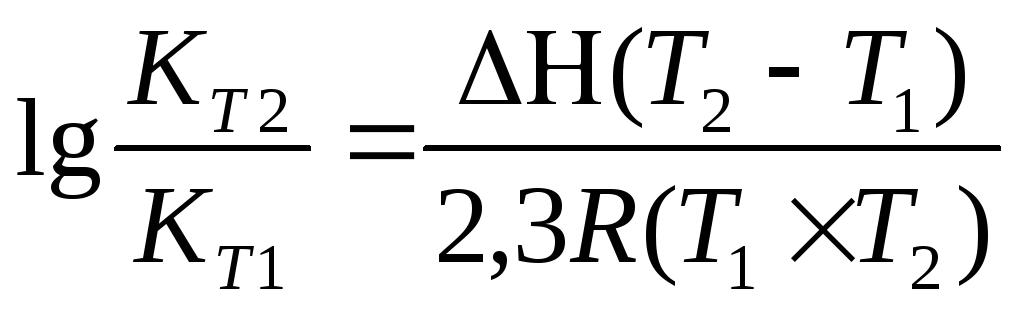
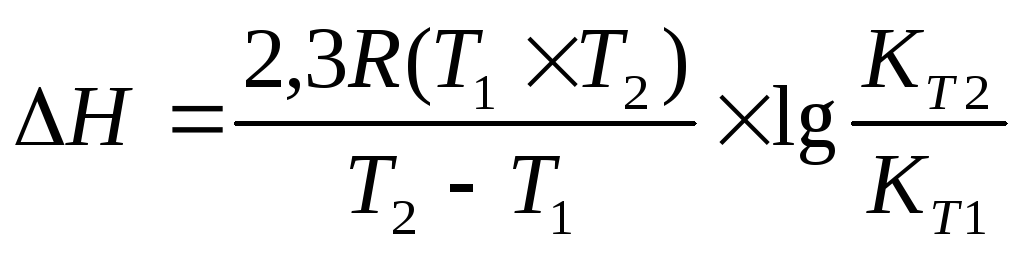
Примем T1 = 800 + 273 = 1073 K
T2 = 1000 + 273 = 1273 K
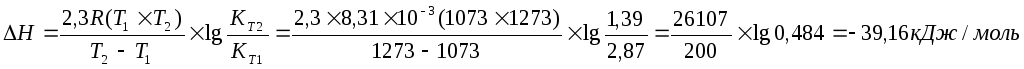
Ответ: DН = -39,16 кДж/моль
2. Стандартная энтальпия реакции сгорания метанола (сн3он) равна (-726,64) кДж/моль. Написать термохимическое уравнение сгорания метанола и вычислить стандартную энтальпию его образования.
Дано: |
|
Стандартной энтальпией сгорания вещества 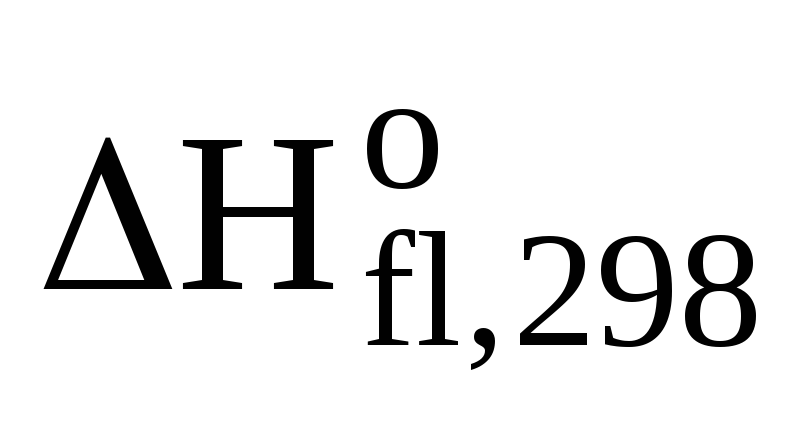 (В)
называется тепловой эффект реакции
полного сгорания 1 моль органического
вещества до СО2(г)и Н2О(ж)при стандартных условиях.
(В)
называется тепловой эффект реакции
полного сгорания 1 моль органического
вещества до СО2(г)и Н2О(ж)при стандартных условиях.
Составляем термохимическое уравнение сгорания 1 моль метанола:
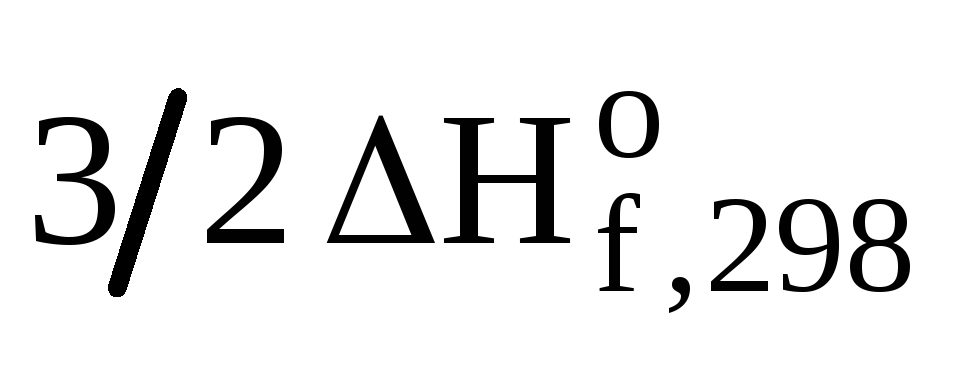
1CH3ОН(ж)+3/2О2(г)=СО2(г)+2Н2О(ж) 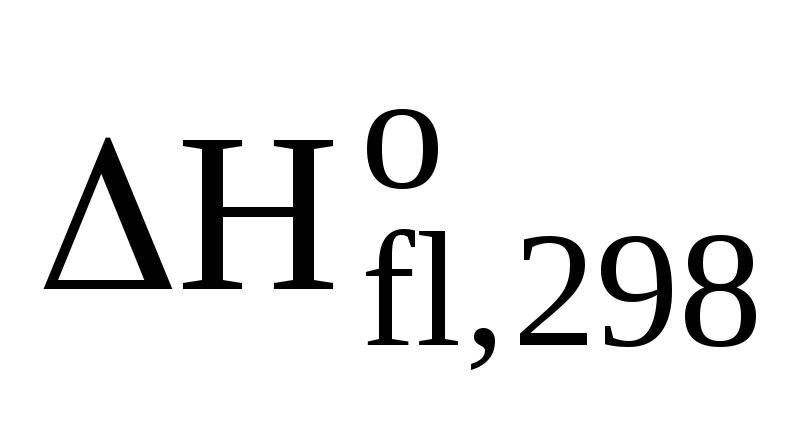 = -726,64 кДж/моль
= -726,64 кДж/моль
Следовательно,
для данной реакции 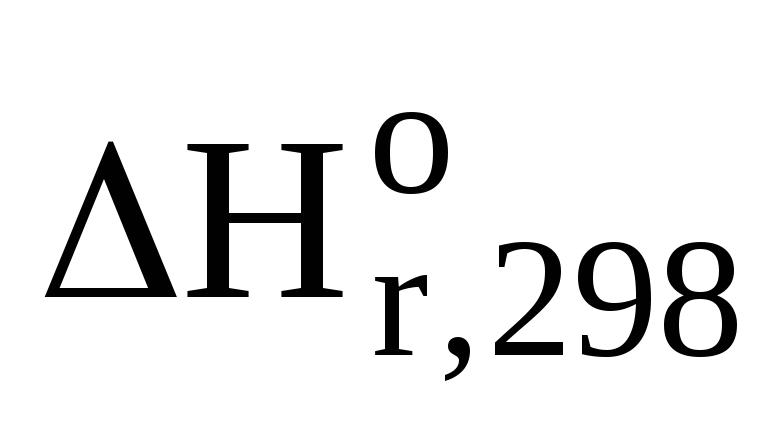 = -726,64 кДж
= -726,64 кДж
Для
определения 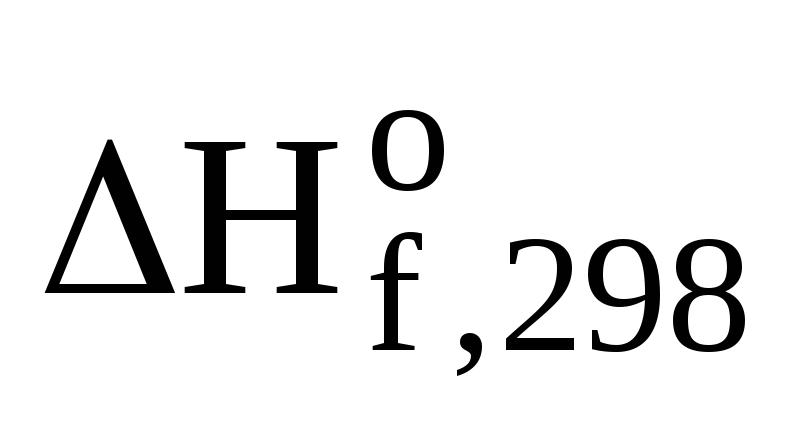 (CH3ОН(ж))
используем первое следствие из закона
Гесса для этой же реакции:
(CH3ОН(ж))
используем первое следствие из закона
Гесса для этой же реакции:
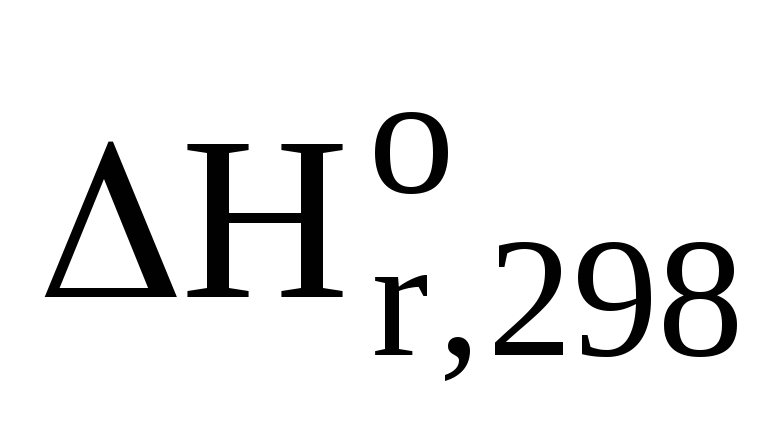 =
=  (СО2(г))
+
(СО2(г))
+ 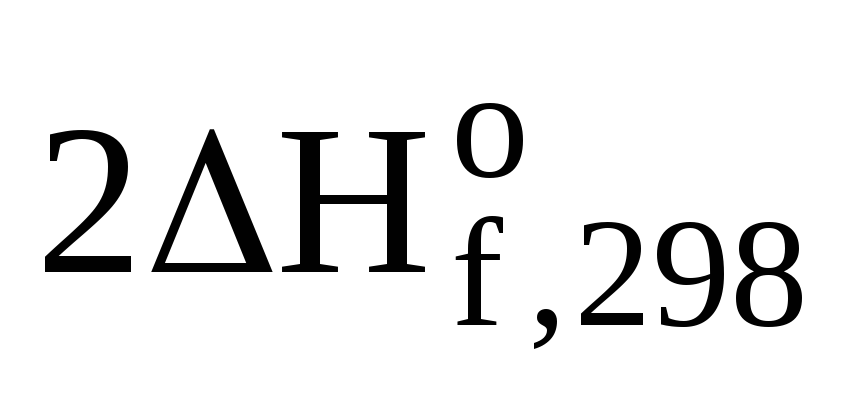 (Н2О(ж))
—
(Н2О(ж))
—
— 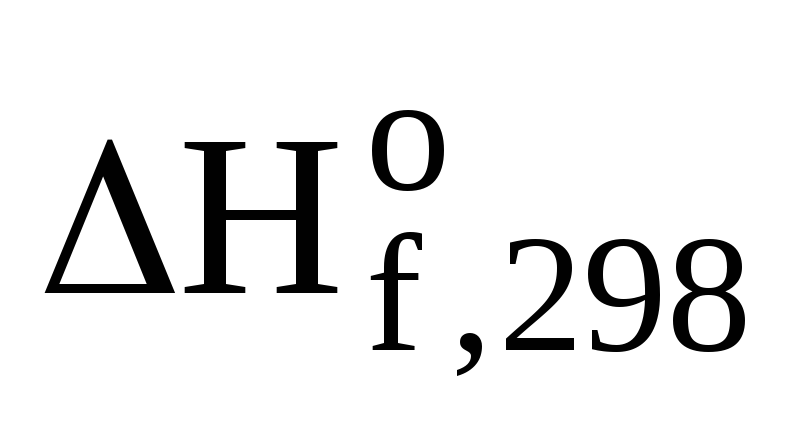 (CH3ОН(ж))
—
(CH3ОН(ж))
— 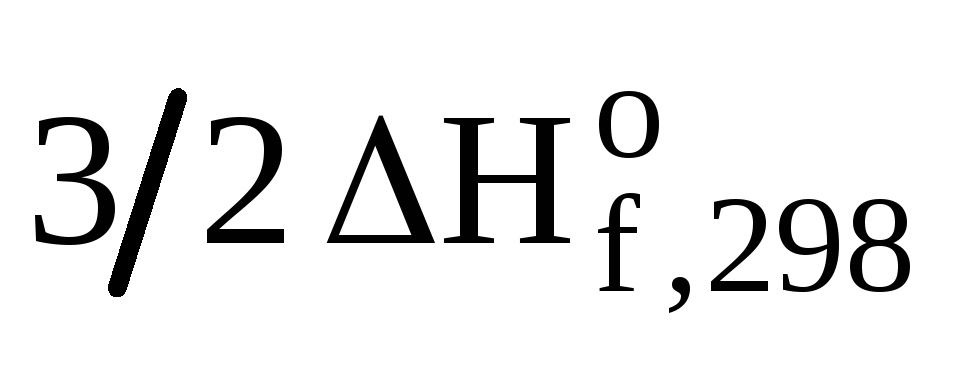 (О2(г)).
(О2(г)).
Откуда: 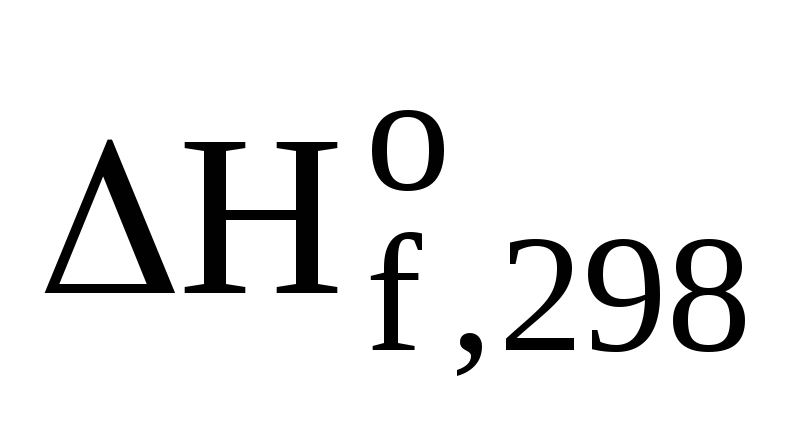 (CH3ОН(ж))
=
(CH3ОН(ж))
= 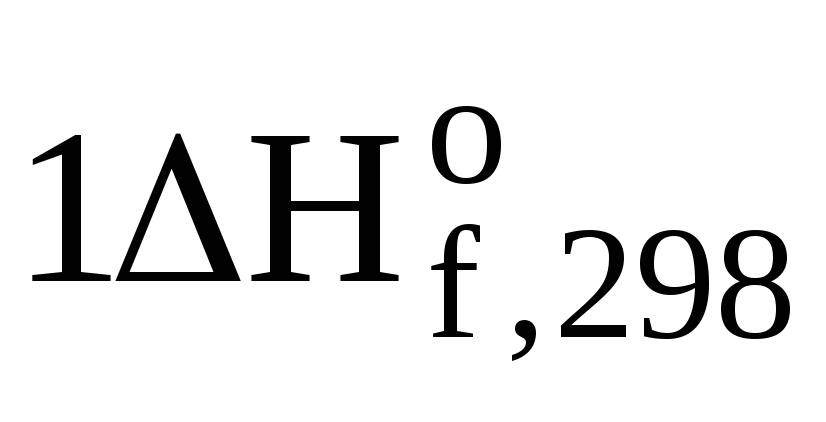 (СО2(г))+
(СО2(г))+
+ 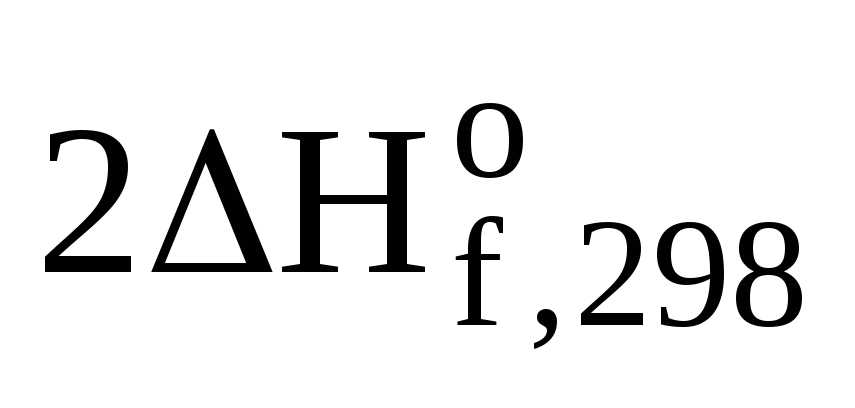 (Н2О(ж))
—
(Н2О(ж))
—  –
–  (О2(г))
(О2(г))
Значения
стандартных энтальпий образования 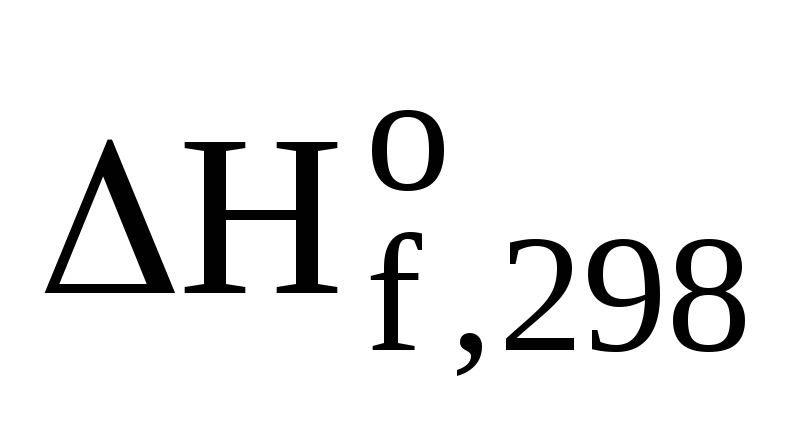 (В)
веществ берем из таблицы стандартных
термодинамических величин.
(В)
веществ берем из таблицы стандартных
термодинамических величин.
 (CH3ОН(ж))
= 1(-393,5) +2(-285,8)-(- 726,64) =
(CH3ОН(ж))
= 1(-393,5) +2(-285,8)-(- 726,64) =
= -238,46 кДж/моль.
Ответ: 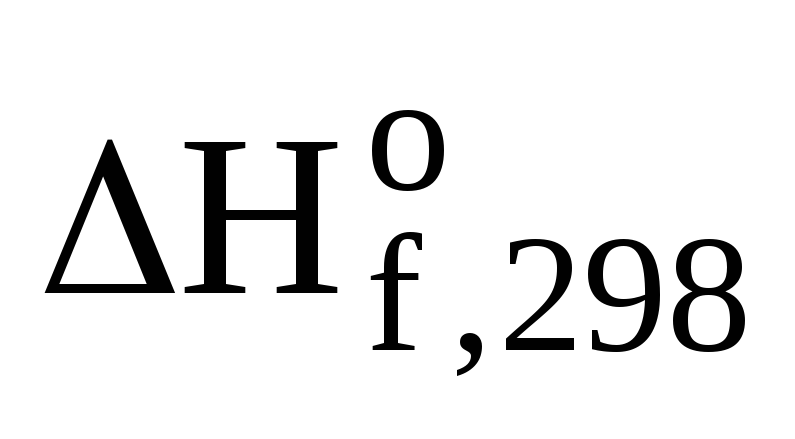 (CH3ОН(ж))
= -238,46 кДж/моль.
(CH3ОН(ж))
= -238,46 кДж/моль.
3. Можно ли при стандартных условиях восстановить водородом оксид хрома (III), алюминием оксид марганца (II), оксидом углерода (II) оксид ртути (II). Ответ подтвердить расчетом по значениям (в).
Дано: Cr2O3 + H2 MnO + Al HgO + CO |
|
Возможность самопроизвольного про-
текания реакции при заданных усло-
виях определяется знаком величины
энергии Гиббса для соответствующей
реакции
– если 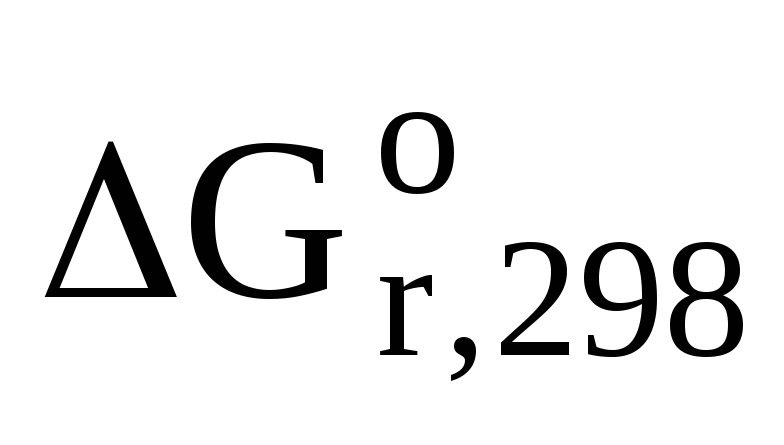 < 0, то самопроизвольное протекание
реакции возможно, если же
< 0, то самопроизвольное протекание
реакции возможно, если же
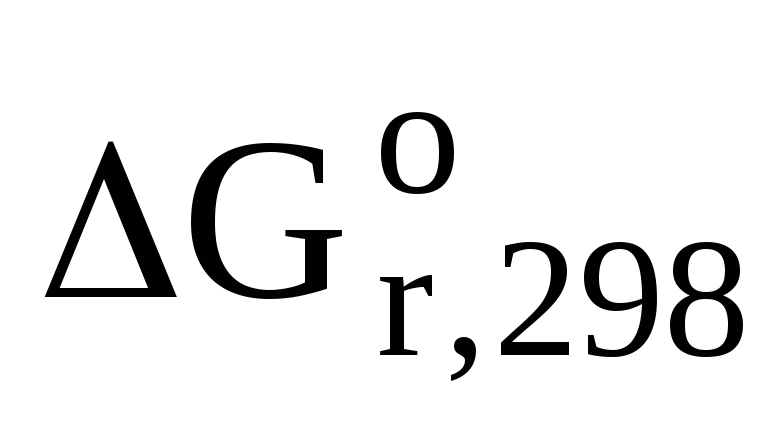 >
0, то протекание данной реакции невозможно.
>
0, то протекание данной реакции невозможно.
Значения 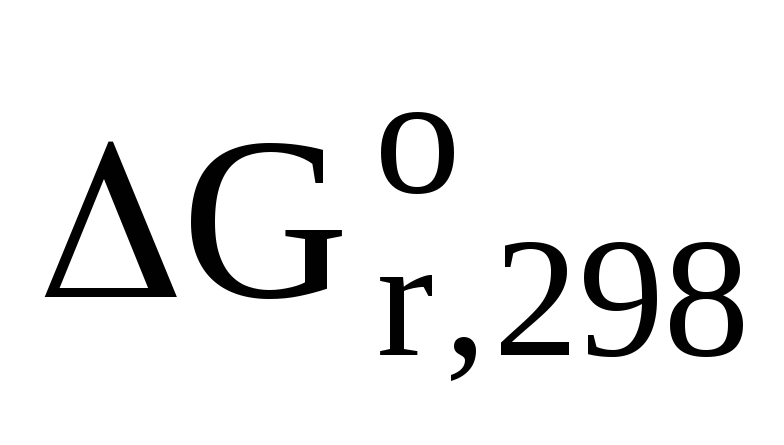 определяем по I
следствию из закона Гесса
определяем по I
следствию из закона Гесса
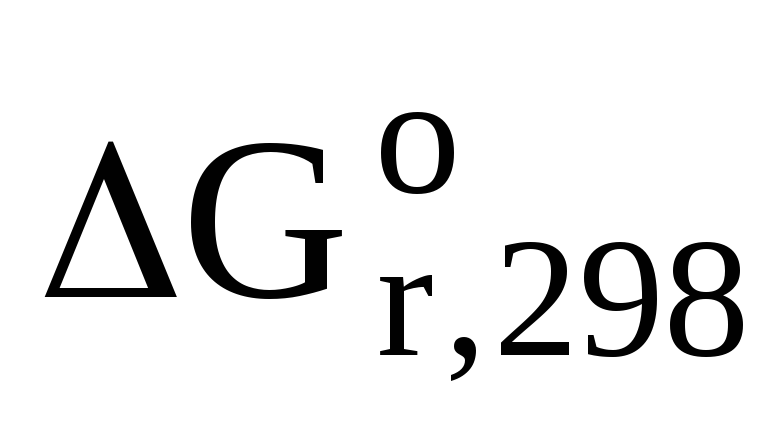 =
Σni
=
Σni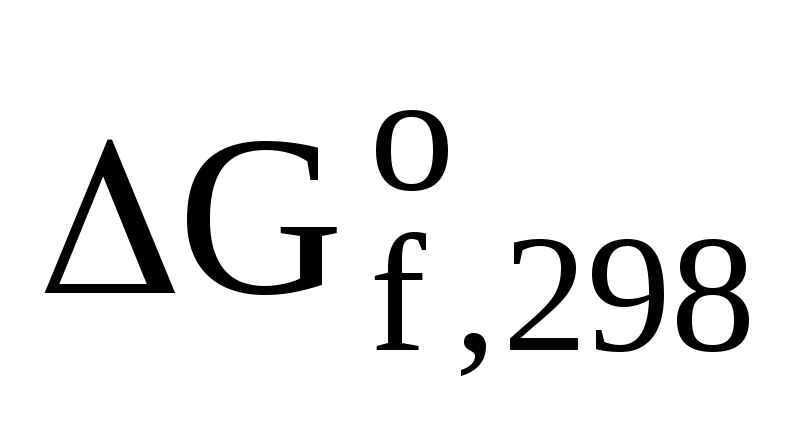 (В)
— Σ nj
(В)
— Σ nj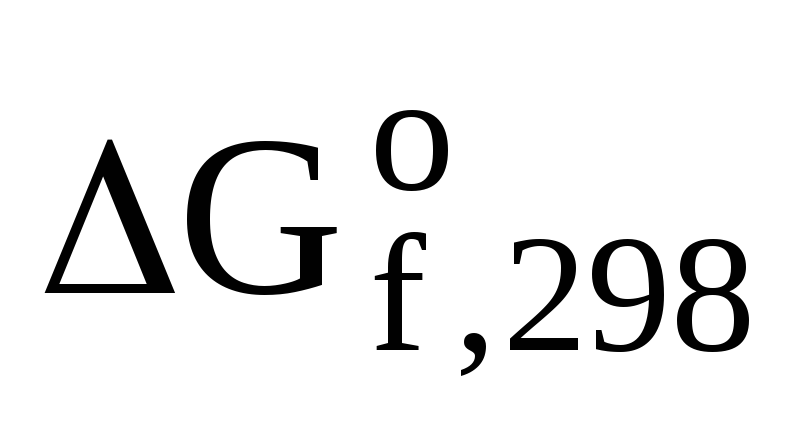
продуктов исходных
реакции веществ
Значения 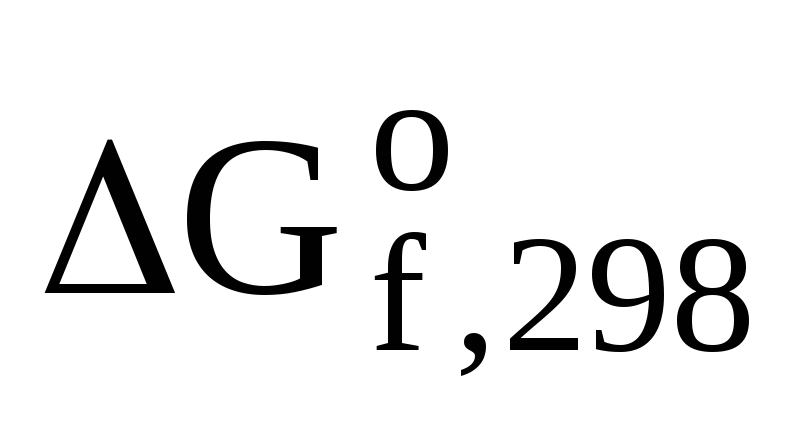 (В) находим из таблицы.
(В) находим из таблицы.
Записываем уравнения протекающих реакций
Cr2O3(к) + 3Н2(г) = 2Cr(к) + 3Н2О(ж) (4.1)
 -1059
0 0 3(-237,3)
-1059
0 0 3(-237,3)
кДж/моль
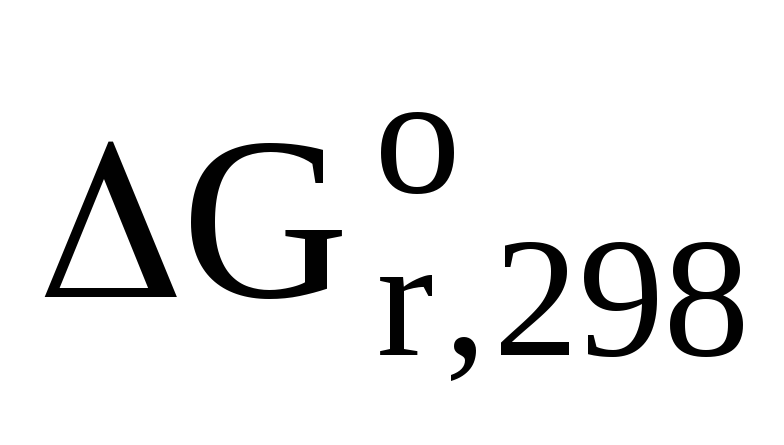 =
3(-237,3) – (-1059) = 374,1 кДж
=
3(-237,3) – (-1059) = 374,1 кДж
Поскольку 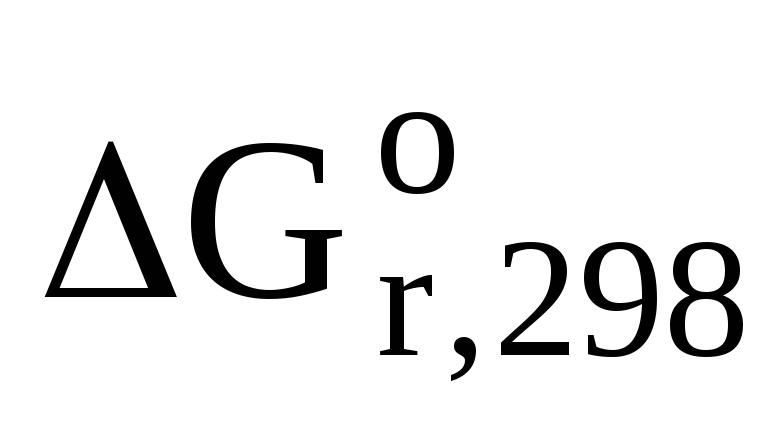 величина положительная, то протекание
реакции (4.1) невозможно.
величина положительная, то протекание
реакции (4.1) невозможно.
3MnO(к) + 2Al(к) = Al2O3(к) + 3Mn(к) (4.2)
 3(-362,85)
0 -1582 0
3(-362,85)
0 -1582 0
кДж/моль
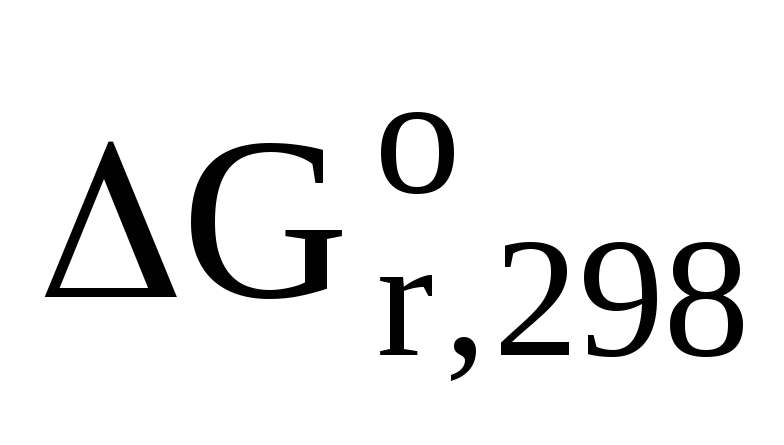 =
(-1582) – 3(-362,85) = — 493,45 кДж
=
(-1582) – 3(-362,85) = — 493,45 кДж
Поскольку 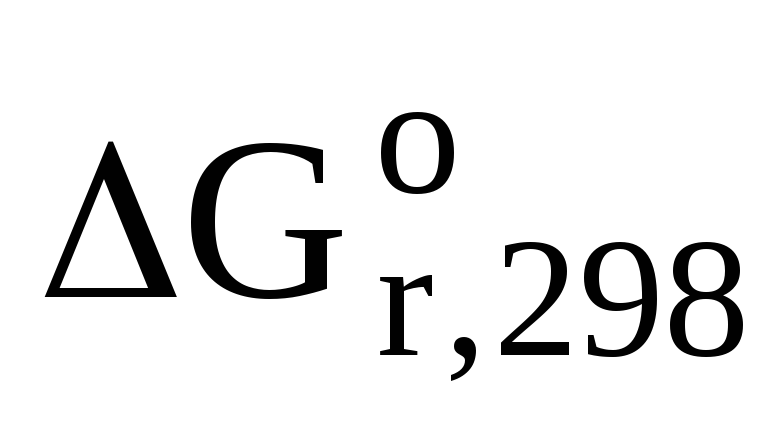 величина отрицательная, то протекание
реакции (4.2) возможно.
величина отрицательная, то протекание
реакции (4.2) возможно.
HgO(к) + CO(г) = СО2(г) + Hg(ж) (4.3)
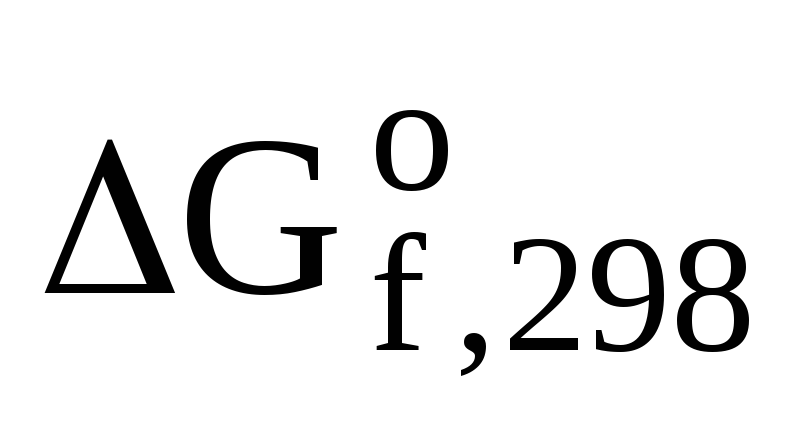 -58,4
— 137,1 -394,4 0
-58,4
— 137,1 -394,4 0
кДж/моль
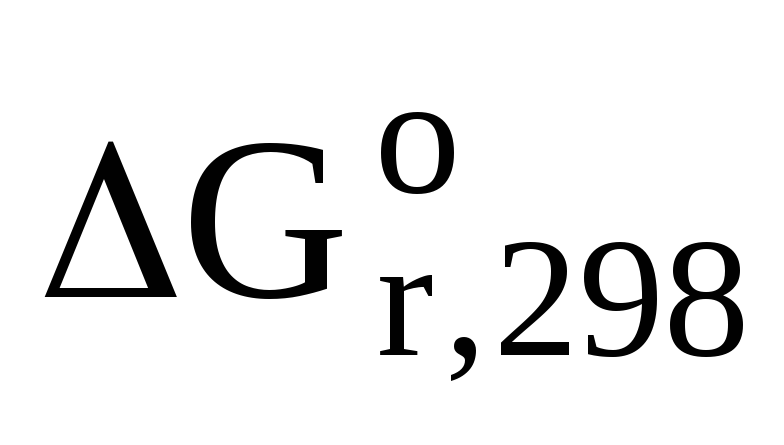 =
(-394,4) – [(-58,4) + (-137,1)] = — 194,9 кДж
=
(-394,4) – [(-58,4) + (-137,1)] = — 194,9 кДж
Поскольку 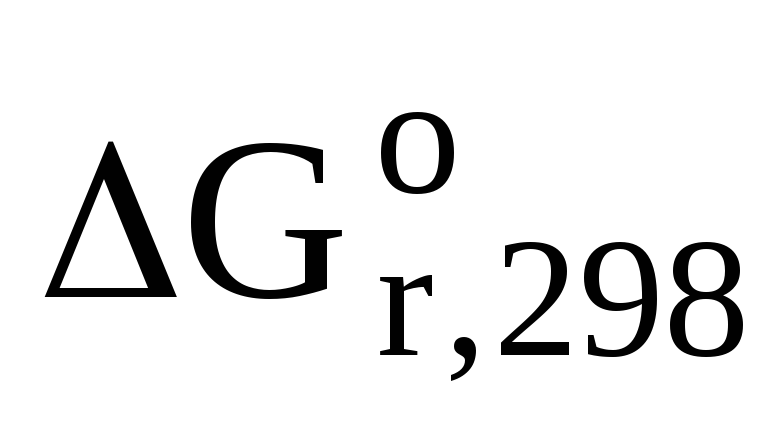 величина отрицательная, то протекание
реак-ции (4.3) возможно.
величина отрицательная, то протекание
реак-ции (4.3) возможно.
Аналогично определяется возможность протекания реакции в случае использования в качестве восстановителя магния.
Уровень b
1. Вычислить стандартную энтальпию растворения NaOH в воде, если при растворении 10 г NaOH в 250 мл воды температура раствора повысилась от 200С до 29,70С. Удельная теплоемкость раствора равна 3,99 Дж/(г·К).
Дано: |
|
Стандартную энтальпию растворения рассчитываем по уравнению:
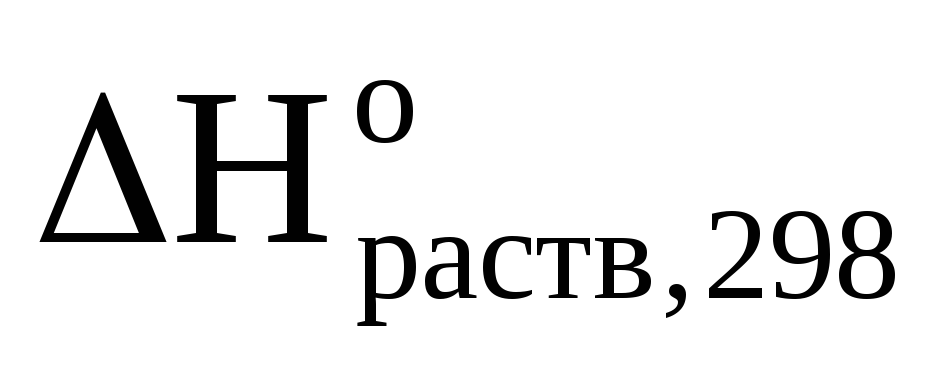 (NaOH)
=
(NaOH)
=
=  ,
(кДж/моль)
,
(кДж/моль)
где МNaOH — молярная масса NaOH, г/моль,
Qp = mр-ра·Ср(р-ра)·(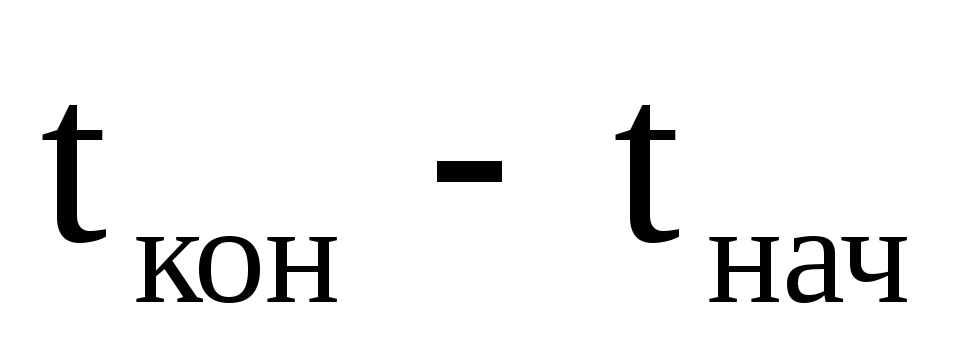 ),
-количество выделившейся теплоты при
растворенииNaOH,
Дж
mр-ра — масса
раствора, г;
),
-количество выделившейся теплоты при
растворенииNaOH,
Дж
mр-ра — масса
раствора, г;
Ср(р-ра) – теплоемкость раствора, кДж/(г×К) 1000 — пересчет Дж в кДж.
Для
рассматриваемой задачи 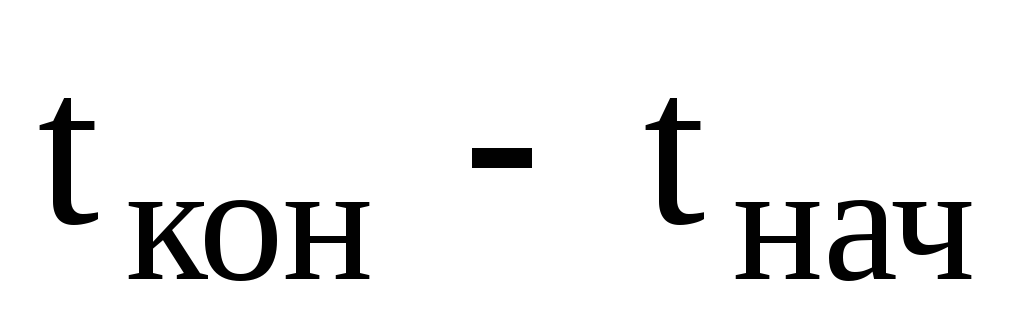 = 29,7-20 = + 9,70.При этом
знак «+» указывает на повышение
температуры при растворении, а знак «-»
— на понижение температуры.
= 29,7-20 = + 9,70.При этом
знак «+» указывает на повышение
температуры при растворении, а знак «-»
— на понижение температуры.
mр-ра = m + m
+ m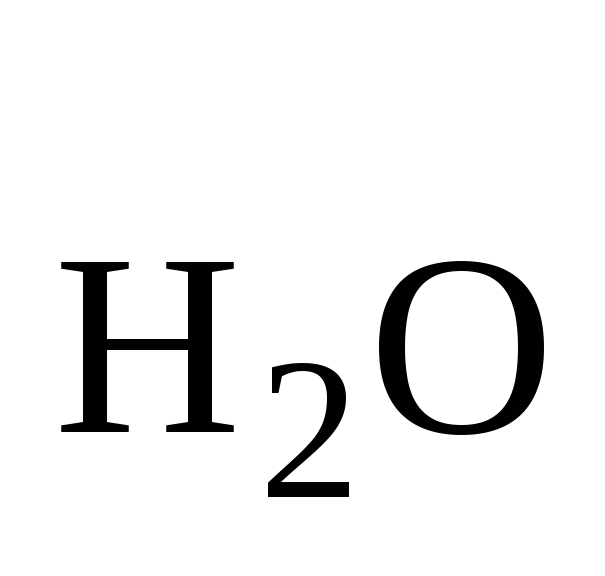 = 10+250 = 260 г.
= 10+250 = 260 г.
Тогда: QР = (10 + 250)·3,99·9,7 = 10062,8 Дж,
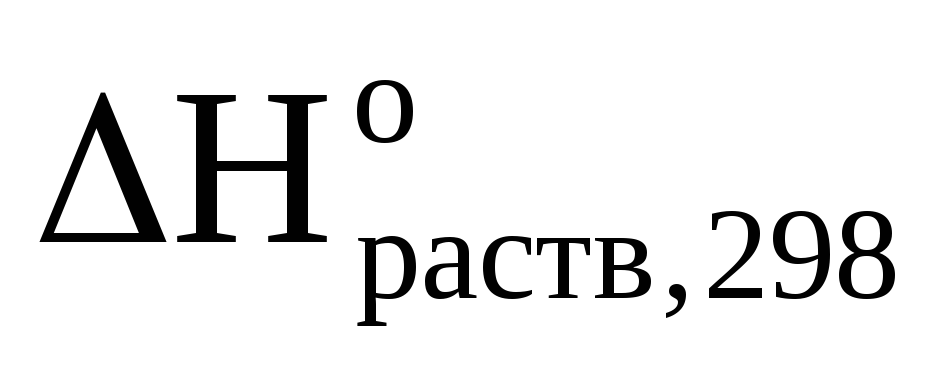 (NaOH)
=
(NaOH)
=  ,
,
Ответ: 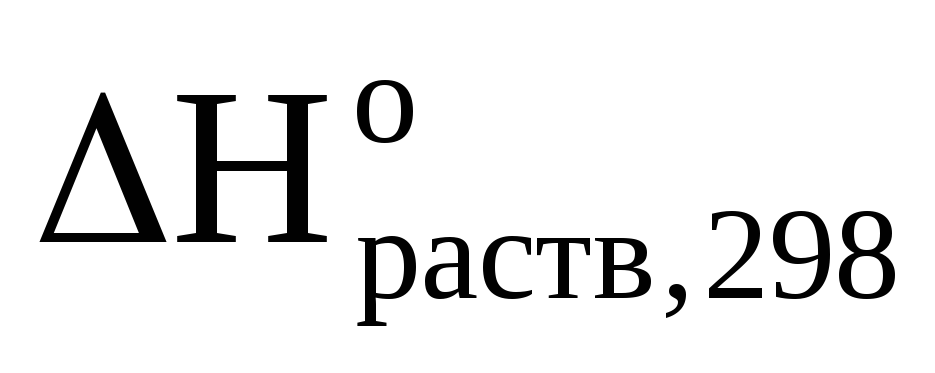 (NaOH)
= — 40,24 кДж/моль.
(NaOH)
= — 40,24 кДж/моль.
Найти массу метана, при полном сгорании, которого выделяется теплота, достаточная для нагревания 30 л воды от 20 до 90оС. Мольная теплоемкость воды равна 75,3 Дж/мольК. КПД теплового агрегата составляет 40%.
Дано: Ср = 75,3 Дж/мольК КПД = 40% |
|
Определяем количество теплоты, необходимое для нагревания 30 л воды от 20 до 90оС.
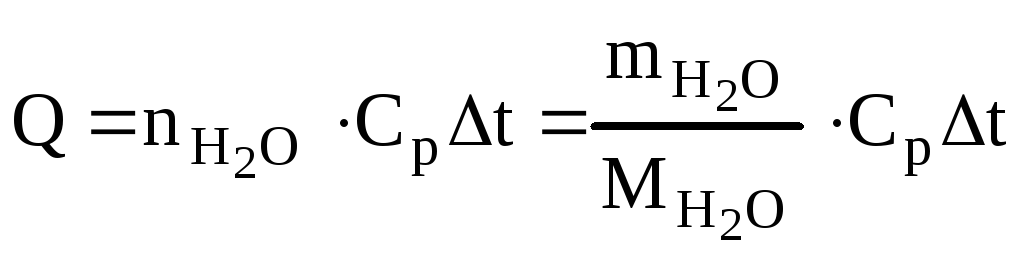
т.к. 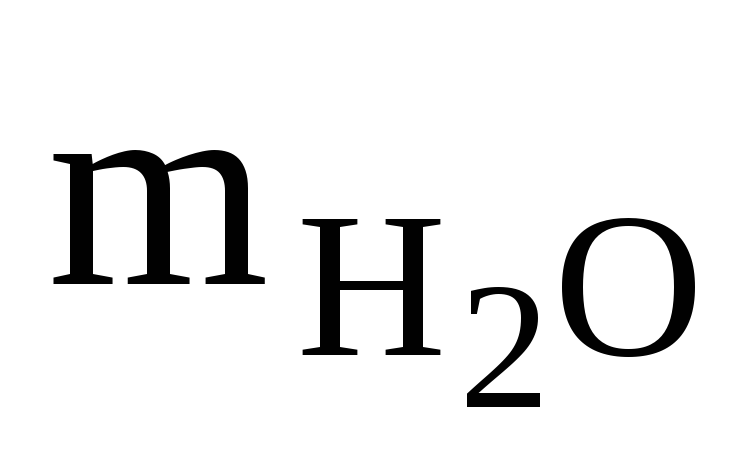 =
=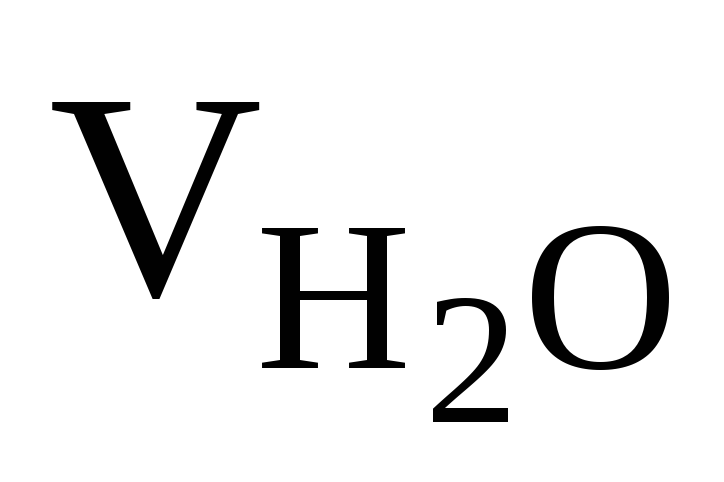
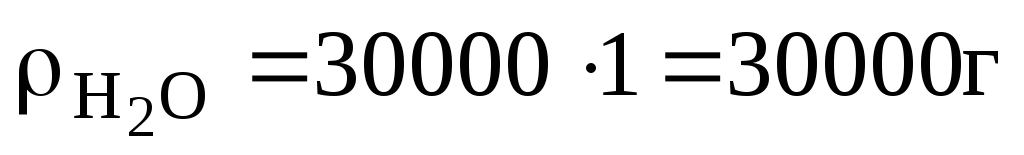
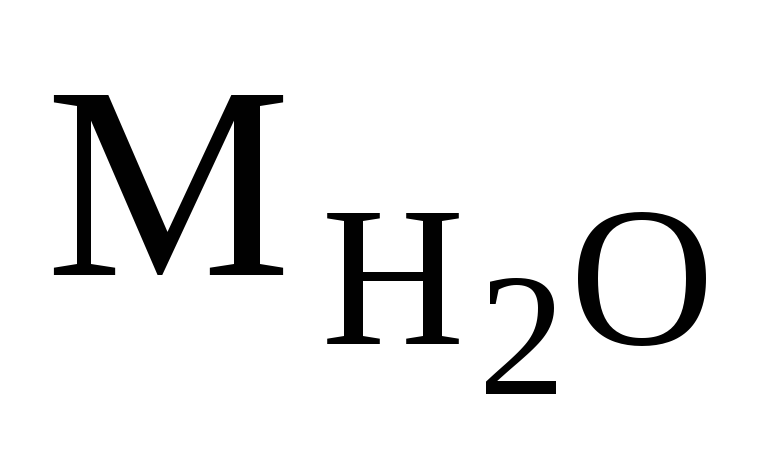 =
18 г/моль ∆t
= 90 – 30 = 60К
=
18 г/моль ∆t
= 90 – 30 = 60К

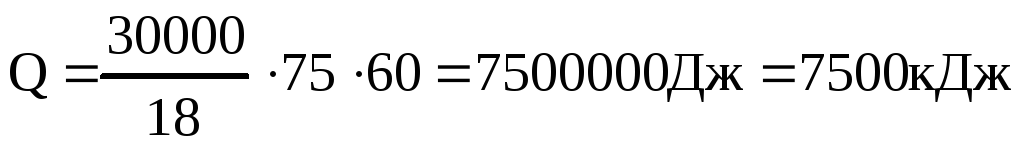
Учитывая КПД теплового агрегата потребуется
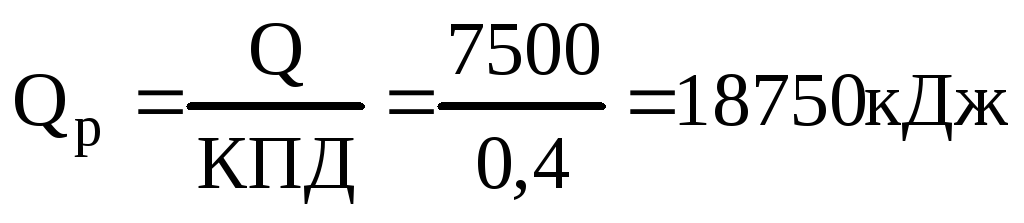 теплоты
теплоты
Такую теплоту необходимо получить при сжигании метана. Тепловой эффект реакции горения метана получим используя I следствие из закона Гесса
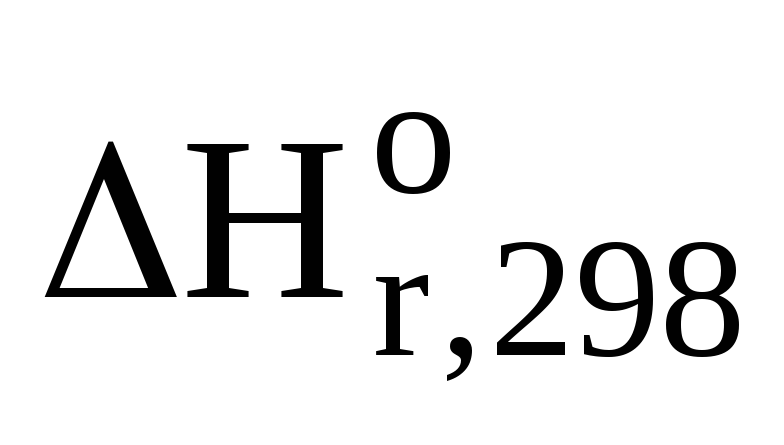 =
Σni
=
Σni (В)
— Σ nj
(В)
— Σ nj
продуктов исходных
реакции веществ
Уравнение горения метана
СН4(г) + О2(г) = СО2(г) + 2Н2О(г)
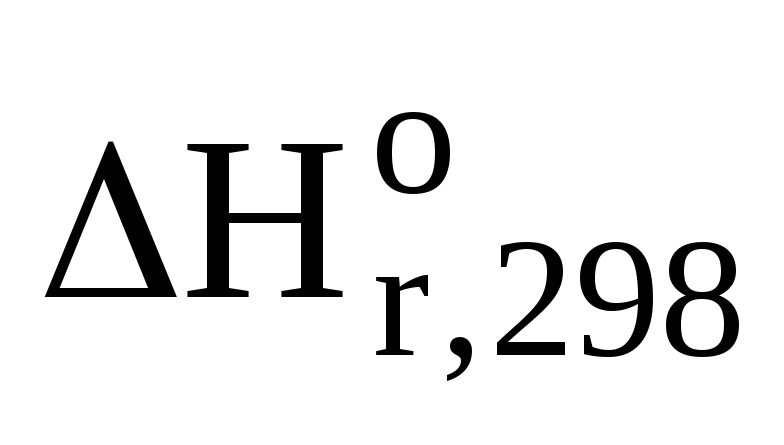 -74,9
0 -393,5 2(-241,84)
-74,9
0 -393,5 2(-241,84)
кДж/моль
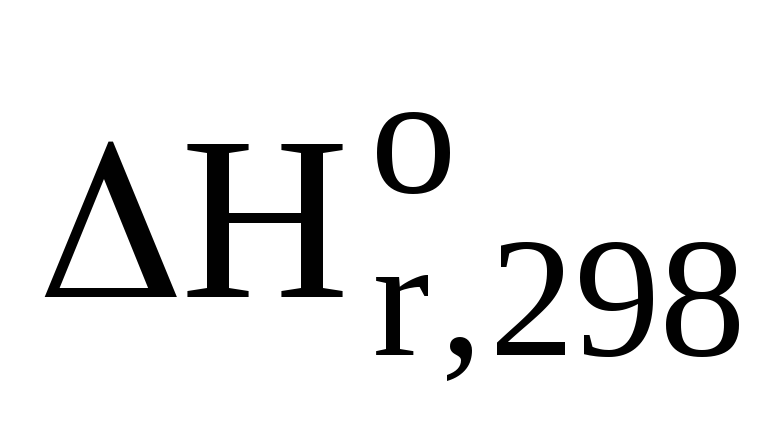 =
(-393,5) + 2(-241,84) –(-74,9) = — 802,28 кДж
=
(-393,5) + 2(-241,84) –(-74,9) = — 802,28 кДж
Так как при сгорании одного моль метана выделяется 802,28кДж, то определяем количество моль метана, которое необходимо для получения 18750 кДж теплоты.
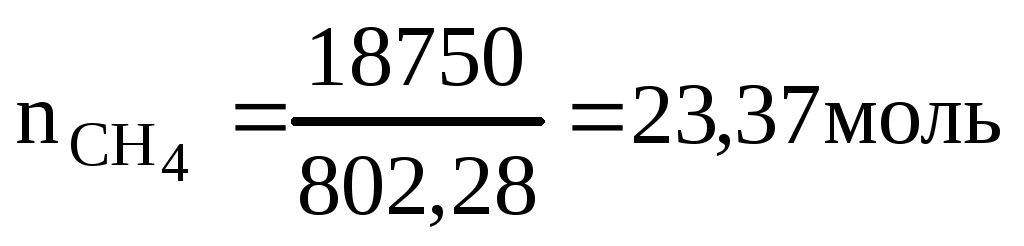
Определяем массу метана

Ответ: 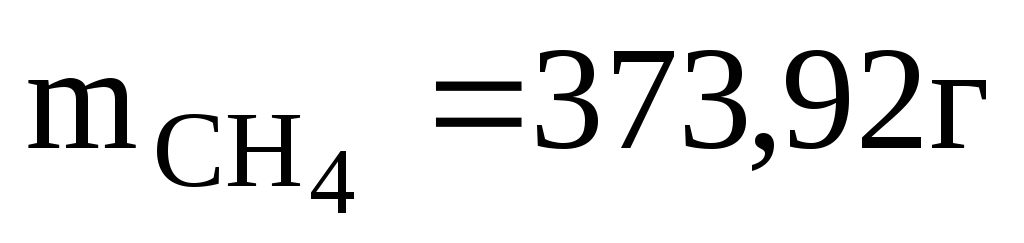
Следствия закона Гесса | Задачи 298
Задача 298.
Вычислить реакций:
Решение:
По табличным данным стандартные энтальпии образования С2Н6(г), С6Н6(ж), Н2О(г), Н2О(ж) и СО2(г) соответственно равны -89,7, -241,8, 82,9, -241,8, -285,8 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета реакций используем уравнение из следствия закона Гесса:
а) Находим стандартную энтальпию реакции:
б) Находим стандартную энтальпию реакции:
Ответ: а) 1423 кДж; б) 3301,3 кДж.
Задача 299.
Вычислить реакций:
Стандартные энтальпии образования L1+(водн.), Na+(водн.) и OH—(водн.) принять соответственно равными -278,5, -239,7 и -228,9 кДж/моль.
Решение:
По условию задачи и по табличным данным стандартные энтальпии образования веществ равны:
Для расчета реакций используем уравнение из следствия закона Гесса:
а) Находим стандартную энтальпию реакции:
б) Находим стандартную энтальпию реакции:
Ответ: а) -443,2кДж; б) -365,6кДж.
Задача 300.
Вычислить значение для протекающих в организме реакций превращения глюкозы:
Какая из этих реакций поставляет организму больше энергии?
Решение:
По табличным данным стандартные энтальпии веществ, участвующих в реакциях равны (стандартные энтальпии простых веществ принято считать равными нулю):
Для расчета реакций используем уравнение из следствия закона Гесса:
а) Находим стандартную энтальпию реакции:
б) Находим стандартную энтальпию реакции:
Реакция (б) поставляет организму больше энергии, чем реакция (а).
Ответ: а) -69,2 кДж; б) -2802,8 кДж.
Задача 301.
Зависит ли значение реакции от присутствия в системе катализаторов? Ответ обосновать.
Решение:
Катализаторы – это вещества, которые ускоряют процесс протекания химической реакции, но сами при этом в реакции не участвуют. Они ускоряют скорость как прямой, так и обратной реакции, но химическое равновесие системы не изменяют.
— это изменение энтальпии или внутренней энергии системы в результате реакции. зависит только от начального и конечного состояний, участвующих в реакции веществ и не зависит от промежуточных стадий процесса, в том числе и от скорости самой реакции (закон Гесса).
реакции определяется значениями стандартных энтальпий образования исходных веществ и продуктов реакции по уравнению из следствия закона Гесса:
Задача 302.
Объяснить, почему процессы растворения веществ в воде могут самопроизвольно протекать не только с экзотермическим < 0), но и с эндотермическим > 0) эффектом.
Решение:
Процессы растворения веществ в воде могут самопроизвольно протекать как с выделением, так и с поглощением теплоты, потому что растворение веществ в воде является не только физическим, но и, одновременно, химическим процессом. Химический процесс может быть или эндотермическим > 0) или экзотермическим < 0) в зависимости от природы реагирующих веществ, в данном случае – от природы растворяемого вещества.
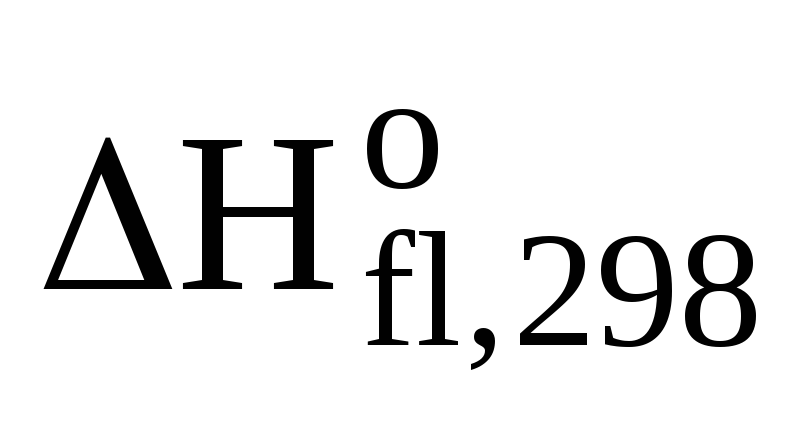 (CH3ОН(ж))
= =-726,64 кДж/моль
(CH3ОН(ж))
= =-726,64 кДж/моль (CH3ОН(ж))
— ?
(CH3ОН(ж))
— ?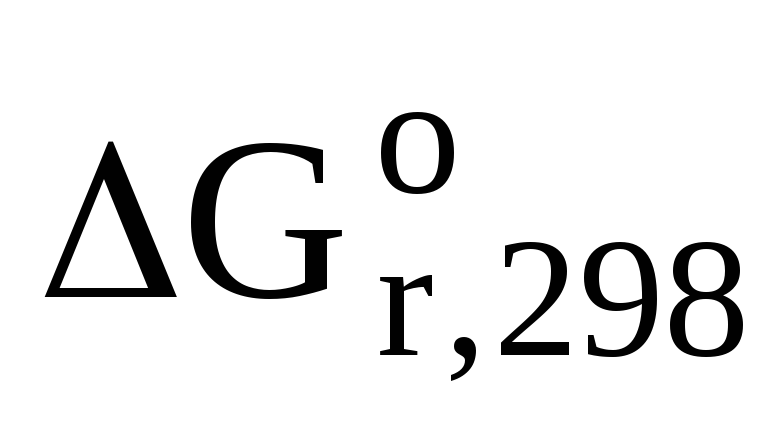 —
?
—
?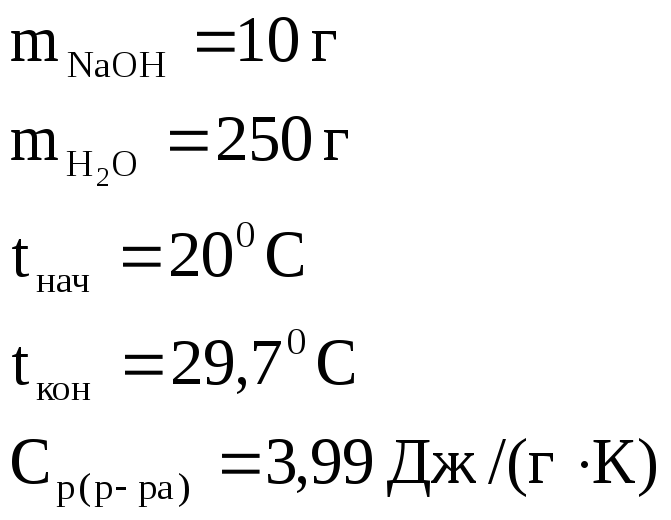
 (NaOH)
— ?
(NaOH)
— ?