Химические свойства оснований
1.
Основание + кислота  соль + вода
соль + вода
КОН
+ HCl  KCl + H2O.
KCl + H2O.
2.
Основание + кислотный оксид  соль + вода
соль + вода
2KOH
+ SO2 K2SO3 + H2O.
K2SO3 + H2O.
3.
Щелочь + амфотерный оксид/гидроксид  соль
+ вода
соль
+ вода
2NaOH(тв) + Al2O 2NaAlO2 + H2O;
2NaAlO2 + H2O;
NaOH(тв) + Al(OH)3 NaAlO2 + 2H2O.
NaAlO2 + 2H2O.
Основание + соль
 соль + основание.
соль + основание.
Реакция обмена между основанием и солью протекает только в растворе (и основание, и соль должны быть растворимы) и только в том случае, если хотя бы один из продуктов – осадок или слабый электролит (NH4OH, H2O)
Ba(OH)2 + Na2SO4 BaSO4
BaSO4 +
2NaOH;
+
2NaOH;
Ba(OH)2 + NH4Cl  BaCl2 + NH4OH.
BaCl2 + NH4OH.
Основание
 основной
оксид + вода.
основной
оксид + вода.
Термостойки только основания щелочных металлов за исключением LiOH
Ca(OH)2 CaO
+ H2O;
CaO
+ H2O;
NaOH  ;
;
NH4OH  NH3 + H2O.
NH3 + H2O.
Щелочь + металл (образующий амфотерный оксид)

2NaOH(тв) + Zn  Na2ZnO2 + H2.
Na2ZnO2 + H2.
КИСЛОТЫ
Кислотами с позиции ТЭД называются сложные вещества, диссоциирующие в растворах с образованием иона водорода Н+.
Классификация кислот
1. По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (HF, HNO2), двухосновные (H2CO3, H2SO4), трехосновные (H3PO4).
2. По составу кислоты делят на бескислородные (HCl, H2S) и кислородсодержащие (HClO4, HNO3).
3. По способности кислот диссоциировать в водных растворах их делят на слабые и сильные. Молекулы сильных кислот в водных растворах распадаются на ионы полностью и их диссоциация необратима.
Например,
HCl  H+ + Cl—;
H+ + Cl—;
H2SO4 H+ + HSO
H+ + HSO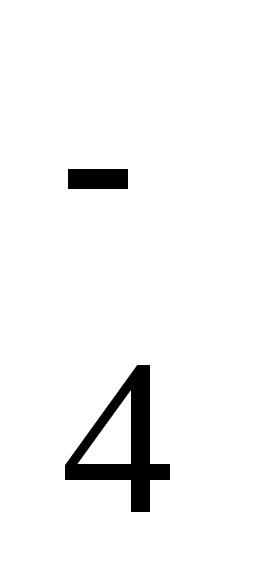 .
.
Слабые кислоты диссоциируют обратимо, т.е. их молекулы в водных растворах распадаются на ионы частично, а многоосновные — ступенчато.
СН3СООН 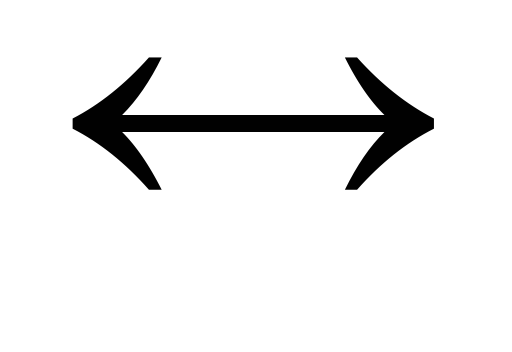 СН3СОО— + Н+;
СН3СОО— + Н+;
1)
H2S 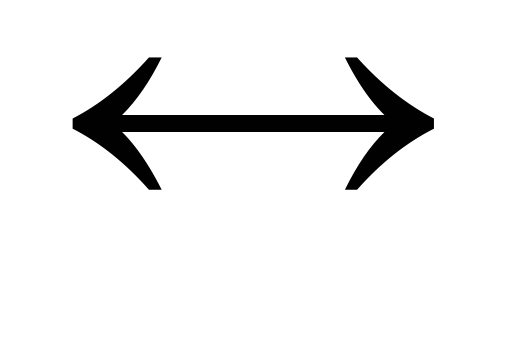
 H+ + S2-.
H+ + S2-. Часть
молекулы кислоты без одного или нескольких
ионов водорода Н+ называется кислотным
остатком.
Заряд кислотного остатка всегда
отрицательный и определяется числом
ионов Н+,
отнятых от молекулы кислоты. Например,
ортофосфорная кислота H3PO4 может
образовать три кислотных остатка: H2PO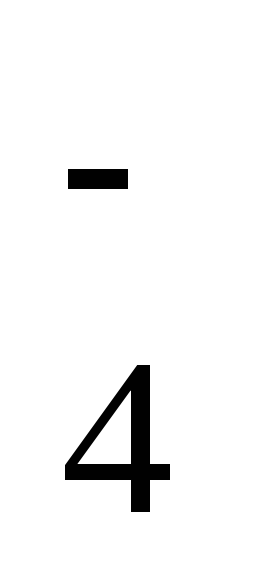 —
дигидрофосфат-ион, HPO
—
дигидрофосфат-ион, HPO —
гидрофосфат-ион, PO
—
гидрофосфат-ион, PO —
фосфат-ион.
—
фосфат-ион.
Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN — — циан) окончание — водородная: HCl – хлороводородная кислота (соляная кислота), H2S – сероводородная кислота, HCN – циановодородная кислота (синильная кислота).
Названия
кислородсодержащих кислот также
образуются от русского названия
кислотообразующего элемента с добавлением
слова «кислота». При этом название
кислоты, в которой элемент находится в
высшей степени окисления, оканчивается
на «…ная» или «…овая», например, H2SO4 – серная
кислота, H3AsO4 – мышьяковая
кислота. С понижением степени окисления
кислотообразующего элемента окончания
изменяются в следующей последовательности: «…ная» (HClO4 – хлорная кислота), «…оватая» (HClO3 – хлорноватая
кислота), «…истая» (HClO2 – хлористая
кислота), «…оватистая» (HClO-
хлорноватистая кислота). Если элемент
образует кислоты, находясь только в
двух степенях окисления, то название
кислоты, отвечающей низшей степени
окисления элемента, получает окончание
«…истая» (HNO
Одному и тому же кислотному оксиду (например, Р2О5) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например, HPO3 и H3PO4). В подобных случаях к названию кислоты, содержащей наименьшее число атомов кислорода в молекуле, добавляется приставка «мета…», а к названию кислоты, содержащей в молекуле наибольшее число атомов кислорода – приставка «орто…» (HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота).
Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, то к ее названию добавляется числительная приставка, например, Н 4Р2О7 – двуфосфорная кислота, Н2В4О7 – четырехборная кислота.
Кислоты, содержащие в своем составе группировки атомов –О-О-, можно рассматривать как производные перекиси водорода. В случае необходимости после приставки «пероксо…» в название кислоты помещают числительную добавку, указывающую на число атомов кислотообразующего элемента, входящего в состав молекулы, например,
Н2SO5 H2S2O8


 H
— O O
O
O
H
— O O
O
O

 S
H
– O – S
–O – O – S – O — H
S
H
– O – S
–O – O – S – O — H H
— O — O  O
O
O
O
O
O
Пероксосерная кислота Пероксодвусерная кислота
Химические свойства кислот
Кислота + основание
 соль + вода
соль + вода
HF
+ KOH  KF + H2O.
KF + H2O.
Кислота + основной оксид
соль + вода
H2SO4 + CuO  CuSO4 + H2O.
CuSO4 + H2O.
Кислота + амфотерный оксид/гидроксид
 соль + вода
соль + вода
2HCl
+ BeO  BeCl2 + H2O.
BeCl2 + H2O.
Кислота + соль
 соль + кислота.
соль + кислота.
Кислоты взаимодействуют с растворами солей, если при этом образуется нерастворимая в кислотах соль или более слабая (летучая) по сравнению с исходной кислота
H2SO4 + BaCl2
 BaSO4
BaSO4  +2HCl;
+2HCl; 2HNO3 + Na2CO3 2NaNO3 + H2O +
CO2
2NaNO3 + H2O +
CO2 .
.
Кислота
 кислотный
оксид + вода
кислотный
оксид + вода
Н2СО3 Н2О
+ СО2.
Н2О
+ СО2.
Кислота + металл (в ряду напряжений до Н2)
 соль + Н2
соль + Н2
H2SO4(разб) + Fe  FeSO4 + H2;
FeSO4 + H2;
HCl
+ Cu  .
.
На рисунке 2 показано взаимодействие кислот с металлами.
КИСЛОТА — ОКИСЛИТЕЛЬ
Металл в ряду напряжения после Н2
+ реакция не идет
реакция не идетМеталл в ряду напряжения до Н2
+  соль металла
+ Н2
соль металла
+ Н2
в min степени
H2SO4 концентриро-
ванная
Au, Pt, Ir, Rh, Ta
окисления (с.о.) +  реакция
не идет
реакция
не идет
Металл щелочной/ щелочноземельный/Mq/Zn
H2S/SO2/S
от условий
Сульфат металла в max с.о.
Н2О
+  + +
+ +
+
Металл (остальные)
SO2
+  +
+
+
+
HNO3 концентриро-
ванная
Au, Pt, Ir, Rh, Ta
+  реакция не идет
реакция не идет
Металл щелочной/ щелочноземельный
N2O
Нитрат металла в max с.о.
Н2О
Металл (остальные; Al,Cr, Fe, Co, Ni при нагревании)
NO2
ТN +
+
 +
+
+
HNO3 разбавленная
Au, Pt, Ir, Rh, Ta
+  реакция
не идет
реакция
не идет
Металл щелочной/ щелочноземельный
NH3 (NH4NO3)
Нитратметал
ла в max с.о.
Н2О
+  +
+
Металл (остальные в ярду напряжений до Н2)
NO/N2O/N2/NH3(NH4NO3)
от условий
+ 
Металл (остальные в ряду напряжений после Н2)
NO
+ +
Рис.2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ
СОЛИ
Соли – это сложные вещества, диссоциирующие в растворах с образованием положителльно заряженных ионов (катионов – основных остатков), за исключением ионов водорода, и отрицательно заряженных ионов (анионов – кислотных остатков), отличных от гидрокисид – ионов.
studfile.net
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солей
www.repetitor2000.ru
I Определение оксидов, кислот, оснований, солей.
Методические рекомендации для учащихся первого курса по теме: «Основные классы неорганических соединений»
1. ОКСИДЫ – сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Элементом может быть как металл, так и неметалл.
2. КИСЛОТЫ – сложные вещества, состоящие из атомов водорода, способных замещаться атомами металла, и кислотных остатков. Водород в формулах кислот всегда пишется на первом месте.
Кислоты – это гидроксиды неметаллов.
3. ОСНОВАНИЯ – сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ОН.
Основания – это гидроксиды металлов.
4. СОЛИ – сложные вещества, состоящие из атомов металла и кислотных остатков.
II Классификация оксидов
Все оксиды делят на две группы: солеобразующие и несолеобразующие.
Несолеобразующие – это оксиды, которые не образуют солей ни с кислотами, ни
с основаниями. К ним относятся оксиды: CO, NO, N2O, SiO. Все эти оксиды –
оксиды неметаллов.
Солеобразующие оксиды – это оксиды, которые образуют соли либо с кислота-
ми, либо с основаниями.
Солеобразующие оксиды делят на три группы: кислотные, основные и амфо-
терные.
КИСЛОТНЫЕ ОКСИДЫ – это оксиды, которым соответствуют кислоты. К
ним относятся все оксиды неметаллов (за исключением несолеобразующих) и
оксиды металлов с валентностью 4 и больше.
Например: SO3 – H2SO4 SO2 – H2SO3 CO2 – H2CO3 SiO2 – H2SiO3
P2O5 – H3PO4 и HPO3 N2O5 – HNO3 CrO3 – H2CrO4 SeO2 – H2SeO3
(Оксиды S, C, Si, P, N – это оксиды неметаллов, а оксиды Cr (VI) и Se (IV) – это
оксиды металлов. Однако и те и другие – это кислотные оксиды).
Таким образом, надо иметь в виду, что оксиды неметаллов – это всегда кислотные
оксиды, а оксиды металлов могут быть как основными, так и кислотными.
ОБРАТИТЕ ВНИМАНИЕ! Валентность (и степень окисления) элемента в оксиде
и кислоте должны быть ОДИНАКОВЫМИ.
Формулу кислоты легко записать по формуле оксида Для этого надо мысленно
(или на черновике) прибавить воду Н2О к оксиду и (если в этом есть необходи-
мость) сократить.
Например: формула оксида N2O3. Прибавляем к N2O3 воду Н2О.Получаем –
Н2 N2O4; сокращаем на 2 – получаем НNO2.
Второй пример: формула оксида V2O5. Прибавляем к V2O5 воду Н2О.
Получаем — Н2 V2O6; сокращаем на 2 – получаем НVO3.
Третий пример: формула оксида Cl2O7. Прибавляем к Cl2O7 воду Н2О.
Получаем — Н2 Cl2O8; сокращаем на 2 – получаем НClO4.
Четвертый пример: формула оксида МоO3. Прибавляем к МоO3 воду Н2О.
Получаем — Н2 МоO4; естественно, сокращать в этом случае просто нечего.
ОСНОВНЫЕ ОКСИДЫ – это оксиды, которым соответствуют основания. К
ним относятся только оксиды металлов (за исключением тех, которые относятся
к кислотным, то-есть с валентностью металла 4 и больше.
НАПРИМЕР: К2О – КОН Na2O – NaOH BaO – Ba(OH)2
FeO – Fe(OH)2 Fe2O3 – Fe(OH)3 CrO – Cr(OH)2 Ag2O – AgOH
ПОМНИТЕ! Валентность гидроксогруппы ОН равна 1. Валентность металла
может быть не только постоянной, но и переменной.
АМФОТЕРНЫЕ ОКСИДЫ – это оксиды, которые проявляют свойства как
основных, так и кислотных оксидов. К ним относятся только некоторые оксиды
металлов – Al2O3, ZnO, BeO, Cr2O3 (эти оксиды надо запомнить) и ряд других.
Если амфотерный оксид реагирует с кислотой, то он реагирует как обычный
основный оксид. Если же амфотерный оксид реагирует со щелочью, то в этом
случае он реагирует как кислотный оксид и ему соответствует кислота, формулу
которой находим так же, как и с любым кислотным оксидом, то-есть прибавляя
Н2О.
НАПРИМЕР: Al2O3 – Н2Al2O4; сокращаем на 2, получаем НАlО2. Если же Al2O3
реагирует с кислотой, то, естественно, ему соответствует гидроксид Аl(ОН)3.
studfile.net
Химические свойства оксидов, оснований, кислот и солей.
Кислоты в свете ТЭД
- Химические свойства кислот.
-
 Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)

-
Кислота Р.+ МехОу (степень окисления Ме от +1до +4) = сольР. + вода (р. Обмена,)

-
Кислота Р.+ соль Р. иногда Н.= новая кислота + новая соль (р. Обмена, ↓, ↑-СО2, SO2, Н2S, кислота сильнее новой кислоты)

- Кислота + Ме = соль + Н2↑ (р. Замещения, происходит если: а) Ме стоит в ЭХРН до Н2, б) Соль — р., в) Кислота – р., г) Кислота не HNO3 и не конц. Н2SO4)

- Способы получения
- Кислотный оксид + вода = кислота (кислородсодержащие кислоты)
- НеМе + Н2= НхнеМе (бескислородные кислоты)
- Соль + кислота = новая кислота + новая соль↓
Основания в свете ТЭД
- Химические свойства оснований.
-
 Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь) 
- Основание Р.+ МехОу (степень окисления Ме от +5 до +7) = соль + вода (р. Обмена)
Основание Р.+ неМехОу = соль + вода (р. Обмена)
- Основание Р.+ соль Р.= новое основание + новая соль (р. Обмена, ↓, ↑-NH3)
- Нерастворимое основание t= неМехОу + Н2О↑ (р. Разложения)
- Способы получения
- Оксид Ме + вода = щелочь (Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, BaO, SrO)
- Щелочной 2Ме + 2Н2О= 2МеОН Р + Н2↑ (щелочь) ( Li, Na, K, Rb, Cs)
Щелочноземельный Ме + 2Н2О= Ме(ОН) Р (щелочь) + Н2↑ (Ca, Ba, Sr)
- Соль р + основание р = новое основание↓+ новая соль
Соли, их классификация, свойства в свете ТЭД


 Соли
Соли



Свойства солей
1. Соль + кислота = другая соль + другая кислота (↓ или ↑ CO2, SO2, H2S)
2. Соль (р) + щелочь = другая соль + другое основание (↓ или ↑ NH3)
3. Соль1 (р) + соль2 (р) = соль3 + соль4 (↓ )
4. Соль (р) + металл (более активный, но не IA, IIA-подгрупп) = другая соль (р) + другой металл (менее активный)
5. Некоторые соли могут разлагаться при прокаливании.
СаСО3 = СаО + СО2
(CuOH)2 СО3 CuO + CO2 + H2O
2NaHCO3Na2CO3 + CO2 + H2O







 MeNO3 —
MeNO3 —



Оксиды, их классификация, свойства в свете ТЭД

 Оксиды
Оксиды


 Несолеобразующие Солеобразующие
Несолеобразующие Солеобразующие
CO, N2O, NO, SiO,
Основные Амфотерные Кислотные
Ме+1,+2xOy Ме+3,+4xOy Ме>+4xOy
НЕМеxOy
Химические свойства основных оксидов
1. О.О + кислота = соль + вода
2. O.O+ вода = щелочь!!!
3. О.О + К.О = соль
4. О.О + А.О = соль
Химические свойства кислотных оксидов
1. К.О + основание = соль + вода
2. К.O+ вода = кислота (искл. SiO2)
3. О.О + К.О = соль
4. K.О + А.О = соль
5. K.O + соль летучих К.О= новая соль + летучий К.О↑
Химические свойства амфотерных оксидов
1. А.О + щелочь = соль + вода
А.О + кислота = соль + вода
2. А.O+ вода = реакция не идет
3. А.О + К.О = соль
4. А.О + О.О = соль
5. А.O + соль летучих К.О= новая соль + летучий К.О↑
mega-talant.com
Кислоти, основания, соли основные свойства
|
Кислоты
H2SO4 — серная (сульфаты) HCl — соляная (хлориды) HNO3 — азотная (нитраты) H3PO4 — фосфорная (Фосфаты) H2SO3 -сернистая (сульфиты) H2S — сероводород (сульфиды) H2CO3 — угольная (карбонаты) H2SiO3 — кремниевая (силикаты) |
Основания NaOH — гидроксид натрия KOH — гидроксид калия Ca(OH)2 — гидроксид кальция Ba(OH)2 — гидроксид бария Mg(OH)2 — гидроксид магния Cu(OH)2 — гидроксид меди (II) Fe(OH)2 — гидроксид железа (II) Fe(OH)3 — гидроксид железа (III) Al(OH)3 — гидроксид алюминия |
Соли CuSO4 — сульфат меди (II) NaCl — хлориднатрия Fe(NO3)3 — нитрат железа (III) Ba3(PO4)3 -фосфат бария MgSO3 — сульфит магния FeS -сульфид железа (II) CaCO3 -карбонат кальция K2SiO3 -силикат калия Al2(SO4)3 -сульфат алюминия |
1. Кислоты реагируют
- с металлами, стоящими в ряду активностм левее водорода с выделением водорода (кроме азотной и концентрированной серной)
- с основными оксидами с образованием соли и воды
- с основаниями с образованием соли и воды
- с солями, образованными более слабыми кислотами с выпадением осадка или выделением газа
2. Азотная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а образуются различные соединения азота (NH4NO3, N2, N2O, NO, NO2) в зависимости от концентрации кислоты и активности металла.
3. Концентрированная серная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а выделяются различные соединения серы (H2S, S, SO2) в зависимости от активности металла.
4. Вытеснительный ряд кислот (по убыванию):
H2SO4 —> HCl и HNO3 —> H3PO4 —> H2SO3 —> H2S —> H2CO3 —> H2SiO3
5. Кислоты (кроме нерастворимой в воде кремниевой кислоты) изменяют окраску индикаторов: фиолетовый лакмус в кислотах краснеет, оранжевый метилоранж становится розовым.
6. Щелочи реагируют с кремнием, галогенами, кислотами, кислотными и амфотерными оксидами, амфотерными металлами и растворимыми солями, если выпадает осадок или выделяется газ аммиак.
7. Щелочи при нагревании не разлагаются, изменяют окраску индикаторов: фиолетовый лакмус в щелочах синеет, оранжевый метилоранж становится желтым, бесцветный фенолфталеин становится малиновым.
8. Нерастворимые основания реагируют с кислотами и разлагаются при нагревании на оксид металла и воду.
9. Амфотерные основания реагируют с кислотами, щелочами и разлагаются при нагревании.
10. Соли реагируют
-
со щелочами (если выпадает осадок или выделяется газ аммиак)
-
с кислотами, более сильными, чем та, которой образована соль
-
с другими растворимыми солями (если выпадает осадок)
-
с металлами (более активные вытесняют менее активные)
-
с галогенами (более активные галогены вытесняют менее активные и серу)
11. Нитраты разлагаются с выделением кислорода:
-
если металл стоит до Mg, образуется нитрит + кислород
-
если металл от Mg до Cu, образуется оксид металла + NO2 + O2
-
если металл стоит после Cu, образуется металл + NO2 + O2
-
нитрат аммония разлагается на N2O и H2O
12. Карбонаты щелочных металлов не разлагаются при нагревании
13. Карбонаты металлов II группы разлагаются на оксид металла и углекислый газ
Давайте порассуждаем вместе
1. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Na2CO3 + HCl 1) NaCl + CO2 + H2O Б) Na2CO3 + CO2 + H2O 2) NaHCO3 + HCl В) Na2CO3 + CaCl2 3) NaOH + NaHCO3 4) NaHCO3 5) NaCl + CaCO3
Ответ:
т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CO2 + H2O = NaHCO3
Na2CO3 + CaCl2 = 2NaCl + CaCO3
2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) H2SO4 + MgO 1) MgSO4 + H2O Б) H2SO4 + Mg(OH)2 2) MgSO4 + H2 В) Mg + H2S 3) MgS + H2O 4) MgH2 + S 5) MgS + H2
Ответ:
т.к. H2SO4 + MgO = MgSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
Mg + H2S = MgS + H2
3. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Al2O3 + NaOH 1) NaAlO2 + H2O Б) Al2O3 + HCl 2) NaH2AlO3 В) Na2SO3 + CaCl2 3) AlCl3 + H2O 4) AlCl3 + H2 5) NaCl + CaSO3
Ответ:
т.к. Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Na2SO3 + CaCl2 = 2NaCl + CaSO3
dx-dy.ru
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим  |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым  |
Универсальный индикатор | Универсальный индикатор становится синим  |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
www.yaklass.ru
Химические свойства солей: средних, кислых, основных, комплексных.
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):

В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:

Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:

В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:

Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:

Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:

Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:


а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:

Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:



Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):

Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:

Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:

Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:

Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:



Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:


Также для основных солей характерны реакции разложения при нагревании, например:

Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:

Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:

Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
![Na2[Zn(OH)4] → Na2ZnO2 + 2h3O](http://xn--90abjbtjdof1b8dvb.xn--p1ai/wp-content/plugins/a3-lazy-load/assets/images/lazy_placeholder.gif)
![Na[Al(OH)4] → NaAlO2 + 2h3O](http://xn--90abjbtjdof1b8dvb.xn--p1ai/wp-content/plugins/a3-lazy-load/assets/images/lazy_placeholder.gif)
scienceforyou.ru
 соль + основание.
соль + основание. основной
оксид + вода.
основной
оксид + вода.
 соль + вода
соль + вода
 соль + вода
соль + вода соль + кислота.
соль + кислота.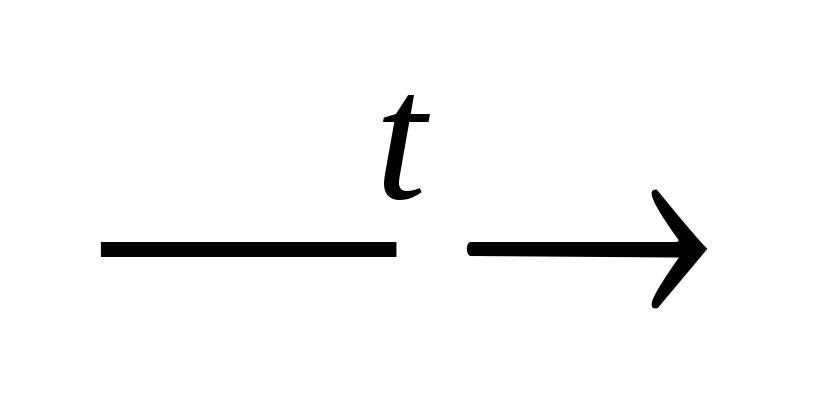 кислотный
оксид + вода
кислотный
оксид + вода соль + Н2
соль + Н2 Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)


 Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)