Химические вещества: примеры, свойства
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.

Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.

Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
ФИЗИЧЕСКИЕ ТЕЛА И ВЕЩЕСТВА. МАТЕРИАЛЫ — НАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ Химия 7 класс Ярошенко О.Г. — Сиция 2015 год
Тема 1 ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
В этой теме вы узнаете о:
• физические тела и вещества, из чего состоят вещества
• многообразие веществ
• физические и химические свойства веществ
• атом, его состав
• химические элементы, их названия и символы
• периодическую систему химических элементов Д. И. Менделеева, ее структура
• относительные атомные массы химических элементов и относительные молекулярные массы веществ
• химические формулы веществ, вычисления с ними относительных молекулярных масс и массовой доли элемента в сложном веществе
• валентность химических элементов
• связь между размещением элемента в периодической системе и его валентностью
• физические и химические явления
§ 5. ФИЗИЧЕСКИЕ ТЕЛА И ВЕЩЕСТВА. МАТЕРИАЛЫ
Изучение параграфа поможет вам:
· различать физические тела, вещества, материалы;
· приводить примеры физических тел, веществ, материалов
ФИЗИЧЕСКИЕ ТЕЛА И ВЕЩЕСТВА. Как вам известно из природоведения, тела, или физические тела — это все живое и неживое, что создали природа и человек на Земле. Для лучшего осознания этого понятия учтите следующее определение.
Физическое тело всегда имеет форму, ограниченную определенной, свойственной ему поверхностью, и массу.
Твердые тела, которые человек производит для своих нужд, имеют название предметов. На кухне такими предметами е тарелки, ложки, вилки, кастрюли, сковородки и много других. Гостиную обустраивают столом, стульями, телевизором, ковром и тому подобное. То есть предметов очень много, они разнообразны, их используют для создания комфортных бытовых условий.
Ледяная сосулька, капля росы на листьях, снежинка, снеговик, ледяная скульптура (рис. 19) — это примеры физических тел. Они интересны тем, что созданы из одного вещества — воды.
Восстановите в памяти
Приведите примеры небесных тел. Опишите форму, охарактеризуйте размеры и массу одного из них по сравнению с Землей.
Рис 19. Физические тела, состоящие из воды
Рис. 20. Налив воды из делительной воронки в химический стакан
Но, согласитесь, у каждого тела — свои, присущие только ему, форма и размеры.
На рис. 20 изображен налива воды из делительной воронки в химический стакан. Будет неправильно назвать воду в этом случае физическим телом. А все потому, что она не имеет формы, которая бы хранила, как это мы видели на предыдущем рисунке. В данном случае вода — вещество, одна порция которой содержится в воронке, другая— в стакане. В каждом сосуде это вещество приобрела форму сосуда. Не проводя измерений, взглянув на рисунок, видим, что масса и объем этого вещества в воронке и стакане разные.
— Понятие вещества не связывают с конкретной формой и размерами. Веществами называют то, из чего образованы физические тела.
На примере с ледяной сосулькой, снежинкой, снеговиком видим, как из одного вещества образовалось несколько тел. Таких примеров достаточно много, и вы их можете привести самостоятельно.
Такие вещества, как кислород, углекислый газ, йод, глюкоза, етанова (уксусная) и лимонная кислоты, поваренная соль, пищевая сода, вам уже известны. В целом, веществ, которые существуют в природе и созданы человеком, очень много — более 10 млн.
Восстановите в памяти
Что вам известно об использовании названных веществ?
— Из одной и той же вещества могут образоваться или быть изготовлены различные физические тела.
Случается наоборот — предметы одного назначения изготовляют из разных веществ. Так, скрепки бывают стальными и пластмассовыми, пакеты — полиэтиленовыми и бумажными, ложки — стальными, серебряными, деревянными.
Следует помнить, что тела живой природы (растения, грибы, животные и другие) независимо от того, они одноклеточные или многоклеточные, никогда не образуются из одного вещества.
МАТЕРИАЛЫ 1. Довольно часто к веществ или их смесей, из которых изготавливают тела, применяют название материалы.
Восстановите в памяти
Вспомните и приведите примеры одноклеточного и багатоклітинного организмов.
— Материалами называют вещества или смеси веществ, которые образовались в природе или были получены человеком и предназначенные для изготовления тел.Вы видите примеры тел, изготовленных человеком из различных материалов (рис. 21). Так, карандаш изготовлен по меньшей мере из 4-х материалов — графита, древесины, резины, краски (нанесена на его поверхность). Кухонные ножи имеют стальные лезвия и пластмассовые или деревянные ручки. Деревья созданы природой, а деревянные изделия изготовила человек из их стволов, применив дополнительно клей, железные гвозди, краску и т. п (рис. 22).
СОВРЕМЕННЫЕ МАТЕРИАЛЫ. Сначала человек использовал природные материалы (камень, дерево, волокнистую часть стеблей льна или конопли), а со временем сама начала создавать нужные ей вещества и материалы.
Познавая вещества, человек находил им то или иное применение. В первых водопроводах вода двигалась деревянными желобами, со временем их заменили металлические трубы. На сегодня массовым является изготовление водопроводных труб из полиэтилена. Этот материал, в отличие от предыдущих, легкий и долговечный, не подвергается разрушительному воздействию внешней среды.
Сперва построенные человеком дома были без окон или имели узкие отверстия, которые закрывались на зиму. И только с изобретением способов изготовления материала под названием стекло дневное освещение домов стало привычным явлением. Сейчас впечатляющей является количество веществ, которые не существуют в природе, а изготовленные человеком искусственно. И в этом заслуга химической науки.
В повседневной жизни нас окружают различные материалы, что является веществами или смесями веществ, в основном созданными человеком благодаря достижениям химической науки. На рис. 23 изображены хорошо известные вам предметы, изготовленные из материалов, которых нет в природе. Если бы прекратилось производство этих веществ, мы лишились бы многих предметов, без которых уже не представляем своего быта.
Или еще такой пример. Материал, без которого невозможно производство покрышек для велосипедных, мотоциклетных, тракторных, автомобильных колес, называется резина. В его состав входят такие вещества, как каучук, сера, углерод.
Рис. 21. Тела, изготовленные из различных материалов
Рис. 22. Древесина — распространенный природный материал
Рис. 23. Изделия из созданных человеком материалов
Довольно часто в названии предметов звучат названия и предмета и материала, из которого он изготовлен. Например: серебряная ложка, железный гвоздь, резиновый мяч и тому подобное.
— Химические знания сделали возможным создание веществ и материалов, которых не существует в природе. Благодаря этому человек имеет возможность изготавливать множество разнообразных физических тел, или предметов.
Как видите, современная химия изучает не только вещества, что существуют в природе, но и занимается созданием новых веществ и материалов. В этих исследованиях ученые довольно часто руководствуются желанными, то есть заранее запланированными свойствами, которые отсутствуют у природных веществ.
Что же понимают под свойствами веществ? Об этом речь пойдет в следующем параграфе.
Копилка эрудита
Среди материалов большое значение приобрели сплавы. Такое название имеют твердые смеси нескольких металлов или металлов с неметаллами. Сплав бронза известный людям с III тыс. к н. е. Сейчас его тоже широко используют. В столице нашего государства (Киеве) из этого сплава построен памятник Богдану Хмельницкому (рис. 24).
Сплавы на основе алюминия появились значительно позднее бронзу. Да и сам алюминий добыли в чистом виде только в 1825 г. В XIX ст. металл был настолько дорогим. что стоил дороже золота. В настоящее время алюминий занимает второе место после железа по добыче и стоимость его умеренная. В Украине первый алюминиевый завод был построен в 1933 г. вблизи м. Запорожье.
Сплавы алюминия легкие, прочные, устойчивые к негативному воздействию окружающей среды. Такие их свойства незаменимы в самолето — и ракетостроении. Недаром алюминий называют «крылатым металлом» (рис. 25).
Рис. 24. Памятник Богдану Хмельницкому в Киеве
Рис. 25. Корпус самолета изготавливают из сплавов алюминия
?
1. Сформулируйте определения понятий: физическое тело, предмет, вещество, материал. Что характерно для тел, но отсутствует у веществ?
2. Приведите примеры современных материалов и изделий из них.
3. Изменится форма железных гвоздей, если высыпать их в ведро? Это дало основания отнести их к: а) тел; б) веществ.
4. Запишите примеры тел, изготовленных из одного вещества.
5. Заполните колонки таблицы, воспользовавшись перечнем: ложка, чашка, резина, вода, снежинка, железо, железный гвоздь, стеклянная палочка, алюминиевая проволока, сахар:
Вещества | Тела | Материалы |
6. Дополните предложения записью двух-трех собственных примеров:
а) из полиэтилена изготовлены тела:_______
б) из стекла производят:________________
7. Составьте перечень веществ, названия которых содержатся в тексте параграфа, и перечень лабораторного оборудования, на рис. 20.
8. Подумайте, чего есть больше — тел или веществ. Свой ответ обоснуйте и подтвердите примерами.
9. Расширьте свои знания о тела и вещества. Для этого поинтересуйтесь у взрослых членов вашей семьи, из каких веществ или материалов изготовлены различные предметы ежедневного обихода, инструменты их профессиональной деятельности. О несколько новых примеров, которые станут вам известны, сделайте сообщение в классе.
Самые невероятные химические реакции — Интересное в сети! — LiveJournal
Молекулярный материал в нашей повседневной жизни настолько предсказуем, что мы часто забываем, какие удивительные вещи могут твориться с основными элементами.
Даже внутри нашего тела происходит множество удивительных химических реакций.
Вот несколько увлекательных и впечатляющих химических и физических реакций в форме гифок, которые напомнят вам курс химии.

Химические реакции
1. «Фараонова змея» — распад тиоцианата ртути
Горение тиоцианата ртути приводит к его разложению на три других химических вещества. Эти три химических вещества в свою очередь разлагаются на еще три вещества, что приводит к развертыванию огромной «змеи».
2. Горящая спичка
Спичечная головка содержит красный фосфор, серу и бертолетову соль. Тепло, генерируемое фосфором, разлагает бертолетову соль и в процессе высвобождает кислород. Кислород в сочетании с серой производит кратковременное пламя, которое мы используем, чтобы зажечь, например, свечу.
3. Огонь + водород
Газообразный водород легче воздуха и его можно разжечь пламенем или искрой, что приведет к впечатляющему взрыву. Вот почему сейчас чаще используется гелий, а не водород для наполнения аэростатов.
4. Ртуть + алюминий
Ртуть проникает сквозь защитный слой окиси (ржавчину) алюминия, заставляя его ржаветь намного быстрее.
Примеры химических реакций
5. Змеиный яд + кровь
Одна капля яда гадюки, попавшая в чашку Петри с кровью, заставляет ее свернуться в толстый комок твердого вещества. Именно это происходит в нашем теле, когда нас кусает ядовитая змея.
6. Железо + раствор медного купороса
Железо заменяет медь в растворе, превращая медный купорос в железный купорос. Чистая медь собирается на железе.
7. Воспламенение емкости с газом
8. Хлорная таблетка + медицинский спирт в закрытой бутылке
Реакция приводит к увеличению давления и заканчивается разрывом контейнера.
9. Полимеризация п-нитроанилина
На гифке к половине чайной ложки п-нитроанилина или 4-нитроанилина добавляют несколько капель концентрированной серной кислоты.
10. Кровь в перекиси водорода
Фермент в крови, называемый каталаза, превращает перекись водорода в воду и газообразный кислород, создавая пену кислородных пузырей.
Химические опыты
11. Галлий в горячей воде
Примеры тел и и веществ
Тело, или физическое тело в физике материальный объект, имеющий массу и отделенный от других тел границей раздела. Тело есть форма существования вещества. Физическое тело — это любой предмет, имеющий объем, массу, плотность, температуру, твердость, вязкость, электропроводность и многие другие подобные свойства, называемые физическими. Допустим, этот предмет — кусочек свинца. В физическом эксперименте можно, например, бросать свинцовый предмет с разной высоты, чтобы определить ускорение свободного падения. В другом опыте можно измерить объем этого кусочка и определить плотность свинца. Можно нагреть свинец, чтобы расплавить его и определить температуру плавления. Можно измерить электропроводность свинца. А можно погрузить в воду и измерить выталкивающую силу. Во всех этих опытах будут проявляться разные физические свойства предмета. Но если в первом опыте с бросанием предмета не так уж и важно, из чего он сделан — из свинца, резины или железа, то во всех остальных опытах исследователь получит совершенно разные результаты для свинцового, резинового и железного физического тела. А вообще-то, ученик, можно было, если не учебник открыть — то хотя бы самому инете поискать…
№2 ответ прочти и всё норм))
тело-ложка, вещество-железо
Тела бывают разные, а вещество одно. Например, гвозди, проволка, ведро, кнопка, ножницы — сделаны из железа, точнее из стали. Стакан, банка, окно сделаны из стекла. Может быть одинаковые по форме и величине тела, сделанные из разных веществ, например, кубик пластмассовый и кубик деревянный.
апрлоололрлополворролоаплоопорлопр
вещество-из него состоит тело: тело-мяч, вещество-резина
орДопустим, этот предмет — кусочек свинца. В физическом эксперименте можно, например, бросать свинцовый предмет с разной высоты, чтобы определить ускорение свободного падения. В другом опыте можно измерить объем этого кусочка и определить плотность свинца. Можно нагреть свинец, чтобы расплавить его и определить температуру плавления. Можно измерить электропроводность свинца. А можно погрузить в воду и измерить выталкивающую силу. Во всех этих опытах будут проявляться разные физические свойства предмета. Но если в первом опыте с бросанием предмета не так уж и важно, из чего он сделан — из свинца, резины или железа, то во всех остальных опытах исследователь получит совершенно разные результаты для свинцового, резинового и железного физического тела. А вообще-то, ученик, можно было, если не учебник открыть — то хотя бы самому инете поискать…
Тело: стакан-вещество стекло, тело шкаф-вещество древесина, тело свеча-вещество парафин.
примеры и свойства. Какие бывают жидкие тела
Выделяют три агрегатных состояния веществ: жидкость, вода и газ. Все они различаются по своим свойствам. Особое место в этом списке занимают жидкости. В отличие от твердых тел, в жидкостях молекулы не расположены упорядочено. Жидкость – это особое состояние вещества, являющееся промежуточным между газом и твердым телом. Вещества в этом виде могут существовать только при строгом соблюдении интервалов определенных температур. Ниже этого интервала жидкое тело превратится в твердое, а выше – в газообразное. При этом границы интервала напрямую зависят от давления.

Вода
Одним из основных примеров жидкого тела является вода. Несмотря на принадлежность к данной категории, вода может принимать форму твердого тела или газа – в зависимости от температуры окружающей среды. В процессе перехода из состояния жидкости в твердое, молекулы обычного вещества сжимаются. Но вода ведет себя совершенно иначе. При замерзании ее плотность снижается, и вместо того, чтобы тонуть, лед выплывает на поверхность. Вода в своем обычном, текучем, состоянии обладает всеми свойствами жидкости – у нее всегда имеется конкретный объем, однако, нет определенной формы.
Поэтому вода всегда сохраняет тепло под поверхностью льда. Даже если температура окружающей среды составляет -50°С, то подо льдом она все равно будет составлять около нуля. Однако в начальной школе можно не углубляться в подробности свойств воды или других веществ. В 3 классе примеры жидких тел можно приводить самые простые – и в этот список желательно включить воду. Ведь ученик начальной школы должен иметь общие представления о свойствах окружающего мира. На данном этапе достаточно знать, что вода в ее обычном состоянии является жидкостью.
Натяжение поверхности — свойство воды
Вода обладает большим, чем другие жидкости, показателем натяжения поверхности. Благодаря этому свойству образуются капли дождя, а, следовательно, и поддерживается круговорот воды в природе. Иначе пары воды не могли бы так легко превратиться в капли и пролиться на поверхность земли в виде дождя. Вода, действительно, является примером жидкого тела, от которого напрямую зависит возможность существования живых организмов на нашей планете.
Поверхностное натяжение объясняется тем, что молекулы жидкости притягиваются друг к другу. Каждая из частиц стремится окружить себя другими и уйти с поверхности жидкого тела. Именно поэтому мыльные и образующиеся при кипении воды пузыри стремятся принять жидкую форму – при этом объеме минимальной толщиной поверхности может обладать только шар.

Жидкие металлы
Однако не только привычные для человека вещества, с которым он имеет дело в повседневности, принадлежат к классу жидких тел. Среди этой категории немало различных элементов периодической системы Менделеева. Примером жидкого тела также является ртуть. Это вещество широко применяется в изготовлении электротехнических приборов, металлургии, химической промышленности.
Ртуть является жидким, блестящим металлом, испаряющимся уже при комнатной температуре. Она способна растворять серебро, золото и цинк, образуя при этом амальгамы. Ртуть является примером того, какие бывают жидкие тела, относящиеся к категории опасных для жизни человека. Ее пары токсичны, опасны для здоровья. Поражающее действие ртути проявляется, как правило, через некоторое время после контакта отравления.
Металл под названием цезий также относится к жидкостям. Уже при комнатной температуре он находится в полужидкой форме. Цезий на вид представляет собой вещество золотисто-белого оттенка. Данный металл немного похож на золото по цвету, однако, светлее его.

Серная кислота
Примером того, какие бывают жидкие тела, также являются и практически все неорганические кислоты. К примеру, серная кислота, на вид представляющая собой тяжелую маслянистую жидкость. У нее нет ни цвета, ни запаха. При нагревании она становится очень сильным окислителем. На холоде она не вступает во взаимодействие с металлами – например, железом и алюминием. Данное вещество проявляет свои характеристики только в чистом виде. Разбавленная серная кислота не проявляет окислительных свойств.
Свойства
Какие жидкие тела существуют помимо перечисленных? Это кровь, нефть, молоко, минеральное масло, алкоголь. Их свойства позволяют этим веществам легко принимать форму тары. Как и другие жидкости, эти вещества не теряют своего объема, если перелить их из одного сосуда в другой. Какие же еще свойства присущи каждому из веществ в данном состоянии? Жидкие тела и их свойства хорошо изучены физиками. Рассмотрим их основные характеристики.
Текучесть
Одна из главнейших характеристик любого тела данной категории – это текучесть. Под данным термином понимается способность тела принимать различную форму, даже если не него оказывается относительно слабое воздействие извне. Именно благодаря данному свойству каждая жидкость может разливаться струями, разбрызгиваться по окружающей поверхности каплями. Если бы тела данной категории не обладали текучестью, было бы невозможным налить воду из бутылки в стакан.
При этом данное свойство выражается у разных веществ в различной степени. Например, мед меняет форму очень медленно по сравнению с водой. Данную характеристику называют вязкостью. Это свойство зависит от внутреннего строения жидкого тела. Например, молекулы меда больше похожи на ветви дерева, а молекулы воды, скорее, напоминают шарики с небольшими выпуклостями. При движении жидкости частицы меда будто «цепляются друг за друга» — именно этот процесс и придает ему большую вязкость, нежели другим типам жидкостей.

Сохранение формы
Нужно помнить и о том, что о каком бы примере жидких тел ни шла речь, они меняют только форму, но не меняют объем. Если налить воды в мензурку, и перелить ее в другую емкость, данная характеристика не изменится, хотя и само тело примет форму нового сосуда, в который его только что перелили. Свойство сохранения объема объясняется тем, что между молекулами действуют как силы взаимного притяжения, так и отталкивающие. Нужно отметить, что жидкости практически невозможно сжать посредством внешнего воздействия за счет того, что они всегда принимают форму контейнера.

Жидкие и твердые тела отличаются тем, что последние не подчиняются закону Паскаля. Напомним, что данное правило описывает поведение всех жидкостей и газов, и заключается в их свойстве передавать оказываемое на них давление во все стороны. Однако нужно отметить, что те жидкости, которые обладают меньшей вязкостью, делают это быстрее, чем более вязкие жидкие тела. Например, если оказать давление на воду или спирт, то оно распространится достаточно быстро.

В отличие от этих веществ, давление на мед или жидкое масло будет распространяться медленнее, однако, так же равномерно. В 3 классе примеры жидких тел можно приводить без указания их свойств. Более детальные знания школьникам понадобятся в старших классах. Однако если ученик подготовит дополнительный материал, это может поспособствовать получению более высокой оценки на уроке.
свойства, строение, плотность и примеры
Твердыми называют такие вещества, которые способны образовывать тела и имеют объем. От жидкостей и газов они отличаются своей формой. Твердые вещества сохраняют форму тела благодаря тому, что их частицы не способны свободно перемещаться. Они отличаются по своей плотности, пластичности, электропроводности и цвету. Также у них есть и другие свойства. Так, например, большинство данных веществ плавятся во время нагревания, приобретая жидкое агрегатное состояние. Некоторые из них при подогреве сразу же превращаются в газ (возгоняются). Но есть еще и те, которые разлагаются на иные вещества.
Виды твердых веществ
Все твердые вещества подразделяют на две группы.
- Аморфные, в которых отдельные частицы располагаются хаотично. Другими словами: в них нет четкой (определенной) структуры. Эти твердые вещества способны плавиться в каком-то установленном промежутке температур. К самым распространенным из них можно отнести стекло и смолу.
- Кристаллические, которые, в свою очередь, подразделяются на 4 типа: атомные, молекулярные, ионные, металлические. В них частицы располагаются только по определенной схеме, а именно в узлах кристаллической решетки. Ее геометрия в разных веществах может сильно различаться.
Твердые кристаллические вещества преобладают над аморфными по своей численности.

Типы кристаллических твердых веществ
В твердом состоянии практически все вещества имеют кристаллическую структуру. Они отличаются своим строением. Кристаллические решетки в своих узлах содержат различные частицы и химические элементы. Именно в соответствии с ними они и получили свои названия. У каждого типа имеются характерные для него свойства:
- В атомной кристаллической решетке частицы твердого вещества связаны ковалентной связью. Она отличается своей прочностью. Благодаря этому такие вещества отличаются высокой температурой плавления и кипения. К этому типу относятся кварц и алмаз.
- В молекулярной кристаллической решетке связь между частицами отличается своей слабостью. Вещества такого типа характеризуются легкостью закипания и плавления. Они отличаются летучестью, благодаря которой имеют определенный запах. К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью.
- В ионной кристаллической решетке в узлах чередуются соответствующие частицы, заряженные положительно и отрицательно. Они удерживаются электростатическим притяжением. Данный тип решетки существует в щелочах, солях, основных оксидах. Многие вещества этого вида легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавки. Практически все они не имеют запаха, поскольку для них характерна нелетучесть. Вещества с ионной решеткой неспособны проводить электрический ток, поскольку в их составе нет свободных электронов. Типичный пример ионного твердого вещества – поваренная соль. Такая кристаллическая решетка придает ей хрупкость. Это связано с тем, что любой ее сдвиг может привести к возникновению сил отталкивания ионов.
- В металлической кристаллической решетке в узлах присутствуют только ионы химических веществ, заряженные положительно. Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость.

Общие понятия о твердом теле
Твердые тела и вещества – это практически одно и то же. Этими терминами называют одно из 4 агрегатных состояний. Твердые тела имеют стабильную форму и характер теплового движения атомов. Причем последние совершают малые колебания рядом с положениями равновесия. Раздел науки, занимающийся изучением состава и внутренней структуры, называют физикой твердого тела. Существуют и другие важные области знаний, занимающиеся такими веществами. Изменение формы при внешних воздействиях и движении называют механикой деформируемого тела.
Благодаря различным свойствам твердых веществ они нашли применение в разных технических приспособлениях, созданных человеком. Чаще всего в основе их употребления лежали такие свойства, как твердость, объем, масса, упругость, пластичность, хрупкость. Современная наука позволяет использовать и другие качества твердых веществ, которые можно обнаружить исключительно в лабораторных условиях.
Что такое кристаллы
Кристаллы – это твердые тела с расположенными в определенном порядке частицами. Каждому химическому веществу соответствует своя структура. Его атомы образуют трехмерно-периодическую укладку, называемую кристаллической решеткой. Твердые вещества обладают различной симметрией структуры. Кристаллическое состояние твердого тела считается устойчивым, поскольку имеет минимальное количество потенциальной энергии.
Подавляющее большинство твердых материалов (природных) состоит из огромного числа беспорядочно ориентированных отдельных зерен (кристаллитов). Такие вещества называют поликристаллическими. К ним относят технические сплавы и металлы, а также множество горных пород. Монокристаллическими называют одиночные природные или синтетические кристаллы.
Чаще всего такие твердые тела образуются из состояния жидкой фазы, представленного расплавом или раствором. Иногда их получают и из газообразного состояния. Этот процесс называют кристаллизацией. Благодаря научно-техническому прогрессу процедура выращивания (синтеза) различных веществ получила промышленный масштаб. Большинство кристаллов имеет естественную форму в виде правильных многогранников. Их размеры бывают самыми разными. Так, природный кварц (горный хрусталь) может весить до сотен килограммов, а алмазы – до нескольких грамм.
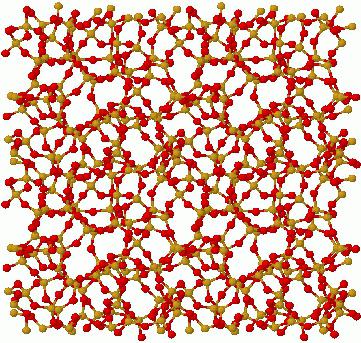
В аморфных твердых телах атомы находятся в постоянном колебании вокруг хаотически находящихся точек. В них сохраняется определенный ближний порядок, но отсутствует дальний. Это обусловлено тем, что их молекулы расположены на расстоянии, которое можно сравнить с их размером. Наиболее часто встречающимся в нашей жизни примером такого твердого вещества является стеклообразное состояние. Аморфные вещества часто рассматриваются как жидкость с бесконечно большой вязкостью. Время их кристаллизации иногда так велико, что и вовсе не проявляется.
Именно вышеперечисленные свойства данных веществ делают их уникальными. Аморфные твердые тела считаются нестабильными, поскольку со временем могут перейти в кристаллическое состояние.
Молекулы и атомы, из которых состоит твердое вещество, упакованы с большой плотностью. Они практически сохраняют свое взаимоположение относительно иных частиц и держатся вместе благодаря межмолекулярному взаимодействию. Расстояние между молекулами твердого вещества в различных направлениях именуют параметром кристаллической решетки. Структура вещества и ее симметричность определяют множество свойств, таких как электронная зона, спайность и оптика. При воздействии на твердое вещество достаточно большой силы эти качества могут быть в той или иной степени нарушены. При этом твердое тело поддается остаточной деформации.
Атомы твердых тел совершают колебательные движения, которыми обусловлено обладание ими тепловой энергией. Поскольку они ничтожно малы, их можно наблюдать только при лабораторных условиях. Молекулярное строение твердого вещества во многом влияет на его свойства.
Изучение твердых веществ
Особенности, свойства данных веществ, их качества и движение частиц изучаются различными подразделами физики твердого тела.
Для исследования используются: радиоспектроскопия, структурный анализ при помощи рентгена и другие методы. Так изучаются механические, физические и тепловые свойства твердых веществ. Твердость, сопротивление нагрузкам, предел прочности, фазовые превращения изучает материаловедение. Оно в значительной степени перекликается с физикой твердых тел. Существует и другая важная современная наука. Исследование существующих и синтезирование новых веществ проводятся химией твердого состояния.
Особенности твердых веществ
Характер движения внешних электронов атомов твердого вещества определяет многие его свойства, например, электрические. Существует 5 классов таких тел. Они установлены в зависимости от типа связи атомов:
- Ионная, основной характеристикой которой является сила электростатического притяжения. Ее особенности: отражение и поглощение света в инфракрасной области. При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
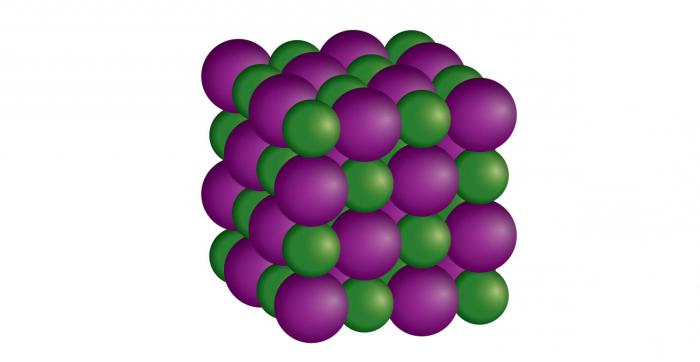
- Ковалентная, осуществляемая за счет электронной пары, которая принадлежит обоим атомам. Такая связь подразделяется на: одинарную (простую), двойную и тройную. Эти названия говорят о наличии пар электронов (1, 2, 3). Двойные и тройные связи называют кратными. Существует еще одно деление этой группы. Так, в зависимости от распределения электронной плотности выделяют полярную и неполярную связь. Первая образуется разными атомами, а вторая – одинаковыми. Такое твердое состояние вещества, примеры которого — алмаз (С) и кремний (Si), отличается своей плотностью. Самые твердые кристаллы относятся именно к ковалентной связи.
- Металлическая, образующаяся путем объединения валентных электронов атомов. В результате чего возникает общее электронное облако, которое смещается под воздействием электрического напряжения. Металлическая связь образуется тогда, когда связываемые атомы большие. Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
- Молекулярная, возникающая в кристаллах, которые образуются отдельными молекулами вещества. Ее характеризуют промежутки между молекулами с нулевой электронной плотностью. Силы, связывающие атомы в таких кристаллах, значительны. При этом молекулы притягиваются друг к другу только слабым межмолекулярным притяжением. Именно поэтому связи между ними легко разрушаются при нагревании. Соединения между атомами разрушаются намного сложнее. Молекулярная связь подразделяется на ориентационную, дисперсионную и индукционную. Примером такого вещества является твердый метан.
- Водородная, которая возникает между положительно поляризованными атомами молекулы или ее части и отрицательно поляризованной наименьшей частицей иной молекулы либо другой части. К таким связям можно отнести лед.

Свойства твердых веществ
Что нам известно на сегодняшний день? Ученые давно изучают свойства твердого состояния вещества. При воздействии на него температур изменяется и оно. Переход такого тела в жидкость называют плавлением. Трансформация твердого вещества в газообразное состояние называется сублимацией. При понижении температуры происходит кристаллизация твердого тела. Некоторые вещества под действием холода переходят в аморфную фазу. Этот процесс ученые называют стеклованием.
При фазовых переходах изменяется внутренняя структура твердых тел. Наибольшую упорядоченность она приобретает при понижении температуры. При атмосферном давлении и температуре Т > 0 К любые вещества, существующие в природе, затвердевают. Только гелий, для кристаллизации которого нужно давление в 24 атм, составляет исключение из этого правила.
Твердое состояние вещества придает ему различные физические свойства. Они характеризуют специфическое поведение тел под воздействием определенных полей и сил. Эти свойства подразделяют на группы. Выделяют 3 способа воздействия, соответствующие 3 видам энергии (механической, термической, электромагнитной). Соответственно им существует 3 группы физических свойств твердых веществ:
- Механические свойства, связанные с напряжением и деформацией тел. По этим критериям твердые вещества делят на упругие, реологические, прочностные и технологические. В покое такое тело сохраняет свою форму, но оно может изменяться под действием внешней силы. При этом его деформация может быть пластической (начальный вид не возвращается), упругой (возвращается в первоначальную форму) или разрушительной (при достижении определенного порога происходит распад/разлом). Отзыв на прилагаемое усилие описывают модулями упругости. Твердое тело сопротивляется не только сжатию, растяжению, но и сдвигам, кручению и изгибам. Прочностью твердого тела называют его свойство сопротивляться разрушению.
- Термические, проявляющиеся при воздействии тепловых полей. Одно из самых важных свойств – температура плавления, при которой тело переходит в жидкое состояние. Оно отмечается у кристаллических твердых веществ. Аморфные тела обладают скрытой теплотой плавления, поскольку их переход в жидкое состояние при повышении температуры происходит постепенно. По достижении определенной теплоты аморфное тело теряет упругость и приобретает пластичность. Это состояние означает достижение им температуры стеклования. При нагревании происходит деформация твердого тела. Причем оно чаще всего расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на такие механические характеристики, как текучесть, пластичность, твердость и прочность.
- Электромагнитные, связанные с воздействием на твердое вещество потоков микрочастиц и электромагнитных волн большой жесткости. К ним условно относят и радиационные свойства.

Зонная структура
Твердые вещества классифицируются и по так называемой зонной структуре. Так, среди них различают:
- Проводники, отличающиеся тем, что зоны их проводимости и валентности перекрываются. При этом электроны могут перемещаться между ними, получая малейшую энергию. К проводникам относятся все металлы. При приложении к такому телу разности потенциалов образуется электрический ток (благодаря свободному передвижению электронов между точками с наименьшим и большим потенциалом).
- Диэлектрики, зоны которых не перекрываются. Интервал между ними превышает 4 эВ. Для проведения электронов из валентной в проводимую зону необходима большая энергия. Благодаря таким свойствам диэлектрики практически не проводят ток.
- Полупроводники, характеризующиеся отсутствием зон проводимости и валентности. Интервал между ними меньше 4 эВ. Для перевода электронов из валентной в проводимую зону необходима энергия меньшая, чем для диэлектриков. Чистые (нелегированные и собственные) полупроводники плохо пропускают ток.
Движения молекул в твердых веществах обуславливают их электромагнитные свойства.
Другие свойства
Твердые тела подразделяются и по своим магнитным свойствам. Есть три группы:
- Диамагнетики, свойства которых мало зависят от температуры или агрегатного состояния.
- Парамагнетики, являющиеся следствием ориентации электронов проводимости и магнитных моментов атомов. Согласно закону Кюри, их восприимчивость убывает пропорционально температуре. Так, при 300 К она составляет 10-5.
- Тела с упорядоченной магнитной структурой, обладающие дальним порядком атомов. В узлах их решетки периодически располагаются частицы с магнитными моментами. Такие твердые тела и вещества часто используются в разных сферах деятельности человека.

Самые твердые вещества в природе
Какие же они? Плотность твердых веществ во многом определяет их твердость. За последние годы ученые открыли несколько материалов, которые претендуют на звание «наиболее прочного тела». Самое твердое вещество – это фуллерит (кристалл с молекулами фуллерена), который примерно в 1,5 раза тверже алмаза. К сожалению, он пока доступен только в крайне малых количествах.
На сегодняшний день самое твердое вещество, которое в дальнейшем, возможно, будет использоваться в промышленности, – лонсдейлит (гексагональный алмаз). Он на 58% тверже бриллианта. Лонсдейлит – аллотропная модификация углерода. Его кристаллическая решетка очень напоминает алмазную. Ячейка лонсдейлита содержит 4 атома, а бриллианта – 8. Из широко используемых кристаллов на сегодня самым твердым остается алмаз.
Ответы@Mail.Ru: приведите пример химического вещества?
Оно может быть любое, хотя бы например моющее средство или серная кислота
соль NaCl. мел CaCO3 сахар С12Н22О11
Пример. При нагревании магния (серебристо-белый металл) в молекулярном кислороде (бесцветный газ) образуется оксид магния (белый порошок) : 2Mg + O2 = 2MgO. Примером реакции разложение меже служить химичесмкая реакция разложения мела (или известняка под воздействием температуры) : СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в расвор медного купороса получаем железный капорос (здесь железо вытеснило медь из её соли) Fe+CuSO4= FeSO4+Cu. Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакцииобмена может служить нейтрализация кислоты щёлочью: NaOH+HCl=NaCl+Н2О. Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего обращзуется раствор поваренной соли в воде Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие раекции, обычно, называют окислительно — восстановительные реакции, папример: 2KMnO4+10NaI+8h3SO4=2MnSO4+K2SO4+5Na2SO4+5I2+8h3O.
А НЕхимических веществ и не бывает! Всё, из чего состоят окружающие нас тела и предметы — это и есть химические вещества
1.Из приведенного перечня выпишите вещества: гвоздь, железо, стакан, линейка, стекло, графит, воронка, крахмал, алюминий, проволока