Урок 11. Химические уравнения – HIMI4KA
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.


До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.


М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.


Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.


Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):




При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*1023), то коэффициенты показывают и химические количества каждого из веществ:


При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:


знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
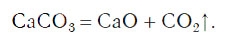
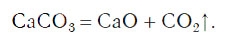
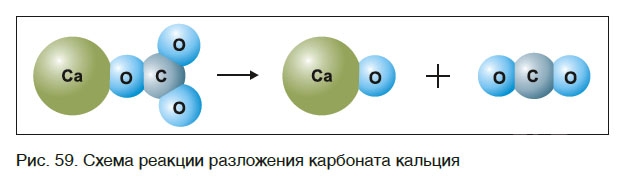

Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
как решать химические уравнения по химии 8 класс объясните пожалуйста
Составление уравнения химической реакции Процесс составления уравнения химической реакции состоит из двух стадий (этапов). 1. Составление схемы реакции. Схема показывает, какие вещества вступили во взаимодействие и какие получились в результате реакции. Надо помнить, что молекулы простых газообразных веществ почти всегда состоят из двух атомов (O2, Cl2, h3 и т. д.) 2. Подбор коэффициентов к формулам веществ. Необходимо подобрать коэффициенты так, чтобы число атомов каждого элемента в левой и правой частях было одинаково. Правила подбора коэффициентов: — если число атомов элемента в одной части схемы реакции четное, а в другой нечетное, то перед формулой с нечетным числом атомов надо поставить коэффициент 2, а затем уравнивать число всех атомов. — расстановку коэффициентов следует начинать с наиболее сложного по составу вещества и делать это в следующей последовательности: сначала надо уравнять число атомов металлов, затем – кислотных остатков (атомов неметаллов), затем атомов водорода, и последним – атомов кислорода. — если число атомов кислорода в левой и правой частях уравнения одинаково, то коэффициенты определены верно. — после этого стрелку между частями уравнения можно заменить знаком равенства. — коэффициенты в уравнении химической реакции не должны иметь общих делителей. Пример. Составим уравнение химической реакции между гидроксидом железа (III) и серной кислотой с образованием сульфата железа (III). 1. Составим схему реакции: Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O 2. Подберем коэффициенты к формулам веществ. Мы знаем, что надо начать с наиболее сложного вещества и последовательно уравнять во всей схеме сначала атомы металлов, потом кислотных остатков, затем водорода и в конце – кислорода. В нашей схеме наиболее сложное вещество — Fe2(SO4)3. В нем два атома железа, а в составе Fe(OH)3 – один атом железа. Значит, перед формулой Fe(OH)3 надо поставить коэффициент 2: 2Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O Теперь уравниваем число кислотных остатков SO4. В составе соли Fe2(SO4)3 – три кислотных остатка SO4. Значит, в левой части перед формулой h3SO4 ставим коэффициент 3: 2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + h3O. Теперь уравниваем число атомов водорода. В левой части схемы в гидроксиде железа 2Fe(OH)3 – 6 атомов водорода (2 · 3), в серной кислоте 3h3SO4 – тоже 6 атомов водорода. Всего в левой части 12 атомов водорода. Значит, в правой части перед формулой воды h3O ставим коэффициент 6 – и теперь в правой части тоже 12 атомов водорода: 2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + 6h3O. Осталось уравнять число атомов кислорода. Но делать это уже не надо, потому что в левой и правой частях схемы уже одинаковое число атомов кислорода – по 18 в каждой части. Это значит, что схема записана полностью, и мы можем стрелку заменить знаком равенства: 2Fe(OH)3 + 3h3SO4 = Fe2(SO4)3 + 6h3O.
1 год назад Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода. Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи. Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу. Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль. Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции: на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды. Отсюда количество вещества воды равно 0,2 моль. Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т. е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
<a href=»/» rel=»nofollow» title=»15907216:##:1OQmRak»>[ссылка заблокирована по решению администрации проекта]</a>
а) N2 + h3 → Nh4 б) Al(OH)3 → Al2O3 + h3O в) Mg + HCl → MgCl2 + h3 г) СaO + HNO3→ Ca(NO3)2 + h3O
touch.otvet.mail.ru
Химические уравнения: как решать максимально эффективно
Химическим уравнением можно назвать визуализацию химической реакции с помощью знаков математики и химических формул. Такое действие является отображением какой-либо реакции, в процессе которой появляются новые вещества.
Химические задания: виды
Химическое уравнение – это последовательность химических реакций. Они основываются на законе сохранения массы каких-либо веществ. Существует всего два вида реакций:
- Соединения – к ним относятся реакции замещения (происходит замена атомов сложных элементов атомами простых реагентов), обмена (замещение составными частями двух сложных веществ), нейтрализации (реакция кислот с основаниями, образование соли и воды).
- Разложения – образование двух и более сложных или простых веществ из одного сложного, но состав их более простой.
Химические реакции также можно разделить на типы: экзотермические (происходят с выделением теплоты) и эндотермические (поглощение теплоты).

Как решать уравнения химических реакций
Этот вопрос волнует многих учащихся. Мы предлегаем несколько простых советов, которые подскажут, как научиться решать химические уравнения:
- Желание понять и освоить. Нельзя отступать от своей цели.
- Теоретические знания. Без них невозможно составить даже элементарную формулу соединения.
- Правильность записи химической задачи – даже малейшая ошибка в условии сведет к нулю все ваши усилия в ее решении.
Желательно, чтобы сам процесс решения химических уравнений был для вас увлекательным. Тогда химические уравнения (как решать их и какие моменты нужно запомнить, мы разберем в этой статье) перестанут быть для вас проблемными.

Задачи, которые решаются с использованием уравнений химических реакций
К таким задачам относятся:
- Нахождение массы компонента по данной массе другого реагента.
- Задания по комбинации «масса-моль».
- Расчеты по комбинации «объем-моль».
- Примеры с применением термина «избыток».
- Расчеты с использованием реагентов, один из которых не лишен примесей.
- Задачи на распад результата реакции и на производственные потери.
- Задачи на поиск формулы.
- Задачи, в которых реагенты предоставлены в виде растворов.
- Задачи, содержащие смеси.
Каждый из этих видов задач включает в себя несколько подтипов, которые обычно подробно рассматриваются еще на первых школьных уроках химии.
Химические уравнения: как решать
Существует алгоритм, который помогает справиться с практически любым заданием из этой непростой науки. Чтобы понять, как правильно решать химические уравнения, нужно придерживаться определенной закономерности:
- При записи уравнения реакции не забывать расставлять коэффициенты.
- Определение способа, с помощью которого можно найти неизвестные данные.
- Правильность применения в выбранной формуле пропорций или использование понятия «количество вещества».
- Обратить внимание на единицы измерений.
В конце важно обязательно проверить задачу. В процессе решения вы могли допустить элементарную ошибку, которая повлияла на результат решения.

Основные правила составления химических уравнений
Если придерживаться правильной последовательности, то вопрос о том, что такое химические уравнения, как решать их, не будет вас волновать:
- Формулы веществ, которые вступают в реакцию (реагенты), записываются в левой части уравнения.
- Формулы веществ, которые образуются в результате реакции, записываются уже в правой части уравнения.
Составление уравнения реакции основывается на законе сохранения массы веществ. Следовательно, обе части уравнения должны быть равны, т. е. с одинаковым числом атомов. Достичь этого можно при условии правильной расстановки коэффициентов перед формулами веществ.
Расстановка коэффициентов в химическом уравнении
Алгоритм расстановки коэффициентов таков:
- Подсчет в левой и правой части уравнения атомов каждого элемента.
- Определение меняющегося количества атомов у элемента. Также нужно найти Н.О.К.
- Получение коэффициентов достигается путем деления Н.О.К. на индексы. Обязательно проставить данные цифры перед формулами.
- Следующим шагом является пересчет количества атомов. Иногда возникает необходимость в повторении действия.
Уравнивание частей химической реакции происходит с помощью коэффициентов. Расчет индексов производится через валентность.

Для успешного составления и решения химических уравнений необходимо учитывать физические свойства вещества, такие как объем, плотность, масса. Также нужно знать состояние реагирующей системы (концентрация, температура, давление), разбираться в единицах измерения данных величин.
Для понимания вопроса о том, что такое химические уравнения, как решать их, необходимо использование основных законов и понятий этой науки. Чтобы успешно вычислять подобные задачи, необходимо также вспомнить или освоить навыки математических операций, уметь совершать действия с числами. Надеемся, с нашими советами вам будет легче справляться с химическими уравнениями.
fb.ru