Химическое уравнение — Википедия
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций — условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
История
Титульный лист Tyrocinium ChymicumВ начале не было представления о химических уравнениях, ещё не были известны основные химические законы, но уже в алхимический период развития химии начали обозначать химические элементы символами.
С дальнейшим развитием химии менялись представления о символике химических элементов,ской записи, используя химические формулы. Первым предложил использовать химические уравнения Жан Бегун (Jean Beguin) в 1615 году в одном из первых учебников по химии
Конец XVIII—начало XIX вв. — становление законов стехиометрии. У истоков этих исследований стоял немецкий ученый И. В. Рихтер. В студенческие годы на него большое впечатление произвели слова его учителя — философа И. Канта о том, что в отдельных направлениях естественных наук истинной науки столько, сколько в ней математики. Рихтер посвятил свою диссертацию использованию математики в химии. Не будучи в сущности химиком, Рихтер ввел первые количественные уравнения химических реакций, стал использовать термин стехиометрия.
Правила составления
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила[1]. В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы(формулу) образовавшихся веществ, также соединенных знаком «плюс». Между частями уравнения ставят знак равенства или стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Для обозначения различных типов реакций используются следующие символы:
Закон сохранения массы гласит, что количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции. Таким образом, левая и правая части химического уравнения должны иметь одинаковое количество атомов того или иного элемента. Химическое уравнение должно быть электронейтрально, то есть сумма зарядов в левой и правой части уравнения должна равняться нулю.
Как правило, химические уравнения записываются с наименьшими целочисленными коэффициентами. В случае, если перед химической формулой нет коэффициента, подразумевается что он равен единице. Проверка материального баланса, то есть количества атомов с левой и правой части, может быть следующей: перед самой сложной химической формулой ставится коэффициент 1. Далее расставляются коэффициенты перед формулами таким образом, что бы количество атомов каждого из элементов в левой и правой части уравнения было равно. Если один из коэффициентов — дробный, то следует умножить все коэффициенты на число стоящее в знаменателе дробного коэффициента. Если перед формулой коэффициент 1, то его опускают.
Одним из способов уравнивания количества атомов в химическом уравнении является подбор коэффициентов.
Расстановка коэффициентов в химической реакции горения метана:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + H2O
Количество атомов углерода с левой и правой сторон одинаково. Следующий элемент, который следует уравнять — водород. Слева 4 атома водорода, справа 2, чтобы уравнять количество атомов водорода следует поставить коэффициент 2 перед водой, в результате:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + 2H2O
Проверка правильности расстановки коэффициентов в любом химическом уравнении производится подсчетом количества атомов кислорода, если в левой и правой части количество атомов кислорода одинаково, значит коэффициенты расставлены правильно.
- 1CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Перед молекулами CH4 и CO2 коэффициент 1 опускают.
- CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Для более сложных случаев применяются математический метод уравнивания реакций с помощью составления системы линейных алгебраических уравнений и метод Гарсиа (аналог математического метода Гаусса).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
Запись ионных уравнений
Ионные уравнения — это химические уравнения, в которых электролиты записаны в виде диссоциировавших ионов. Ионные уравнения используются для записи реакций замещения и реакций обмена в водных растворах. Пример, реакция обмена, взаимодействие хлорида кальция и нитрата серебра с образованием осадка хлорида серебра:
- CaCl2(ж) + 2AgNO3(ж) →{\displaystyle \rightarrow } Ca(NO3)2(ж) + 2AgCl(тв)
полное ионное уравнение:
- Ca2+ + 2Cl− + 2Ag+ + 2NO3−→{\displaystyle \rightarrow } Ca2+ + 2NO3− + 2AgCl(тв)
М. Язык химиков // Химия и жизнь. — 2000. -№ 1. — С.50-52.
- Кудрявцев А. А. Составление химических уравнений — 4-е издание, перераб. и доп., 1968—359 с.
- Берг Л. Г. Громаков С. Д. Зороацкая И. В. Аверко-Антонович И. Н. Способы подбора коэффициентов в химических уравнениях — Казань: изд-во Казанского ун-та, 1959.- 148 с.
- Леенсон И. А. Чет или нечет — М.: Химия, 1987. — 176 с.
См. также
Примечания
- ↑ Химические уравнения / Габриелян О. С. Химия. 8 класс. — М. Дрофа, 2013. — 288 с. (С. 160)
Ссылки
wikipedia.green
Химическое уравнение — Википедия
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций — условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
История
Титульный лист Tyrocinium Chymicum В начале не было представления о химических уравнениях, ещё не были известны основные химические законы, но уже в алхимический период развития химии начали обозначать химические элементы символами.С дальнейшим развитием химии менялись представления о символике химических элементов,ской записи, используя химические формулы. Первым предложил использовать химические уравнения Жан Бегун (Jean Beguin) в 1615 году в одном из первых учебников по химии Tyrocinium Chymicum («Начала химии»).
Конец XVIII—начало XIX вв. — становление законов стехиометрии. У истоков этих исследований стоял немецкий ученый И. В. Рихтер. В студенческие годы на него большое впечатление произвели слова его учителя — философа И. Канта о том, что в отдельных направлениях естественных наук истинной науки столько, сколько в ней математики. Рихтер посвятил свою диссертацию использованию математики в химии. Не будучи в сущности химиком, Рихтер ввел первые количественные уравнения химических реакций, стал использовать термин
Правила составления
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила[1]. В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы(формулу) образовавшихся веществ, также соединенных знаком «плюс». Между частями уравнения ставят знак равенства или стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Для обозначения различных типов реакций используются следующие символы:
Закон сохранения массы гласит, что количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции. Таким образом, левая и правая части химического уравнения должны иметь одинаковое количество атомов того или иного элемента. Химическое уравнение должно быть электронейтрально, то есть сумма зарядов в левой и правой части уравнения должна равняться нулю.
Как правило, химические уравнения записываются с наименьшими целочисленными коэффициентами. В случае, если перед химической формулой нет коэффициента, подразумевается что он равен единице. Проверка материального баланса, то есть количества атомов с левой и правой части, может быть следующей: перед самой сложной химической формулой ставится коэффициент 1. Далее расставляются коэффициенты перед формулами таким образом, что бы количество атомов каждого из элементов в левой и правой части уравнения было равно. Если один из коэффициентов — дробный, то следует умножить все коэффициенты на число стоящее в знаменателе дробного коэффициента. Если перед формулой коэффициент 1, то его опускают.
Одним из способов уравнивания количества атомов в химическом уравнении является подбор коэффициентов.
Расстановка коэффициентов в химической реакции горения метана:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + H2O
Количество атомов углерода с левой и правой сторон одинаково. Следующий элемент, который следует уравнять — водород. Слева 4 атома водорода, справа 2, чтобы уравнять количество атомов водорода следует поставить коэффициент 2 перед водой, в результате:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + 2H2O
Проверка правильности расстановки коэффициентов в любом химическом уравнении производится подсчетом количества атомов кислорода, если в левой и правой части количество атомов кислорода одинаково, значит коэффициенты расставлены правильно.
- 1CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Перед молекулами CH4 и CO2 коэффициент 1 опускают.
- CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Для более сложных случаев применяются математический метод уравнивания реакций с помощью составления системы линейных алгебраических уравнений и метод Гарсиа (аналог математического метода Гаусса).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
Запись ионных уравнений
Ионные уравнения — это химические уравнения, в которых электролиты записаны в виде диссоциировавших ионов. Ионные уравнения используются для записи реакций замещения и реакций обмена в водных растворах. Пример, реакция обмена, взаимодействие хлорида кальция и нитрата серебра с образованием осадка хлорида серебра:
- CaCl2(ж) + 2AgNO3(ж) →{\displaystyle \rightarrow } Ca(NO3)2(ж) + 2AgCl(тв)
полное ионное уравнение:
- Ca2+ + 2Cl− + 2Ag+ + 2NO3−→{\displaystyle \rightarrow } Ca2+ + 2NO3− + 2AgCl(тв)
М. Язык химиков // Химия и жизнь. — 2000. -№ 1. — С.50-52.
- Кудрявцев А. А. Составление химических уравнений — 4-е издание, перераб. и доп., 1968—359 с.
- Берг Л. Г. Громаков С. Д. Зороацкая И. В. Аверко-Антонович И. Н. Способы подбора коэффициентов в химических уравнениях — Казань: изд-во Казанского ун-та, 1959.- 148 с.
- Леенсон И. А. Чет или нечет — М.: Химия, 1987. — 176 с.
См. также
Примечания
- ↑ Химические уравнения / Габриелян О. С. Химия. 8 класс. — М. Дрофа, 2013. — 288 с. (С. 160)
Ссылки
wikipedia.bio
Химическое уравнение — Википедия. Что такое Химическое уравнение
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций — условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
История
 Титульный лист Tyrocinium Chymicum
Титульный лист Tyrocinium ChymicumВ начале не было представления о химических уравнениях, ещё не были известны основные химические законы, но уже в алхимический период развития химии начали обозначать химические элементы символами.
С дальнейшим развитием химии менялись представления о символике химических элементов,ской записи, используя химические формулы. Первым предложил использовать химические уравнения Жан Бегун (Jean Beguin) в 1615 году в одном из первых учебников по химии Tyrocinium Chymicum («Начала химии»).
Конец XVIII—начало XIX вв. — становление законов стехиометрии. У истоков этих исследований стоял немецкий ученый И. В. Рихтер. В студенческие годы на него большое впечатление произвели слова его учителя — философа И. Канта о том, что в отдельных направлениях естественных наук истинной науки столько, сколько в ней математики. Рихтер посвятил свою диссертацию использованию математики в химии. Не будучи в сущности химиком, Рихтер ввел первые количественные уравнения химических реакций, стал использовать термин стехиометрия.
Правила составления
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила[1]. В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы(формулу) образовавшихся веществ, также соединенных знаком «плюс». Между частями уравнения ставят знак равенства или стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Для обозначения различных типов реакций используются следующие символы:
Закон сохранения массы гласит, что количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции. Таким образом, левая и правая части химического уравнения должны иметь одинаковое количество атомов того или иного элемента. Химическое уравнение должно быть электронейтрально, то есть сумма зарядов в левой и правой части уравнения должна равняться нулю.
Как правило, химические уравнения записываются с наименьшими целочисленными коэффициентами. В случае, если перед химической формулой нет коэффициента, подразумевается что он равен единице. Проверка материального баланса, то есть количества атомов с левой и правой части, может быть следующей: перед самой сложной химической формулой ставится коэффициент 1. Далее расставляются коэффициенты перед формулами таким образом, что бы количество атомов каждого из элементов в левой и правой части уравнения было равно. Если один из коэффициентов — дробный, то следует умножить все коэффициенты на число стоящее в знаменателе дробного коэффициента. Если перед формулой коэффициент 1, то его опускают.
Одним из способов уравнивания количества атомов в химическом уравнении является подбор коэффициентов.
Расстановка коэффициентов в химической реакции горения метана:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + H2O
Количество атомов углерода с левой и правой сторон одинаково. Следующий элемент, который следует уравнять — водород. Слева 4 атома водорода, справа 2, чтобы уравнять количество атомов водорода следует поставить коэффициент 2 перед водой, в результате:
- 1CH4 + O2→{\displaystyle \rightarrow } CO2 + 2H2O
Проверка правильности расстановки коэффициентов в любом химическом уравнении производится подсчетом количества атомов кислорода, если в левой и правой части количество атомов кислорода одинаково, значит коэффициенты расставлены правильно.
- 1CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Перед молекулами CH4 и CO2 коэффициент 1 опускают.
- CH4 + 2O2→{\displaystyle \rightarrow } CO2 + 2H2O
Для более сложных случаев применяются математический метод уравнивания реакций с помощью составления системы линейных алгебраических уравнений и метод Гарсиа (аналог математического метода Гаусса).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
Запись ионных уравнений
Ионные уравнения — это химические уравнения, в которых электролиты записаны в виде диссоциировавших ионов. Ионные уравнения используются для записи реакций замещения и реакций обмена в водных растворах. Пример, реакция обмена, взаимодействие хлорида кальция и нитрата серебра с образованием осадка хлорида серебра:
- CaCl2(ж) + 2AgNO3(ж) →{\displaystyle \rightarrow } Ca(NO3)2(ж) + 2AgCl(тв)
полное ионное уравнение:
- Ca2+ + 2Cl− + 2Ag+ + 2NO3−→{\displaystyle \rightarrow } Ca2+ + 2NO3− + 2AgCl(тв)
М. Язык химиков // Химия и жизнь. — 2000. -№ 1. — С.50-52.
- Кудрявцев А. А. Составление химических уравнений — 4-е издание, перераб. и доп., 1968—359 с.
- Берг Л. Г. Громаков С. Д. Зороацкая И. В. Аверко-Антонович И. Н. Способы подбора коэффициентов в химических уравнениях — Казань: изд-во Казанского ун-та, 1959.- 148 с.
- Леенсон И. А. Чет или нечет — М.: Химия, 1987. — 176 с.
См. также
Примечания
- ↑ Химические уравнения / Габриелян О. С. Химия. 8 класс. — М. Дрофа, 2013. — 288 с. (С. 160)
Ссылки
wiki.sc
ХИМИЧЕСКОЕ УРАВНЕНИЕ | Энциклопедия Кругосвет
Содержание статьиХИМИЧЕСКОЕ УРАВНЕНИЕ, краткий способ описания химической реакции. Символы, обозначающие вступающие в реакцию вещества, находятся в левой части уравнения, а обозначения продуктов реакции – в правой:

где в скобках указано агрегатное состояние, Q – тепловой эффект реакции. Это уравнение описывает химическую реакцию между натрием и хлором с образованием хлорида натрия (поваренная соль). Натрий – металл, бурно реагирующий с водой, хлор – ядовитый газ, но, соединяясь друг с другом, эти элементы образуют вполне безвредное вещество, необходимое для жизни. Это пример реакций присоединения. Известны также химические реакции замещения, обмена, разложения и пр.; реакции могут быть обратимые, ионные, окислительно-восстановительные, ядерные и др. в зависимости от принципа классификации реакций: по формальному признаку, по механизму реакций, по термодинамическим или кинетическим параметрам и т.д. См. также ПРЕВРАЩЕНИЯ ВЕЩЕСТВ.
Реакции присоединения
X + Y → XY
Примеры:
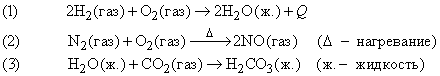
Число атомов данного элемента в левой части уравнения равно числу этих атомов в правой части, другими словами, вещество в ходе химической реакции не возникает из ничего и не уничтожается. Химическая реакция, в которой выделяется тепло, например реакция (1), называется экзотермической, а реакция, которая протекает только при подводе тепла извне, например реакция (2), – эндотермической. Почти все химические реакции сопровождаются выделением или поглощением тепла, но в уравнениях это часто не указывают, если только не рассматриваются термодинамические аспекты процесса.
Реакции замещения
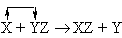
или
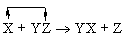
Примеры:
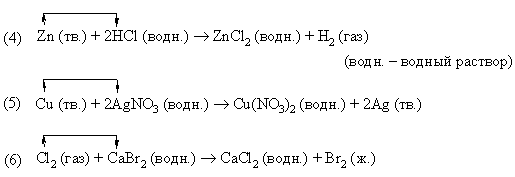
В реакции (4) металлический цинк замещает водород в соляной кислоте. В реакции (5) медь замещает серебро в нитрате серебра. В реакции (6) хлор замещает бром в бромиде кальция.
Реакции обмена (двойного замещения) XY + UV → XV + UY
Примеры:
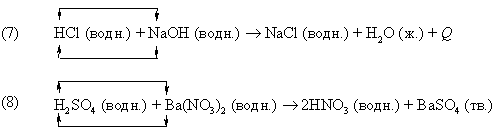
Реакция (7) – типичный пример кислотно-основной реакции (реакции нейтрализации), продуктами которой являются соль и вода. В реакции (8) в результате взаимодействия иона бария Ba2+, принадлежащего нитрату бария Ba(NO3)2, c сульфат-ионом 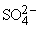 серной кислоты образуется осадок сульфата бария BaSO4. В реакциях (7) и (8) реагирующие вещества обмениваются катионами.
серной кислоты образуется осадок сульфата бария BaSO4. В реакциях (7) и (8) реагирующие вещества обмениваются катионами.
Реакции разложения (расщепления) 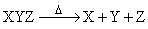
Примеры
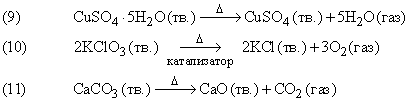
В реакции (9) синие кристаллы гидратированного сульфата меди разлагаются при нагревании, при этом гидратная вода превращается в пар. Реакция (10) протекает при относительно невысокой температуре в присутствии катализатора – диоксида марганца. Катализатор ускоряет химическую реакцию, оставаясь при этом неизменным (см. также КАТАЛИЗ). Реакция (11) применяется в промышленности: известняк (карбонат кальция CaCO3) при интенсивном нагревании разлагается, образуя негашеную известь (оксид кальция CaO) – важную составную часть цемента.
Обратимые реакции
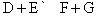 или
или 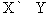
Стрелки в прямом и обратном направлениях указывают, что продукты реакции взаимодействуют с образованием исходных реагентов, другими словами, реакция идет в обоих направлениях. Систему, в которой протекает обратимая реакция, можно уподобить двум водоемам, соединенным узкой протокой, в которых обитают два или несколько видов рыб. Рыбы беспрепятственно переплывают из одного водоема в другой, так что в конце концов каждый водоем оказывается заселенным смешанной популяцией постоянного состава. Это и есть состояние равновесия.
Примеры:
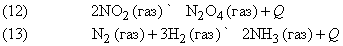
Количества исходных веществ и продуктов реакции сильно зависят от давления, температуры и концентрации реагирующих веществ.
Ионные реакции.
Химические уравнения можно записывать с указанием заряда исходных веществ и продуктов реакции (+, –, 0 означают положительный, отрицательный и нулевой электрические заряды соответственно; их помещают вверху справа от символа химического элемента). Члены уравнения в правой и левой его частях, отвечающие группам атомов одинакового состава, несущих одинаковый заряд, можно сокращать, как это принято в алгебраических уравнениях:
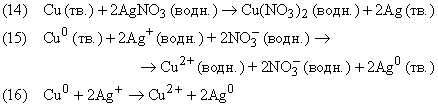
Ион серебра Ag+ несет один положительный заряд; следовательно, на каждый атом меди, образующий двухзарядный положительный ион, должно приходиться два иона серебра, поскольку суммы зарядов в левой и правой частях уравнений должны быть одинаковы. После сокращения одинаковых членов в обеих частях уравнения получаем уравнение (16), которое выражает химические превращения, произошедшие в реакции. Приведенные выше уравнения – это три разных способа представления одной и той же химической реакции: ее молекулярная форма, полная и сокращенная ионные формы.
Ядерные реакции.
Ядерные реакции можно отнести к химическим лишь весьма условно, поскольку в них элемент превращается в изотоп того же элемента или другой элемент. Иногда какая-то часть вещества в ядерной реакции исчезает, и этот процесс сопровождается высвобождением огромного количества энергии; такие процессы происходят при взрыве атомной бомбы или в ядерном реакторе. Обычно в уравнениях ядерных реакций фигурируют нейтроны (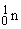 ), протоны (
), протоны (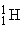 ), электроны (
), электроны (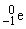 ), a-частицы (
), a-частицы (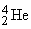 ), g-лучи (
), g-лучи (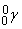 ) и позитроны (
) и позитроны (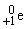 ). Верхний левый индекс обозначает массу частицы, а нижний левый – ее заряд. Приведем уравнения типичных ядерных реакций:
). Верхний левый индекс обозначает массу частицы, а нижний левый – ее заряд. Приведем уравнения типичных ядерных реакций:
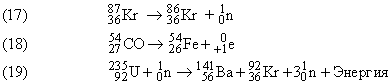
Суммы верхних индексов в левой и правой частях уравнения должны быть одинаковыми; то же самое относится к нижним индексам. Может показаться, что масса вещества в ходе ядерных реакций (17)–(19) не изменяется. В действительности же вследствие взаимодействия элементарных частиц в ядре и изменения их массы покоя у продуктов масса может оказаться чуть меньше, чем у исходных веществ. Именно с исчезновением этого незначительного количества вещества, которое превращается в энергию согласно уравнению Эйнштейна Е = mc2, и связана разрушительная сила ядерного взрыва. Протекающая при этом реакция описывается уравнением (19). В уравнении (17) 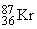 (криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
(криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
Окислительно-восстановительные реакции.
В ходе окислительно-восстановительной реакции меняется заряд элементов (их степень окисления), что и учитывается при написании уравнения. Потеря электрона называется окислением, а приобретение – восстановлением. Число отданных и приобретенных в ходе реакции электронов должно быть одинаковым, и исходя из этого устанавливаются соотношения между всеми участниками реакции. Рассмотрим реакцию
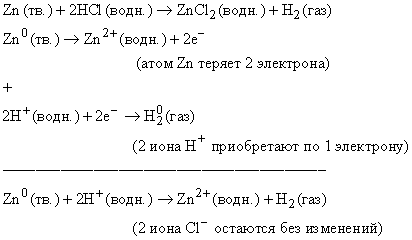
Приведем более сложный пример – окислительно-восстановительную реакцию между медью и концентрированной азотной кислотой:
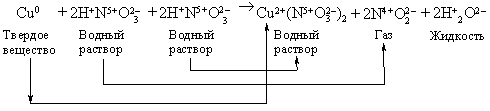
В ходе этой реакции Сu0 теряет 2 электрона, превращаясь в ион Сu2+, а N5+ принимает 1 электрон, превращаясь в N4+. Чтобы уравнять число отданных электронов с числом приобретенных, вводим коэффициент 2 перед NO2 в правой части, а чтобы число атомов азота при этом осталось прежним, умножаем HNO3 в левой части на 2. Cu(NO3)2 в правой части содержит два иона 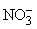 , степень окисления N в которых равна +5. Чтобы сохранить число ионов в левой части с той же степенью окисления, добавляем в левой части 2 молекулы HNO3. Далее, чтобы уравнять 4H+, содержащихся в молекулах HNO3, записываем в правой части 2H2O. В левой части имеем 3Ч4 = 12 ионов кислорода, содержащихся в кислоте. Эти 12 ионов кислорода присутствуют и в правой части: 2 в воде, 4 в NO2 и 6 в нитрате меди Cu(NO3)2. Аналогичным образом можно записывать любые, более сложные уравнения.
, степень окисления N в которых равна +5. Чтобы сохранить число ионов в левой части с той же степенью окисления, добавляем в левой части 2 молекулы HNO3. Далее, чтобы уравнять 4H+, содержащихся в молекулах HNO3, записываем в правой части 2H2O. В левой части имеем 3Ч4 = 12 ионов кислорода, содержащихся в кислоте. Эти 12 ионов кислорода присутствуют и в правой части: 2 в воде, 4 в NO2 и 6 в нитрате меди Cu(NO3)2. Аналогичным образом можно записывать любые, более сложные уравнения.
Применение.
Химические уравнения используются химиками-технологами при расчете характеристик производственных процессов. Так, с их помощью определяется количество реагентов (сырья), необходимое для получения данного количества продукта. См. также ХИМИЯ.
www.krugosvet.ru