Повторение. Генетическая связь классов неорганических соединений
Тема этого урока — «Повторение. Генетическая связь классов неорганических соединений». Вы повторите, как делятся все неорганические вещества, сделаете вывод, как из одного класса неорганических соединений можно получить другой. На основании полученных сведений узнаете, что такое генетическая связь таких классов, два основных пути таких связей.
Тема: Введение
Урок: Повторение. Генетическая связь классов неорганических соединений
Химия – это наука о веществах, их свойствах и превращениях друг в друга.

Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
— Сложные вещества.
Простые вещества делятся на:
— Металлы
— Неметаллы
Сложные вещества можно разделить на:
— Оксиды
— Основания
— Кислоты
— Соли. См. Рис.1.
Оксиды – это бинарные соединения, состоящее из двух элементов, одним их которых является кислород в степени окисления -2. Рис.2.
Например, оксид кальция: Сa+2О-2,оксид фосфора (V) P2O5., оксид азота (IV) –«лисий хвост»

Рис. 2. Оксиды
Оксиды делятся на:
— Основные
— КислотныеОсновным оксидам соответствуют основания.
Кислотным оксидам соответствуют кислоты.
Соли состоят из катионов металла и анионов кислотного остатка.

Рис. 3. Пути генетических связей между веществами
Таким образом: из одного класса неорганических соединений можно получить другой класс.
Следовательно, все классы неорганических веществ взаимосвязаны.
Связь классов неорганических соединений часто называют генетической. Рис.3.
Генезис по — гречески означает «происхождение». Т.е. генетическая связь показывает взаимосвязь превращения веществ и их происхождение от единого вещества.
Существует два основных пути генетических связей между веществами. Один из них начинается металлом, другой — неметаллом.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль →Основание → Новая соль.
Генетический ряд неметалла отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота →Соль.
Для любого генетического ряда можно написать уравнения реакций, которые показывают превращения одних веществ в другие.
— Для начала, нужно определить к какому классу неорганических соединений относится каждое вещество генетического ряда.
— Подумать, как из веществ
interneturok.ru
Соли и комплексные соединения. Генетическая связь между основными классами неорганических соединений
В ходе урока вы сможете изучить тему «Соли и комплексные соединения». Вы узнаете о химических свойствах солей и методах их получения. Узнаете, какие соли встречаются в природе. Познакомитесь с комплексными соединениями и их строением.
Тема: Основные классы соединений, их свойства и типичные реакции
Урок: Соли и комплексные соединения. Генетическая связь между основными классами неорганических соединений
Соли – это электролиты, в результате диссоциации их водных растворов образуются катионы металлов и анионы кислотных остатков.
Классификация солей
Соли бывают:
· Средние
· Кислые
· Основные
· Двойные
· Смешанные
Соли в природе
Очень многие соли, используемые химиками, встречаются в природе.
Природные соли можно классифицировать следующим образом. Табл. 1.
Минеральные соли
|
Бинарные соединения |
Сульфиды, галогениды |
|
Соли с анионом, содержащим неметалл (металлоид) |
Карбонаты, сульфаты, фосфаты, нитраты, бораты, арсенаты, силикаты, алюмосиликаты. |
|
Соли с анионом, содержащим металл |
Хроматы, вольфраматы, молибдаты, ванадаты. |
В обычных условиях все соли – это твердые бесцветные вещества. Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет. Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые. Рис. 1.
Растворимость солей может быть различной. Хорошо растворимы нитраты, почти все соли щелочных металлов и аммония.

Рис. 1
1. Взаимодействие с металлами
Более активные восстановители вытесняют менее активные из раствора их солей. Активность метала можно определить в электрохимическом ряду напряжения металлов.
Zn+ СuCl2 = ZnCl2+ Сu
Zn0 + Сu2+ = Zn2+ + Сu0
Однако щелочные и щелочноземельные металлы реагируют с растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом образуется щелочь и выделяется водород.
2K + 2H2O =2KOH + H2↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
interneturok.ru
Генетическая связь неорганических веществ
Цель:
- Сформировать понятие о генетической связи и генетическом ряде.
- Рассмотреть генетические ряды металлов и неметаллов.
- Выяснить генетическую связь между классами неорганических соединений.
- Продолжить формировать умения пользоваться таблицей растворимости и периодической системой Д.И.Меделеева для прогнозирования возможных химических реакций, а также применять полученные знания по темам свойства классов веществ.
- Повторить основные классы неорганических соединений и их классификацию.
- Развивать познавательный интерес к предмету, умение быстро и четко отвечать на вопросы.
- Продолжать формировать умения логически мыслить, работать с учебником, работать с полученной информацией.
- Закрепить и систематизировать знания по данной теме.
Оборудование: Периодическая система Д.И. Менделеева, кодоскоп, таблица “Кислоты”, схема “Генетическая связь”, карточки для игры “Конвейер”, “Творческое задание”.
Реактивы: В штативах 3 пробирки с растворами HCI, NaCI, NaOH, универсальная индикаторная бумажка. На столе учителя: Na, H2O кристаллизаторе, фенолфталеин, H2SO4.
Класс разбит на 4 микрогруппы: “Оксиды”, “Кислоты”, “Соли”, “Основания”.
Ход урока
I. Организационный момент.
1. Дисциплина.
2. Готовность класса к уроку.
3. Постановка цели урока, мотивация.
II. Основная часть.
1. Целевая установка урока
Другого ничего в природе нет
Ни здесь, ни там в космических глубинах.
Все – от песчинок малых – до планет
Из элементов состоит единых.Как формула, как график трудовой,
Строй менделеевской системы строгой,
Вокруг тебя творится мир живой,
Входи в него руками трогай.
Сегодня мы собрались здесь, чтобы подвергнуть испытанию лучших восьмиклассников нашей школы и ответить на вопрос: “Достойны ли они, стать гражданами великой химической страны?” Страна эта древняя и волшебная, хранящая множество загадок. Отгадать многие из них еще не удавалось ни одному человеку. Лишь самым, умным, смелым и настойчивым эта страна приоткрывает свои тайны. Итак, начнем!
Итак, изучив тему “Важнейшие классы неорганических соединений” вы получили представление о том, что неорганические соединения многообразны и взаимосвязаны. На уроке мы с вами рассмотрим небольшие фрагменты взаимопревращений веществ, вспомним классификацию неорганических веществ, поговорим о единстве и многообразии химических веществ.
Задача нашего урока – обобщить сведения о веществах, об отдельных классах неорганических соединений и их классификации в целом, закрепить знания о генетических рядах, генетической связи, взаимодействии вещества разных классов, научиться умению применять знания на практике.
Запишите в тетрадях тему нашего урока “Генетическая связь между неорганическими соединениями”.
Но, сначала скажите о каких веществах идет речь (название, формула)?
- На суку сидит сова,
Выдыхает _____________________________
Пропускают ___________________________- Его все знают,
В магазине покупают,
Без него не сваришь ужин —
В малых дозах в блюдах нужен ___________ - Флакон с веществом, обычно имеется в каждой квартире,
С рожденья ребенок любой с ним знаком,
Едва лишь покинет он с мамой роддом,
Ею искупают в ванночке с _________ - Что за чудо посмотри,
По доске он проезжает,
За собой след оставляет. ____________________ - Если нет у вас для теста разрыхлителя
вы вместо него.
Положите в пироги. ________________________
Переведите с химического языка на
- Не все то аурум, что блестит.
_____________________________________________________________ - Куй феррум, пока горячо.
_____________________________________________________________ - Слово – аргентум, а молчание – аурум.
_____________________________________________________________ - 5.Купрумного гроша не стоит.
_____________________________________________________________ - Стойкий станумный солдатик.
_____________________________________________________________ - С тех пор много Н2О утекло.
_____________________________________________________________
Все эти вещества относятся, к какому то классу неорганических веществ. Ответьте на вопрос:
– Как распределяются по классам на основе состава и свойств неорганические
вещества?
– Назовите известные вам классы неорганических соединений
По микрогруппам:
– Дайте определения.
Ученики дают определения веществам.
– Классификация данных классов веществ.
Ученики дают ответы.
На слайде:
Из предложенного перечня неорганических соединений выберите формулы:
1 группа – оксиды,
2 группа – кислоты,
3 группа – соли.
4 группа – основания.
Назовите эти вещества.
Ученики выполняют задание в тетрадях по микрогруппам.
Правильный ответ:
А теперь поиграем с вами в игру “крестики – нолики”.
Слайд 19. Приложения 1.
Распределите вещества, формулы которых приведены в таблице по классам. Из букв, соответствующим правильным ответам, получите фамилию великого русского ученого
| Формулы | Оксиды | Кислоты | Основания | Соли |
| K2O | М | А | Ш | А |
| H2CO3 | П | Е | Т | Р |
| P2O5 | Н | И | М | А |
| CuSO4 | П | О | С | Д |
| Ca(OH)2 | Л | И | Е | С |
| Fe(NO3)3 | А | Н | У | Л |
| SO2 | Е | Л | З | А |
| H3PO4 | Н | Е | Л | С |
| Na3PO4 | Ч | У | М | В |
Ответ: Менделеев.
Проблемное задание.
Могут ли разные классы неорганических соединений взаимодействовать друг с другом?
Выделить признаки генетического ряда:
Ca Ca(OH)2 CaCO3 CaO CaSO4 CaCl2 Ca ?
Ответы:
- вещества разных классов;
- разные вещества образованы одним химическим элементом;
- разные вещества одного химического элемента связаны взаимопревращениями.
Между классами существует важная связь, которую называют генетической («генезиз» по-гречески обозначает «происхождение»). Эта связь заключается в том, что из веществ одного класса можно получить вещества других классов.
Генетическим называют ряд веществ – представителей разных классов неорганических соединений, являющихся соединениями одного и того же химического элемента, связанного взаимопревращениями и отражающего общность происхождения этих веществ.
Генетический ряд отражает взаимосвязь веществ разных классов, в основу которых положен один и тот же химический элемент.
Генетическая связь – связь между веществами разных классов, образованных одним химическим элементом, связанных взаимопревращениями и отражающая единство их происхождения.
Существует два основных пути генетических связей между веществами: один из
них начинается металлами, другой – неметаллами.
Среди металлов также можно выделить две разновидности рядов:
1
. Генетический ряд, в котором в качестве основания выступает щелочь. Этот ряд можно представить с помощью следующих превращений:металл—основный оксид—щелочь–соль
Например: K—K2O—KOH—KCl.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл—основный оксид—соль—нерастворимое основание—основный оксид—металл.
Например: Cu—CuO—CuCl2—Cu(OH)2—CuO—>Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота.
Цепочку превращений можно представить в следующем виде:
неметалл—кислотный оксид—растворимая кислота—соль.
Например:
P—P2O5—H3PO4—Na3PO4.
2. Генетический ряд неметаллов, где в качестве звена ряда
выступает нерастворимая кислота:
неметалл—кислотный оксид—соль—кислота—кислотный оксид–неметалл
Например: Si—SiO2—Na2SiO3—H2SiO3—SiO2—Si.
Осуществить превращения по микрогруппам.
Слайд 27.
Физкультминутка “Рыжий кот”.
Решение задачи.
Слайд 29.
Задача.
Однажды Юх проводил эксперименты по измерению электропроводности растворов разных солей. На его лабораторном столе стояли химические стаканы с растворами KCl, BaCl2, K2CO3, Na2SO4 и AgNO3. На каждом стакане была аккуратно приклеена этикетка. В лаборатории жил попугай, клетка которого запиралась не очень хорошо. Когда Юх, поглощенный экспериментом, оглянулся на подозрительный шорох, он с ужасом обнаружил, что попугай, грубо нарушая правила техники безопасности, пытается пить из стакана с раствором BaCl2. Зная, что все растворимые соли бария чрезвычайно ядовиты, Юх быстро схватил со стола стакан с другой этикеткой и насильно влил раствор в клюв попугаю. Попугай был спасен. Стакан с каким раствором был использован для спасения попугая?
Ответ:
BaCl2 + Na2SO4 = BaSO4 (осадок) + 2NaCl (сульфат бария настолько малорастворим, что не способен быть ядовитым, как некоторые другие соли бария).
Демонстрационный эксперимент. Учитель показывает в пробирках образцы:
1 – кусочек кальция, 2 – негашеная известь, 3 – гашеная известь, 4 – гипс задает вопрос:
“Что общего между этими образцами?” и записывает цепочку из формул представленных образцов.
Ca CaO Ca(OH)2 CaSO4
Хорошо, ребята! Подумайте, как с помощью химических реакций можно перейти от простого вещества к сложному, от одного класса соединений к другим. Давайте проведем эксперимент, доказывающий присутствие атомов меди в разных ее соединениях. По ходу эксперимента запишите цепочку превращений. Назовите типы химических реакций.
Работа выполняется по инструктивной карте.
Соблюдайте правила техники безопасности!
Инструктивная карта.
Лабораторная работа: “Практическое осуществление цепочки химических превращений”.
Проверьте наличие оборудования и реактивов на рабочих местах.
Оборудование: штатив для пробирок, спиртовка, спички, зажим для пробирок, тигельные щипцы.
Реактивы и материалы: раствор соляной кислоты (1:2), медная проволока, железный гвоздь или скрепка, нитки.
Выполнение работы.
Проведите реакции, в которых осуществляются химические превращения.
Медная проволока оксид меди(II) хлорид меди(II) медь
Прокаливайте медную проволоку, удерживая ее тигельными щипцами, в верхней части пламени спиртовки (1–2мин). Что наблюдаете?
Аккуратно удалите черный налет с проволоки и поместите его в пробирку. Отметьте цвет вещества.
Прилейте в пробирку в пробирку 1 мл раствора соляной кислоты (1:2). Для ускорения реакции слегка нагрейте ее содержимое. Что наблюдаете?
Осторожно (почему?) погрузите в пробирку с раствором железный гвоздь (скрепку).
Через 2–3 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения.
Образованием какого вещества они вызваны?
Опишите и сравните цвет образовавшегося и исходного растворов.
Приведите рабочее место в порядок.
Внимание! Раствор с оксидом меди нагревать очень осторожно, держа пробирку высоко над пламенем спиртовки.
III. Заключение.
Учитель. Понятия “оксид”, “кислота”, “основание”, “соль” образуют систему, находящуюся в тесной взаимосвязи, она раскрывается при получении веществ одного класса из веществ другого класса. Она проявляется в процессе взаимодействия веществ и активно используется в практической деятельности человека. Как вы думаете, ребята, достигли мы цели, которую ставили в начале урока?
Сейчас мы это проверим.
IV. Закрепление знаний.
Назовите признаки, которые характеризуют генетический ряд.
Даны цепочки превращений:
a) Br2 HBr NaBr NaNO3
б) Fe FeCl2 Fe(OH)2 FeO Fe
в) CaCO3 CaO CaC2 C2H2
г) Si SiO2 Na2SiO3 H2SiO3
1-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда.
2-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда. Реакции ионного обмена запишите в молекулярной и ионной форме.
V. Домашнее задание.
Слайды 30, 31.
VI. Подведение итогов урока, оценивание, рефлексия.
Учитель. Ребята, пришло время подводить итоги. Чему вы сегодня научились, что узнали нового, что вы делали на уроке?
Ученики дают ответы.
urok.1sept.ru
Урок по теме «Генетическая связь между классами неорганических соединений»
Генетическая связь между классами неорганических соединений
Многие вещи нам непонятны не потому, что наши понятия слабы; но потому, что сии вещи не входят в круг наших понятий.
(Козьма Прутков.)
Цели урока:
- Проверить умения распознавать формулы основных классов неорганических веществ
- (оксидов, кислот, оснований, солей), а также классифицировать химические элементы на металлы и неметаллы.
- Продолжить развитие умений строить логические связи, осмысленно двигаясь по генетической цепочке “ простое вещество – оксид – гидроксид – соль”, развивать практические умения и навыки, а также умение делать выводы.
- Продолжить формирование понятия о единстве органических и неорганических веществ, об отсутствии резкой границы между веществами живой и неживой природы.
Тип урока: обобщение знаний и умений, их систематизация.
Методы и методические приемы.
Индивидуальная и групповая работа с карточками химических формул; самостоятельная работа по составлению химических уравнений; работа на обычной и магнитной доске; выполнение лабораторной работы; демонстрационный эксперимент.
Оборудование и реактивы.
Спиртовка, тигельные щипцы, проборкодержатель, подставка для пробирок, пробирка ПХ – 14, медная проволока, гвоздь или скрепка, нитки; колба с пробкой, ложка для сжигания веществ, фосфор (сера), вода, гидроксид натрия, лакмус, раствор соляной кислоты (1:2).
Наборы карточек с формулами веществ разных классов (1 и 2 варианты). Листы чистой бумаги.
Ход урока
I. Организационный момент.
1. Дисциплина.
2. Готовность класса к уроку.
3. Постановка цели урока, мотивация.
II. Основная часть.
УЧИТЕЛЬ. Тема урока: “Генетическая связь между классами неорганических соединений”. На уроке мы с вами рассмотрим небольшие фрагменты взаимопревращений веществ, вспомним классификацию неорганических веществ, поговорим о единстве и многообразии химических веществ.
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Все находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие[2]. Но иногда эти превращения оказывают негативное влияние на живые организмы, воду, атмосферу, горные породы.
Вы не раз замечали, что листья растений вянут и желтеют (появляются пятна), особенно после дождя. Вы не задумывались, почему это происходит?
УЧЕНИК. Предполагаю, что это влияние кислотных дождей.
УЧИТЕЛЬ. Верно, а знаете ли вы, как они образуются и почему?
УЧЕНИК. Дождь всегда представлял собой слабую кислоту: ведь содержащийся в воздухе углекислый газ реагирует с водой, образуя слабую угольную кислоту.
УЧИТЕЛЬ. Но с развитием промышленности, транспорта кислотность дождя резко повысилась. В поселке Аксарайск построен Газоперерабатывающий завод (ГПЗ), который перерабатывает сероводород:
Рисунок 1. Схема образования кислотных дождей в п. Аксарайск
Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот.
Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SO3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты:
2SO2 + О2 —> 2SO3, SO3 + Н2O —> H2SO4.
Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SO2 • nH2O, который часто называют сернистой кислотой и изображают условной формулой H2SO3:
SO2 + Н2O —> H2SO3.
Сернистая кислота во влажном воздухе постепенно окисляется до серной:
2Н2SO3 + O2 —> H2SO4.
Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег) [1].
Кислотные дожди действуют на карбонаты, превращаясь в нерастворимые сульфаты, которые в свою очередь дают воде постоянную жесткость. Кислотные дожди действуют на металлы, которые постепенно подвергаются коррозии: 2FeSO4 + Н2O +0,5O2 —> 2 Fe(OHSO4). Слабая угольная кислота снижает выделение кислорода в процессе фотосинтеза на 30%.
(Ученикам раздают схему образования кислотных аэрозолей и дождей (рис. 2).)
Рисунок 2. Механизм образования кислотных осадков[1]. (Приложение)
УЧИТЕЛЬ. Напишите цепочки превращений, которые здесь встречаются .
УЧЕНИК. S —> SO2—> SO3 —> H2SO4 CaSO4
Демонстрационный эксперимент. Учитель показывает в пробирках образцы :
1 – кусочек кальция, 2 – негашеная известь, 3 – гашеная известь, 4 — гипс задает вопрос:
“Что общего между этими образцами?” и записывает цепочку из формул представленных образцов.
УЧИТЕЛЬ. Ca—> CaO —> Ca(OH)2CaSO4
УЧИТЕЛЬ. Составьте химические уравнения следующих превращений. Уравнения между электролитами составьте в молекулярной и ионной форме.
УЧЕНИК 1. S + O2—>SO2; SO3 + H2O—> H2SO4 ;
2SO2 + O2—> 2SO3; H2SO4 + CaCO3—> CaSO4 + H2O + CO2
УЧЕНИК 2. 2Ca + O2—>2CaO; CaO + H2O —> Ca(OH)2
УЧЕНИК 3. H2SO4 + Ca(OH)2—> CaSO4 + 2H2O
2H+ +SO42-— + Ca2++2ОН—>CaSO4+H2O
УЧИТЕЛЬ. Записали в виде формул происходящие явления и получили логические цепочки. Что общего в цепочках превращений?
УЧЕНИК. В этих цепочках повторяется один и тот же элемент (Ме или НеМе) в формулах разных классов веществ, а в результате превращений получается соль CaSO4 .
УЧИТЕЛЬ. Правильно. Такие цепочки называются генетические ряды. Эти ряды образуют “родственные вещества”, которые взаимосвязаны между собой генетическими связями. Т.е.имеют одно начало. Какие вещества в генетическом ряду будут родственны. Назовите классы веществ, дайте определение каждому классу веществ.
УЧЕНИК.
УЧИТЕЛЬ. Хорошо. Теперь распределите карточки с веществами по группам и ответы запишите на листах бумаги.
В это время ученик у магнитной доски распределяет свой комплект карточек: Fe, P, Cu, Li,
C, S, LiOH, H2SO4, Li2CO3, HNO2, BaCl2, Cu(OH)2, CuSO4, CuO, P2O5, KCL, SO3, Li2O.
УЧЕНИК.
УЧИТЕЛЬ. Осуществите взаимопроверку в парах, исправьте ошибки, если они имеются.
А теперь составьте из предложенных на доске веществ генетические ряды:
УЧЕНИК 1. Cu —> CuO —> CuSO4 —> Cu(OH)2
УЧЕНИК 2. Li —> Li2O —> LiOH —> Li2CO3
УЧЕНИК 3. S —> SO3 —> H2SO4 —> CuSO4
(обратить внимание на построенный ряд первым учеником: (если основание нерастворимо, то ряд строится так: Ме —> оксид —> соль —> основание ))
УЧИТЕЛЬ. Хорошо, ребята! Подумайте, можно ли с помощью химических реакций перейти от простых веществ к сложным, от одного класса соединений к другим. Давайте проведем эксперимент, доказывающий присутствие атомов меди в разных её соединениях. По ходу эксперимента запишите цепочку превращений. Назовите типы химических реакций.
Работа выполняется по инструктивной карте. Соблюдайте правила техники безопасности!
Инструктивная карта.
Лабораторная работа: “Практическое осуществление цепочки химических превращений”.
Проверьте наличие оборудования и реактивов на рабочих местах.
Оборудование: штатив для пробирок, пробирка ПХ – 14, спиртовка, спички, зажим для пробирок, тигельные щипцы.
Реактивы и материалы : раствор соляной кислоты (1:2), медная проволока, железный гвоздь или скрепка, нитки.
Выполнение работы.
Проведите реакции, в которых осуществляются химические превращения.
Медная проволока —> оксид меди(II) —> хлорид меди(II) a медь
Прокаливайте медную проволоку, удерживая её тигельными щипцами, в верхней части пламени спиртовки(1-2мин). Что наблюдаете?
Аккуратно удалите черный налет с проволоки и поместите его в пробирку. Отметьте цвет вещества.
Прилейте в пробирку в пробирку 1 мл раствора соляной кислоты (1:2). Для ускорения реакции слегка нагрейте её содержимое. Что наблюдаете?
Осторожно (почему?) погрузите в пробирку с раствором железный гвоздь (скрепку).
Через 2-3 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения.
Образованием какого вещества они вызваны?
Опишите и сравните цвет образовавшегося и исходного растворов.
Отчет о работе оформите в свободной форме.
Приведите рабочее место в порядок.
ВНИМАНИЕ! Раствор с оксидом меди нагревать очень осторожно, держа пробирку высоко над пламенем спиртовки.
III. Заключение.
УЧИТЕЛЬ. Ребята, пришло время подводить итоги. Чему вы сегодня научились, что узнали нового, что вы делали на уроке?
УЧЕНИК . Мы рассмотрели небольшие фрагменты взаимопревращений веществ. Эти взаимопревращения различных веществ называются генетической связью (от слова “генезис” — происхождение) или (“генео” — рождаю) [2]. Выполняли лабораторную работу.
УЧИТЕЛЬ. Понятия “оксид”, “кислота”, “основание”, “соль” образуют систему, находящуюся в тесной взаимосвязи, она раскрывается при получении веществ одного класса из веществ другого класса. Она проявляется в процессе взаимодействия веществ и активно используется в практической деятельности человека. Как вы думаете, ребята, достигли мы цели, которую ставили в начале урока? Сейчас мы это проверим.
IV.Закрепление знаний.
Назовите признаки, которые характеризуют генетический ряд.
Даны цепочки превращений:
a) Br2 —> HBr —> NaBr —> NaNO3
б) Fe —> FeCl2 —> Fe(OH)2 —> FeO —> Fe
в) CaCO3 —> CaO —> CaC2 —> C2H2
г) Si —> SiO2 —> Na2SiO3 —> H2SiO3
1-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда.
2-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда. Реакции ионного обмена запишите в молекулярной и ионной форме.
V. Домашнее задание.
УЧИТЕЛЬ. Ребята, запишите домашнее задание:
P + … —>P2O5; P2O5 + H2O —>…; … + NaOH —> … + H2O
Вставьте пропущенные формулы веществ, расставьте коэффициенты. Генетический ряд какого элемента можно составить в данном случае.
VI. Подведение итогов урока, оценивание.
Литература.
- Боровский Е.Э.Кислотные осадки. Парниковый эффект.- М. :Чистые пруды, 2005;
- Габриелян О.С.Настольная книга учителя химии 8 класс.-М.: “Блик плюс”, 2000;
- Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для учащихся 9 класса общеобразоват. учрежд.-М.: “Вентана-Граф”, 2003.
urok.1sept.ru
Разработка урока химии «Классификация неорганических соединений. Генетическая связь между классами неорганических соединений». 11 класс
І. Тема урока: Классификация неорганических соединений Генетическая связь неорганических соединений
Тип занятия: урок повторение
Цель: Знать классификацию неорганических соединений
Задачи:
Образовательная: познакомить учащихся с основными классами неорганических веществ; сформировать умение определять по формуле принадлежность вещества к определенному классу.
Развивающая: развивать у учащихся общеучебные навыки, самостоятельность, логическое мышление, умение сравнивать и анализировать, классифицировать объекты и явления, мыслить абстрактно.
Воспитательная: содействовать экологическому воспитанию, раскрывая материал о воздействии химических веществ на природу; развивать познавательный интерес учащихся к предмету химия, используя конкретные примеры из жизни.
ІІ. Ожидаемые результаты:
А) Учащиеся должны знать:классифицировать классы неорганических веществ
Ә) Учащиеся должны уметь: описывать химические свойства неоргниаческих веществ
б) учащиеся должны владеть: работа с ПС
ІІІ. Метод и приемы каждого этапа занятия: репродуктивтый, наглядный, классификационный, аналитический, самостоятельная работа, взаимопроверка, фронтальная устная работа
IV. Средства: п. с. Д.И. Менделеева.
Ход урока
І. Организационная часть: Проверить посещяемость учащихся. Ознакомление с целью и задачами сегодняшнего занятия.
ІІ. Повторение и обобщение знании: Фронтальный опрос:
Какие бывают вещества по свойства?
ІІІ. Объяснение
План:
1. Классификация неорганических веществ
2. Генетическая связь между классами неорганических веществ
1. Классификация неорганических веществ
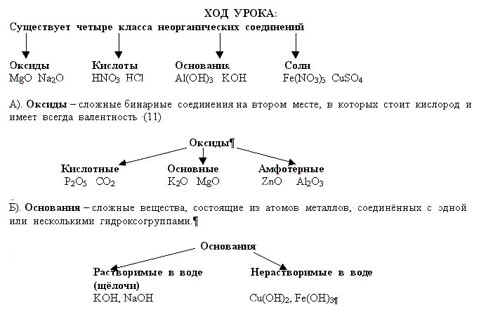

IV. Закрепление знаний: Задание № 1 Распределите по классам следующие соединения: CO2, Al2(SO4)3, KOH, CuO, h3SO4, NaNO3, Ca(OH)2, MgO, HCl, h3CO3, K3PO4, N2O3, HNO3, Al(OH)3, CaCO3, Mg(OH)2, NO2, CaSO4, Ba(OH)2, H2CO3, CaO, Сr(OH)3, H2SO3, KNO3, Fe(OH)3, Na2CO3, H2SO4, Na2CO3, Cl2O7 FeCl2, Zn(OH)2, P2O5, Al(NO3) 3, LiOH, H3PO4, BaO
V. Домашнее задание: Осуществить генетическую связь
2. Генетическая связь между классами неорганических веществ.
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Генетический ряд – ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих превращения данных веществ. В основу этих рядов положен один и тот же элемент.
Какие виды генетических рядов принято выделять?
Среди металлов можно выделить две разновидности рядов:
а) Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл →основный оксид → щёлочь → соль
например, генетический ряд калия K → K2O → KOH→ KCl
б) Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл → основный оксид → соль→ нерастворимое основание →основный оксид → металл
например: Cu→ CuO → CuCl2 → Cu(OH)2 → CuO → Cu
Среди неметаллов также можно выделить две разновидности рядов:
а) Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл → кислотный оксид → растворимая кислота → соль.
Например: P→ P2O5 → H3PO4 →Na3PO4
б) Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота : неметалл → кислотный оксид → соль→ кислота → кислотный оксид → неметалл
Например: Si→ SiO2 → Na2SiO3 → H2SiO3→ SiO2 → Si
Проверочная работа по теме «Номенклатура и классификация неорганических соединений» (11 класс)
Вариант № 1
1. Назовите соединения: Сu(NO3)2, CuO, CO2, NaOH , SO2 , H2SO4, CaSO4, КOH, НCl, HNO3, CaO, KCl.
2. Из задания № 1 выпишите формулы оксидов
3. Составьте формулы всех возможных оксидов для следующих элементов: Ca , S, O, Mg.
4. Составьте формулы следующих соединений: оксид азота (I), гидроксид натрия, сульфат бария, оксид магния, хлорид алюминия, дигидрофосфат натрия, гидроксонитрат железа(II)
……………………………………………………………………………………………………………………
Проверочная работа по теме «Номенклатура и классификация неорганических соединений» (11 класс)
Вариант № 2
1. Назовите соединения: BaCl2, H2SiO3, H3PO4, BaO, H2SO3, AlCl3, Ba(OH)2, KNO3, CaСO3, Fe(OН)2, Na2O, P2O5
2. Из задания № 1 выпишите формулы солей.
3. Составьте формулы всех возможных оксидов для следующих элементов: C, Al, N, Fe.
4. Составьте формулы следующих соединений: фтороводородная кислота, гидроксид бария, нитрат меди, оксид железа (III), оксид кремния, гидроксобромид меди(II), гидрокарбонат лития
………………………………………………………………………………………………………………………
Проверочная работа по теме «Номенклатура и классификация неорганических соединений» (11 класс)
Вариант № 3
1. Назовите соединения: Ba(NO3)2, MgO, CO2, NaOH, HNO2, ZnO, NaCl, SO3, H2SO4, BaSO4,LiOH, НCl,
2. Из задания № 1 выпишите формулы кислот.
3. Составьте формулы всех возможных оксидов для следующих элементов: К, Cl, Mg, Ba.
4. Составьте формулы следующих соединений: гидроксид цинка, оксид алюминия, сероводородная кислота, оксид водорода, нитрат меди, дигидроксохлорид алюминия, гидросульфид натрия
…………………………………………………………………………………………………………………………………..
Проверочная работа по теме «Номенклатура и классификация неорганических соединений» (11 класс)
Вариант № 4
1. Назовите соединения: K2O, P2O3, MgCl2, H2SO3 , H3PO4, :Na2СO3, Fe(OН)3ZnO, H2SO4, FeCl3, Ca(OH)2, NaNO3
2. Из задания № 1 выпишите формулы оснований.
3. Составьте формулы всех возможных оксидов для следующих элементов: Si, Al, N, Li
4. Составьте формулы следующих соединений: гидроксид алюминия, оксид углерода (IV), карбонат кальция, оксид натрия, хлороводородная кислота, гидросульфат кальция, гидроксоиодид железа(II)
infourok.ru
«Генетическая связь между классами неорганических соединений»
Урок по химии в 8-м классе по теме: «Генетическая связь между основными классами неорганических соединений»
Девиз урока:
« Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим».
Майкл Фарадей.
ЦЕЛЬ. На конкретных примерах доказать существование генетической связи между основными классами неорганических веществ.
Задачи:
Обучающие: систематизировать знания учащихся о составе и свойствах основных классов неорганических веществ.
Развивающие: развивать умения ставить проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; развивать предметные компетентности и способность к адекватному само- и взаимоконтролю.
Воспитательные: продолжить формирование научного мировоззрения обучающихся; воспитывать наблюдательность, внимание, инициативу.
Методы : проблемный, исследовательский , словесный .
Формы работы: групповая , индивидуальная работа ,самопрверка, взаимопроверка результатов самостоятельной работы в группе, выставление отметок.
Оборудование: мультимедиапроектор, экран, презентация, штатив с пробирками, компетентностно-ориентированные задания.
Реактивы: натрий, вода, фенолфталеин, соляная кислота, оксид кальция, сульфат меди, гидроксид натрия.
Ход урока.
I.ОРГАНИЗАЦИОННО — МОТИВАЦИОННЫЙ ЭТАП
1.1 Оргмомент.
1.2 Актуализация знаний
Проводится эвристическая беседа с классом по пройденному материалу.
Какие вещества нас окружают в повседневной жизни? (Простые и сложные)
Какие простые вещества вам известны? (металлы и неметаллы)
Какие сложные вещества? (оксиды, основания, кислоты, соли) Что такое оксид? Какие бывают оксиды? Приведите примеры. Что такое кислота? Какие бывают кислоты? Приведите примеры. Что такое основание? Какие бывают основания? Примеры. Что такое соль? Каких солей мы знаем?
Постановка проблемы. Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Все в нем находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие. Все в нем взаимосвязано и взаимообусловлено. Это всеобщий закон природы.
Я предлагаю вам подтвердить или опровергнуть его.
Вам даны вещества: ВaO, P , NaCl, H3PO4 , Вa(OH)2, Ca 3(PO4)2,, H2SO4,ВаSO4 , Вa, P2O5.
1. Из веществ, формулы которых предложены, выберите те, которые можно объединить в две группы.
Остановимся на том варианте, где учащиеся увидят формулы веществ, содержащих один и тот же элемент.
2. Попробуйте распределить их в два ряда по усложнению состава, начиная с простого вещества. Получили две цепи:
Ba BaO Ba(OH)2 ВаSO4
P P2O5 H3PO4 Ca 3(PO4)2
Учитель: В каждой цепи есть общее — это химические элементы — Ba и P, они переходят от одного вещества к другому (как бы по наследству).
Учитель: Почему вы похожи на родителей, ваши родители на своих и т.д ?
Ученик : Родственники обладают сходными признаками, которые передаются по наследству.
Вопрос: А что является носителем наследственной информации?
Ученик: Ген.
Учитель: Как вы думаете, какой элемент будет являться «геном» для данной цепи?
Ученик: Ва и Р
Учитель: Поэтому цепи или ряды называются генетическими.
Тема нашего урока: «Генетическая связь между основными классами неорганических соединений»
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH)2 → CаSO4.
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl2 → Cu (OH)2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P2O5 → H3PO4 → Ca3(PO4)2.
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO2 → Na2SiO3 → H2SiO3 → H2SiO3 → SiO2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
Опыт №1 Na → NaOH → NaCL берем Na добавляем воду получаем гидроксид Na добавляем индикатор фенофталеин доказываем что это щелочь осторожно добавляем соляную кислоту. Происходить реакция нейтрализации. Раствор обесцвечивается, образуется соль и вода. Давайте напишем уравнения реакции.
Опыт №2 Инструкция1 .(Соблюдайте технику безопасности!)
1. В пробирку берем оксид кальция добавляем воду получаем гидроксид кальция Ca(OH)2 добавляем индикатор фенофталеин осторожно добавьте серную кислоты. Что наблюдаете? Составьте уравнение химической реакции
CaO → Ca(OH)2 → CаSO4
Опыт №3 CuSO4 → Cu (OH)2 → CuO
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Обучающиеся выполняют задание « Найди родственников»
Задание « Найди родственников»
Из перечня формул составьте генетический ряд.
1вариант : Ca(OH)2, CI2, Ca, P, CaCO3, NaOH, CaO, CO2.
2 вариант: AI, NaOH, AI(OH)3, CaO, CO2, AI2O3 , P, AICI3
3.2. ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
Формулировка вывода:
Все в природе взаимосвязано, поэтому и в химии все вещества взаимосвязаны друг с другом и из одних можно получить другие.
3.3. ДОМАШНЕЕ ЗАДАНИЕ
Повторить тему: «Основные классы неорганических соединений» §, составить уравнения реакций к цепочкам, которые вы составили при выполнении задания «Найди родственников».
.
infourok.ru
Урок по химии «Генетическая связь между основными классами неорганических соединений » (8 класс)
Урок по химии в 8-м классе по теме: «Генетическая связь между основными классами неорганических соединений»
Девиз урока:
« Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим».
Майкл Фарадей.
ЦЕЛЬ. На конкретных примерах доказать существование генетической связи между основными классами неорганических веществ.
Задачи:
Обучающие: систематизировать знания учащихся о составе и свойствах основных классов неорганических веществ.
Развивающие: развивать умения ставить проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; развивать предметные компетентности и способность к адекватному само- и взаимоконтролю.
Воспитательные: продолжить формирование научного мировоззрения обучающихся; воспитывать наблюдательность, внимание, инициативу.
Методы : проблемный, исследовательский , словесный .
Формы работы: групповая , индивидуальная работа ,самопрверка, взаимопроверка результатов самостоятельной работы в группе, выставление отметок.
Оборудование: штатив с пробирками, держатель, спиртовка, тигельные щипцы, спички, компетентностно-ориентированные задания.
Реактивы: оксид меди, раствор серной кислоты, гидроксид натрия, магний, соляная кислота, свеча трубочка, известковая вода.
Ход урока.
I.ОРГАНИЗАЦИОННО — МОТИВАЦИОННЫЙ ЭТАП
1.1 Оргмомент.
1.2 Актуализация знаний
Проводится эвристическая беседа с классом по пройденному материалу.
Какие вещества нас окружают в повседневной жизни?(Простые и сложные)
Какие простые вещества вам известны? (металлы и неметаллы)
Какие сложные вещества?(оксиды, основания, кислоты, соли)
Что такое оксид?
Какие бывают оксиды? Приведите примеры.
Что такое кислота?
Что такое основание?
Какие бывают основания?
Что такое соль?
Раздаются карточки с заданиями и «Рабочая карта урока»
Задания выполняются поэтапно с проверкой и оценкой правильности выполнения, критерии оценивания описаны в рабочей карте.
Задание № 1
«Найди лишнее вещество»
1) SO3, HNO3, FeO, K2O, CO2, CuO.
(лишнее HNO3, т.к. оксиды)
2) HNO3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3.
(лишнее Al(OH)3, т.к. кислоты)
3) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2.
(лишнее Ba, т.к. основания)
4) KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3
(лишнее BaO, т.к. соли)
Задание № 2
Распредели вещества по 4 колонкам (оксиды, основания, кислоты и соли)
Ca(OH)2, CI2, HCI, Ca, P, CaCO3, NaOH, CaO, CO2, AI(OH)3, AI2O3, HNO3, NaH, Na, NaNO3,CI2O7, HCIO4 , AICI3, NaCIO4, Zn(OH)2, KOH, Fe(OH)2, Ba(OH)2, FeSO4,
K2O, CuO, H2CO3, H2SO4, FeO, H3PO4.
Задание № 3
Ответь на вопросы
Взаимодействие с водой с образованием кислоты?
Взаимодействие с водой с образованием щелочи?
Взаимодействие с кислотами с образованием соли и воды?
Взаимодействие с основаниями с образованием соли и воды?
Взаимодействием с кислотными оксидами с образованием соли?
Взаимодействие с основными оксидами с образованием соли и воды?
Взаимодействие с амфотерным гидроксидом с образованием соли и воды?
Вступают в реакцию нейтрализации?
Взаимод. с солями в том случаи, если один из продуктов р-ции выпадает в осадок?
Водный раствор изменяет окраску индикаторов: фенолфталеин — малиновый.
II. ОПЕРАЦИОННО — ИСПОЛНИТЕЛЬСКИЙ ЭТАП
Постановка проблемы. Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Все в нем находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие. Все в нем взаимосвязано и взаимообусловлено. Это всеобщий закон природы. Я предлагаю вам подтвердить или опровергнуть его.
Задание № 4
Задание выполняется всеми учениками класса в рабочей тетради.
Вам даны вещества: ВaO, CO2 , P , NaCl, H3PO4 ,SO3, Вa(OH)2, NaOH, Ca 3(PO4)2,, H2SO4, ВаSO4 , Вa, P2O5.
1. Из веществ, формулы которых предложены, выберите те, которые можно объединить в две группы.
Остановимся на том варианте, где учащиеся увидят формулы веществ, содержащих один и тот же элемент.
2. Попробуйте распределить их в два ряда по усложнению состава, начиная с простого вещества. Получили две цепи:
Ba BaO Ba(OH)2 ВаSO4
P P2O5 H3PO4 Ca 3(PO4)2
Учитель: В каждой цепи есть общее — это химические элементы — Ba и P, они переходят от одного вещества к другому (как бы по наследству).
Учитель: Почему вы похожи на родителей, ваши родители на своих и т.д ?
Ученик : Родственники обладают сходными признаками, которые передаются по наследству.
Вопрос: А что является носителем наследственной информации?
Ученик: Ген.
Учитель: Как вы думаете, какой элемент будет являться «геном» для данной цепи?
Ученик: Ва и Р
Учитель: Поэтому цепи или ряды называются генетическими.
Тема нашего урока: «Генетическая связь между основными классами неорганических соединений»
Исходя из двух составленных цепей: бария и фосфора, используя обозначения Ме и неМе , 1 и 3 варианты составьте опорный конспект в виде блока для Ме, а 2 и 4 варианты – для неМе.
По одному представителю от группы записывают у доски.
Получаем: 
Суждение. Между основными классами неорганических соединений существует родственная (генетическая взаимосвязь).
Задание № 5
Проблемная ситуация. Можно ли составить «иной » генетический ряд. Как вы думаете, с какого класса веществ нужно начать этот ряд? (варианты могут быть разные). Подтвердите или опровергните свои суждения, выполнив в группе КОЗы.
(Работа в группах с Компетентностно-ориентированными заданиями №1-4.
Проверка результатов . (по одному представителю от группы записывают уравнения ).
III. РЕФЛЕКСИВНО-ОЦЕНОЧНЫЙ ЭТАП
3.1ПЕРВИЧНОЕ ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Обучающиеся выполняют задание « Найди родственников»
Итоговый контроль.
3.2. ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
Формулировка вывода:
Все в природе взаимосвязано, поэтому и в химии все вещества взаимосвязаны друг с другом и из одних можно получить другие
3.3. ДОМАШНЕЕ ЗАДАНИЕ
Повторить тему: «Основные классы неорганических соединений», составить уравнения реакций к цепочкам, которые вы составили при выполнении задания «Найди родственников»
3.4 РЕФЛЕКСИЯ
Отметь, насколько хорошо ты усвоил новый материал:
1. Усвоил полностью
2.В основном усвоил, но требуется ещё разобрать дома
3. Не понял тему
Компетентностно-ориентированное задание для группы №1
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
Инструкция 1.(Соблюдайте технику безопасности!)
1. В пробирку с магнием осторожно добавьте 2мл соляной кислоты. Что наблюдаете? Составьте уравнение химической реакции.
2. После того, как магний весь раствориться в пробирку добавьте 2 мл гидроксида натрия. Что наблюдаете?
3. К полученному осадку добавьте 2мл соляной кислоты. Что наблюдаете? Составьте молекулярные уравнения.
4. Составьте генетический ряд «Найди родственников» .
Реактивы (формула и название вещества)
Уравнение химической реакции
Что наблюдали
Магний (Mg) и соляная кислота (НСI)
Mg + 2 H +CI— = Mg +2 CI2 — + H2
Mg—2е = Mg +2 восстановитель окисляется
2 H + +2е = H2 окислитель восстанавливается
Выделяется газ водород
Хлорид магния(MgCI2) и гидроксид натрия(NaOH)
MgCI2 + 2NaOH =Mg(OH)2+ 2 NaCI
Mg2+ +2CI— +2Na++2OH— = 2Na++2CI— + Mg(OH)2
Mg2+ + 2OH— = Mg(OH)2
Выпадает осадок белого цвета
Гидроксид магния(Mg(OH)2и соляная кислота(HCI)
Mg(OH)2 +2 HCI= MgCI2 +2Н2О
Mg(OH)2 +2 H+ +2CI— = Mg2+ +2CI— +2Н2О
Mg(OH)2 +2 H+ = Mg2++2Н2О
Mg → MgCI2 → Mg(OH)2 → MgCI2
Осадок растворяется
Компетентностно-ориентированные задания для группы №2
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
Инструкция 1.(Соблюдайте технику безопасности!)
1.В пробирку с оксидом меди(II) добавьте 8мл серной кислоты. Пробирку закрепите в держателе и нагрейте в пламени спиртовки. Что наблюдаете? Запишите в таблицу , составьте молекулярные уравнения.
2. К полученному раствору добавьте 3мл гидроксида натрия. Что наблюдаете? Запишите в таблицу , составьте молекулярные уравнения.
3. Немного полученного осадка капните на предметное стекло, закрепите его в держателе и нагревайте до тех пор, пока вода не испариться. Что наблюдаете? Запишите в таблицу , составьте молекулярное уравнение.
4. Составьте генетический ряд «Найди родственников» .
Реактивы (формула и название вещества)
Уравнение химической реакции
Что наблюдали
Оксид меди(II) (CuO) и серная кислота (H2SO4)
CuO + H2SO4 =CuSO4 + H2O
CuO +2H+ +SO42-= Cu2++SO2-4+ H2O
CuO +2H+ = Cu2++ H2O
Черный порошок растворяется, образуется раствор голубого цвета.
Сульфат меди (CuSO4) и гидроксид натрия (NaOH)
CuSO4 +2NaOH=Cu(OH)2+Na2 SO4
Cu2++SO2-4+2Na++2OH— =Cu(OH)2 + 2Na ++ SO42-
Cu2++2OH—= Cu(OH)2
Выпал осадок голубого цвета.
Гидроксид меди(II) ( Cu(OH)2
t
Cu(OH)2 = CuO+ H2O
Вода выкипела , а на стекле остался черный оксид меди(II)
CuO→ CuSO4 → Cu(OH)2 → CuO
Компетентностно-ориентированные задания для группы №3
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
Инструкция 1.(Соблюдайте технику безопасности!)
1.Налейте в пробирку 3мл сульфата железа (II) и добавьте 2мл гидроксида натрия. Что наблюдаете? Составьте молекулярные уравнения.
2. Подождите 2-3 минуты. Что наблюдаете? Составьте молекулярное уравнение и электронный баланс к нему.
3. К полученному осадку прилейте 3мл соляной кислоты. Что наблюдаете? Составьте молекулярные уравнения.
4. Составьте генетический ряд «Найди родственников» .
FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCI3
Реактивы (формула и название вещества)
Уравнение химической реакции
Что наблюдали
Сульфат железа (II)(FeSO4) и гидроксид натрия (NaOH)
FeSO4 + 2NaOH= Fe(OH)2 + Na2 SO4
Fe2++SO42-+ 2Na++2OH—= Fe(OH)2+2Na++ SO42-
Fe2++ 2OH—= Fe(OH)2
Образуется осадок темно-зеленого цвета
Гидроксид железа(II) ( Fe(OH)2) и кислород воздуха
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(O-2 H +)3
Fe+2 -1e = Fe+3 4 восстановитель окисляется
O2 +4е = 2O-2 1 окислитель восстанавливается
Постепенно осадок буреет
Гидроксид железа(III)
(Fe(OH)3) и соляная кислота(HCI)
Fe(OH)3 + 3HCI= FeCI3 + 3H2O
Fe(OH)3 +3H+ +3CI— = Fe3+ +3CI— + 3H2O
Fe(OH)3 +3H+ = Fe3+ + 3H2O
Осадок растворился, стал кирпично-красным
Компетентностно-ориентированные задания для группы №4
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем..
Инструкция 1.(Соблюдайте технику безопасности!)
1. В пробирку с известковой водой( гидроксид кальция) опустите стеклянную трубочку и выдыхайте через нее углекислый газ. Что наблюдаете? Составьте молекулярные уравнения.
2.Выньте трубочку и в пробирку добавьте соляной кислоты. Что наблюдаете? Составьте молекулярные уравнения.
3. К полученному раствору добавьте 1 мл нитрата серебра. Что наблюдаете? Составьте молекулярные уравнения.
4. . Составьте генетический ряд «Найди родственников» .
Реактивы (формула и название вещества)
Уравнение химической реакции
Что наблюдали
Оксид углерода(IV) (углекислый газ(СО2) и известковая вода(гидроксид кальция)(Са(ОН)2)
СО2 + Са(ОН)2 = СаСО3↓ + H2O
СО2 + Са2+ +2ОН— = СаСО3↓ + H2O
Известковая вода мутнеет
Карбонат кальция (СаСО3) и соляная кислота(HCI)
СаСО3↓ + 2 HCI= СаCI2 + СО2 + H2O
СаСО3↓ + 2 H+ +2CI— = Са2+ +2CI— + СО2 + H2O
Осадок растворяется
Хлорид кальция (СаCI2) и нитрат серебра (AgNO3)
СаCI2 + 2AgNO3 = 2AgCI + Ca(NO3)2
Са2+ +2CI— = 2Ag+ +2NO3— = 2AgCI + Ca2++2NO3—
2CI— + 2Ag+ = 2AgCI
Выпал белый хлопьевидный осадок
СО2 → СаСО3 → СаCI2 → AgCI
Рабочая карта урока (Ф.И.)_________________________________________________
По теме «Генетическая связь между классами неорганических соединений».
Участие в беседе
За каждый правильный ответ 1балл
Кол-во баллов________
1.Найди лишнее вещество
За каждый правильный ответ 1балл
Кол-во баллов_______
2. Распредели вещества по 4 колонкам (оксиды, основания, кислоты и соли)
За каждый правильный ответ 1балл
Кол-во баллов________
3. Ответь на вопросы.
За каждый правильный ответ 1 балл
Кол-во баллов________
4. Составить генетические цепочки веществ.
За каждый правильный ответ 1 балл
Кол-во баллов________
5. Компетентностно-ориентированные задания №1-4.
А) выбор вешеств -1балл
Б) составление уравнений за1 -2балла
В) ответ у доски-3балла
Г) выполнение эксперимента по 1 баллу Кол-во баллов________
6. Закрепление « Найди родственников»
и составь генетический ряд:
Кол-во баллов________
За каждый этап 1 балл
7.Заключительная часть
Формулировка вывода -1балл
Составление древа -1балл
Кол-во баллов________
Общее количество баллов______
Отметка за урок________
Рефлексия.
Отметь, насколько хорошо ты усвоил новый материал:
1. Усвоил полностью
2.В основном усвоил, но требуется ещё разобрать дома
3. Не понял тему.
infourok.ru