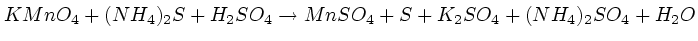Окислительно-восстановительные реакции. Много примеров
1 вариант
«3»
H2O2 = H2O + O2
(NH4)2Cr2O7 = Cr2O3 + N2 + H2O
H2S + SO2 = S + H2O
Zn + HNO3 = Zn(NO3)2 + NO + H2O
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2
Zn + H2SO
KClO3 = KCl + KClO4
«4»
MnCO3 + KClO3 = MnO2 + KCl + CO2
Fe2O3 + CO ® Fe + CO2
(NH4)2CrO4 = Cr2O3 + N2 +H2O + NH3
KMnO4 + H2SO4 + Na2SO3 =MnSO4 + H2O + Na2SO4 + K2SO4
Na2SO3 + KOH + KMnO4 ® Na2SO4 + H2O + K2MnO4
KMnO4 + H2О +Na2SO3 = MnО2(т) + Na2SO4 + КОН

«5»
As2 S3
HCl + K2Cr2O7 CrCl3 + Cl2 + KCl + H2O
KMnO4 + NaBr + H2SO4 = K2SO4 + Br2 + MnSO4 + Na2SO4 + H2O
K2Cr2O7 + H2O2 + H2SO4 = Cr2(SO4 )3 + O2 + H2O + K2SO4
H2S + КMnO4 = К2 SO4 + MnO2 + КOH +H2O
Cr2(SO4)3 + Br2 + NaOH = Na2CrO4 + NaBr + Na2SO4 + H2O
K2Cr2O7 + KI + H2SO4 = I2 + Cr2(SO4)3
2 вариант
«3»
НCl + МnО2 = Сl2 + MnСl2 + Н2О
Zn + HNO3 = Zn(NO3)2 + NO2 + H2O
N2+Н2 = NH3
NO + O2 = NO2
NO2 + Са = СаО + Са3N2
НNO3 = NO2 +O
2 + Н2ONO2 + O2 + Н2O = НNO3
«4»
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
N2 + Мg = Мg3N2
NH3 + O2 = N2 + Н2O
NO2 + Н2 = NНз + Н2
NO2 + O2 + КOН = КNO3 + Н2O
НNО3 + Н2S = Н2S04 + NO2 + Н2O
PH3 + HMnO4 = H3PO4 + MnO2 + H2O
«5»
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
- Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
KOH + H3PO4= K3PO4 + H2O
P +KOH + H2O = KH2PO4 + PH3
Br2 + KOH(хол) = KBrO + KBr + H2O
Br2 + KOH(гор) = KBr + KBrO3 + H2O
Ca + 10HNO3(конц
3Mg + N2 =Mg3N2
3Mg + 2NH3= Mg3N2 + 3H2
4Mg + 10HN03 = 4Mg(NO3)2 + N2O + 5H2O
NH3 + HNO3= NH4NO3
2.
4Ca + 10HNO3(конц) = 4Сa(NO3)2 + N2O + 5H2O
4Ca + 10HNO3(разб)= 4Сa(NO3)2 + NH4NO3 + 3H2O
P + 5HNO3 = H3PO4 + 5NO2 + H2O
3Ca + 2P = Ca3P2
3.
Na 2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + H3PO4 = NaH2PO4 + NaHSO3
3KOH + H3PO4= K3PO4 + 3H2O
4.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
CuS + 8HNO3(конц) = CuSO4+ 8NO2 + 4H2O
2Cu + 2NO = 2CuO + N2
5.
S + 6HNO3(конц
S + 2H2SO4(конц) = 3SO2 + 2H2O
H2S + 2HNO3(конц) = S + 2NO2 + 2H2O
H2S + 3H2SO4(конц) = 4SO2 + 4H2O
6.
2FeCl3 + 2NaI = 2NaCl + 2FeCl2 + I2
FeCl3 + 3CsOH = Fe(OH)3↓ + 3CsCl
H2SO4 + 2CsOH = Cs2SO4 + 2H2O
Na2Cr2O7 + 2CsOH = Na2CrO4 + Cs2CrO4 + H2O
Na2Cr2O7 + 6NaI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
7.
2Al + 3Cl2 = 2AlCl3
2KI + Cl2 = I2 + 2KCl
2KI + 2H2SO4(конц) = I2 + K2SO4 + SO2 + 2H2O
t
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
8.
C + 2H2SO4(конц)= CO2 + 2SO2 + 2H2O
3C + 8H2SO4 + 2K2Cr2O7 = 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8H2O
C + 2H2 = CH4
K2Cr2O7 + 2H2SO4 = 2KHSO4 + 2CrO3 + H2O
9.
NaOH + HCl = NaCl + H2O
NaHCO3 + HCl = NaCl + CO2 + H2O
NaHCO3 + NaOH = Na2CO3 + H2O
Si + 4NaOH = Na4SiO4 + 2H2↑
10.
2Al(безокс.пя) + 6H2O = 2Al(OH)3 + 3H2↑
NaOH + HNO3 = NaNO3 + H2O
8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
(Допустимо Na3[Al(OH)6])
11.
Na2S + H2S = 2NaHS
3Na2S + 2AlCl3 +6H2O = 3H2S + 2Al(OH)3 +6NaCl
Na2S + Cl2 = 2NaCl + S
H2S + Cl2 = 2HCl + S
12.
Na2O +Fe2O3 = 2NaFeO2
2HI + Na2O = 2NaI + H2O
Na2O + CO2 = Na2CO3
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
13.
K3[Al(OH)6] + AlCl3 = 2Al(OH)3 + 3KCl
K3[Al(OH)6] + 3H2S = Al(OH)3 + 3KHS + 3H2O
H2S + 2RbOH = Rb2S + 2H2O
AlCl3 + 3RbOH = Al(OH)3 + 3RbCl
14.
K2CO3 + CO2 + H2O = 2KHCO3
2K2CO3 + H2O + MgCl2 = (MgOH)2CO3 + CO2 + 4KCl
2KHCO3 + MgCl2 = MgCO3 + 2KCl + CO2 + H2O
CO2 + 2Mg = C + 2MgO
15.
5NaNO3 + 2P = 5NaNO2 + P2O5
5Br2 + 2P = 2PBr5
4P + 3KOH + 3H2O = 3KH2PO4 + PH3
Br2 + 2KOH(хол) = KBrO + KBr + H2O
3Br2 + 6KOH(гор) = 5KBr + KBrO3 + 3H2O
infourok.ru
Составление уравнений окислительно-восстановительных реакций. Видеоурок. Химия 9 Класс
Данный урок раскрывает возможность использования метода электронного баланса для составления уравнений окислительно-восстановительных реакций. Рассмотрены примеры расстановки коэффициентов в уравнениях некоторых окислительно-восстановительных реакций с участием сложных веществ.
Тема: Окислительно-восстановительные реакции
Урок: Составление уравнений окислительно-восстановительных реакций
При составлении уравнений окислительно-восстановительных реакций следует учесть, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Должен соблюдаться электронный баланс.
В качестве примера рассмотрим реакцию соляной кислоты с перманганатом калия.
Запишем схему данной реакции, зная, что продуктами реакции являются хлорид калия, хлорид марганца, хлор и вода:
HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Расставить коэффициенты в схеме такой реакции методом подбора достаточно сложно. В таком случае используют метод электронного баланса.
Дальше необходимо расставить значения степеней окисления химических элементов и определить, у каких элементов степень окисления изменилась:
+1 -1 +1+7 -2 +1 -1 +2 -1 0 +1 -2
HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Степени окисления поменяли марганец и хлор.
Записываем схемы процессов окисления и восстановления:
+7 +2
Mn +5e = Mn
-1 0
2Cl – 2e = Cl2
(Как правило, простое вещество в полуреакциях окисления или восстановления записывают в молекулярном виде – в данном случае Cl2. Тогда в левой части полуреакции должно быть два атома хлора. Один атом хлора теряет один электрон, а два атома – два электрона.)
Чтобы уравнять число отданных и принятых электронов, домножим первую полуреакцию на 2, а вторую – на 5.
+7 +2
Mn +5e = Mn 2 окислитель, восстанавливается
-1 0
2Cl – 2e = Cl2 5 восстановитель, окисляется
Получаем:
+7 +2
2Mn +10e = 2Mn
-1 0
10Cl – 10e = 5Cl2
Полученные коэффициенты ставим перед соответствующими формулами в правой части уравнения:
HCl + KMnO4 → KCl + 2MnCl2 + 5Cl2 + H2O
Теперь находим коэффициенты для формул всех остальных веществ:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Получили уравнение реакции.
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.68-71)
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Химия. 8-11 классы: тренинги и тесты с ответами по теме «Окислительно-восстановительные реакции» / авт.-сост. Т.М. Солдатова. – Волгоград: Учитель, 2007. (с.12-20)
5. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.55)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (интерактивные задачи по теме) (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
1. №10.46 из «Сборника задач и упражнений по химии для средней школы» И.Г. Хомченко, 2-е изд., 2008 г.
2. №№7.17, 7.26 из сборника задач и упражнений по химии (8-11 классы), автор — А.Д. Микитюк. – М.: Изд. «Экзамен», 2009.
interneturok.ru
Примеры окислительно-восстановительных реакций с решением. ОВР: схемы
Прежде чем приводить примеры окислительно-восстановительных реакций с решением, выделим основные определения, связанные с данными превращениями.
Те атомы или ионы, которые в ходе взаимодействия меняют степень окисления с понижением (принимают электроны), называют окислителями. Среди веществ, обладающих такими свойствами, можно отметить сильные неорганические кислоты: серную, соляную, азотную.
Окислитель
Также к сильным окислителям относятся перманганаты и хроматы щелочных металлов.
Окислитель принимает то количество электронов в ходе реакции, которое необходимо ему до завершения энергетического уровня (установления завершенной конфигурации).

Восстановитель
Любая схема окислительно-восстановительной реакции предполагает выявление восстановителя. К нему относят ионы или нейтральные атомы, способные повышать в ходе взаимодействия показатель степени окисления (отдают электроны иным атомам).
В качестве типичных восстановителей можно привести атомы металлов.
Процессы в ОВР
Чем еще характеризуются ОВР? Окислительно-восстановительные реакции характеризуются изменением степеней окисления у исходных веществ.
Окисление предполагает процесс отдачи отрицательных частиц. Восстановление предполагает принятие их от других атомов (ионов).
Алгоритм разбора
Примеры окислительно-восстановительных реакций с решением предлагаются в различных справочных материалах, предназначенных для подготовки старшеклассников к выпускным испытаниям по химии.
Для того чтобы успешно справиться с предлагаемые в ОГЭ и ЕГЭ заданиями, важно владеть алгоритмом составления и разбора окислительно-восстановительных процессов.
- В первую очередь проставляют зарядовые величины у всех элементов в веществах, предложенных в схеме.
- Выписываются атомы (ионы) из левой части реакции, которые в ходе взаимодействия, поменяли показатели.
- При повышении степени окисления используется знак «-», а при понижении «+».
- Между отданными и принятыми электронами определяется наименьшее общее кратное (число, на которое они делятся без остатка).
- При делении НОК на электроны, получаем стереохимические коэффициенты.
- Расставляем их перед формулами в уравнение.
Первый пример из ОГЭ
В девятом классе далеко не все школьники знают, как решать окислительно-восстановительные реакции. Именно поэтому они допускают множество ошибок, не получают высоких баллов за ОГЭ. Алгоритм действий приведен выше, теперь попробуем отработать его на конкретных примерах.
Особенность заданий, касающихся расстановки коэффициентов в предложенной реакции, выданных выпускникам основной ступени обучения, в том, что и левая, и правая части уравнения даны.
Это существенно упрощает задачу, так как не нужно самостоятельно придумывать продукты взаимодействия, подбирать недостающие исходные вещества.
Например, предлагается с помощью электронного баланса выявить коэффициенты в реакции:
CuO+Fe=FeO+Cu
На первый взгляд, в данной реакции не требуются стереохимические коэффициенты. Но, для того, чтобы подтвердить свою точку зрения, необходимо у всех элементов зарядовые числа.
В бинарных соединениях, к которым относится оксид меди (2) и оксид железа (2), сумма степеней окисления равна нулю, учитывая, что у кислорода она -2, у меди и железа данный показатель +2. Простые вещества не отдают (не принимают) электроны, поэтому для них характерна нулевая величина степени окисления.
Составим электронный баланс, показав знаком «+» и «-» количество принятых и отданных в ходе взаимодействия электронов.
Cu2++2e=Cu0;
Fe0-2e=Fe2+.
Так как количество принятых и отданных в ходе взаимодействия электронов одинаково, нет смысла находить наименьшее общее кратное, определять стереохимические коэффициенты, ставить их в предложенную схему взаимодействия.
Для того чтобы получить за задание максимальный балл, необходимо не только записать примеры окислительно-восстановительных реакций с решением, но и выписать отдельно формулу окислителя (CuO) и восстановителя (Fe).

Второй пример с ОГЭ
Приведем еще примеры окислительно-восстановительных реакций с решением, которые могут встретиться девятиклассникам, выбравшим химию в качестве выпускного экзамена.
Допустим, предлагается расставить коэффициенты в уравнении:
Na+HCl=NaCl+H2.
Для того чтобы справиться с поставленной задачей, сначала важно определить у каждого простого и сложного вещества показатели степеней окисления. У натрия и водорода они будут равны нулю, так как они являются простыми веществами.
В соляной кислоте водород имеют положительную, а хлор — отрицательную степень окисления. После расстановки коэффициентов получим реакцию с коэффициентами.
Как дополнить окислительно-восстановительные реакции? Примеры с решением, встречающиеся на ЕГЭ (11 класс), предполагают дополнение пропусков, а также расстановку коэффициентов.
Например, нужно электронным балансом дополнить реакцию:
H2S+ HMnO4= S+ MnO2 +…
Определите восстановитель и окислитель в предложенной схеме.
Как научиться составлять окислительно-восстановительные реакции? Образец предполагает использование определенного алгоритма.
Сначала во всех веществах, данных по условию задачи, необходимо поставить степени окисления.
Далее нужно проанализировать, какое вещество может стать неизвестным продуктом в данном процессе. Поскольку в здесь присутствует окислитель (в его роли выступает марганец), восстановитель (им является сера), в искомом продукте не меняются степени окисления, следовательно, это вода.
Рассуждая о том, как правильно решать окислительно-восстановительные реакции, отметим, что следующим этапом будет составление электронного соотношения:
Mn+7 принимает 3 e= Mn+4;
S-2 отдает 2e= S0.
Катион марганца является восстановителем, а анион серы – типичный окислитель. Поскольку наименьшим кратным между принятыми и отданными электронами будет 6, получаем коэффициенты: 2, 3.
Последним этапом будет постановка коэффициентов в исходное уравнение.
3H2S+ 2HMnO4= 3S+ 2MnO2+ 4H2O.

Второй образец ОВР в ЕГЭ
Как правильно составить окислительно-восстановительные реакции? Примеры с решением помогут отработать алгоритм действий.
Предлагается методом электронного баланса заполнить пропуски в реакции:
PH3+ HMnO4 = MnO2 +…+…
Расставляем у всех элементов степени окисления. В данном процессе окислительные свойства проявляются марганцем, входящим в состав марганцовой кислоты, а восстановителем должен быть фосфор, меняя свою степень окисления на положительную в фосфорной кислоте.
Согласно сделанному предположению, получаем схему реакции, затем составляем уравнение электронного баланса.
P-3 отдает 8 e и превращается в P+5;
Mn+7 принимает 3e, переходя в Mn+4.
НОК будет 24, поэтому у фосфора должен присутствовать стереометрический коэффициент 3, а у марганца -8.
Ставим коэффициенты в полученный процесс, получаем:
3 PH3+ 8 HMnO4= 8 MnO2+ 4H2O+ 3 H3PO4.

Третий пример из ЕГЭ
Путем электронно-ионного баланса нужно составить реакцию, указать восстановитель и окислитель.
KMnO4+ MnSO4+…= MnO2 +…+ h3SO4.
По алгоритму расставляем у каждого элемента степени окисления. Далее определяем те вещества, что пропущены в правой и левой частях процесса. Здесь дан восстановитель и окислитель, поэтому в пропущенных соединениях степени окисления не меняются. Упущенным продуктом станет вода, а исходным соединением – сульфат калия. Получаем схему реакции, для которой составим электронный баланс.
Mn+2-2 e= Mn+4 3 восстановитель;
Mn+7+3e= Mn+4 2 окислитель.
Записываем коэффициенты в уравнение, суммируя атомы марганца в правой части процесса, так как он относится к процессу диспропорционирования.
2KMnO4+ 3MnSO4+ 2H2O= 5MnO2+ K 2SO4+ 2H2SO4.
Заключение
Окислительно-восстановительные реакции имеют особое значение для функционирования живых организмов. Примерами ОВР являются процессы гниения, брожения, нервной деятельности, дыхания, обмена веществ.
Окисление и восстановление актуальны для металлургической и химической промышленности, благодаря таким процессам можно восстанавливать металлы из их соединений, защищать от химической коррозии, подвергать обработке.
Для составления окислительно-восстановительного процесса в органической или неорганической химии необходимо использовать определенный алгоритм действий. Сначала в предложенной схеме расставляют степени окисления, потом определяют те элементы, которые повысили (понизили) показатель, записывают электронный баланс.
Далее между принятыми и отданными электронами необходимо определить наименьшее кратное, вычислить математическим путем коэффициенты.
При соблюдении последовательности действий, предложенной выше, можно без проблем справиться с заданиями, предлагаемыми в тестах.
Помимо метода электронного баланса, расстановка коэффициентов возможна также путем составления полуреакций.
fb.ru
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение. Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
- Далее определим какие из соединений являются окислителем и восстановителем; найдем их степень окисления в начале и конце реакции:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
- Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 ¦ 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 ¦ 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
- Далее надо уравнять количества атомов элементов, не изменяющих степень окисления, в такой последовательности: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
- Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления. При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы: H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
- Запишем уравнение в ионном виде, сократив те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
- Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+, образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
- Находим коэффициент для окислителя и восстановителя, учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O ¦2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ ¦5 восстановитель, процесс окисления
- Затем необходимо просуммировать обе полуреакции, предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
- Запишем молекулярное уравнение, которое имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— ¦2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O ¦3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2 MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
И еще один пример — составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 ¦2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O ¦1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
zadachi-po-khimii.ru