Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl 3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
 Химические свойства солей
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Соли в химии ⚗️ определение, классификация, структурные формулы, виды, химические и физические свойства, получение и применение, номенклатура, с чем взаимодействуют

Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.

Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами.

- Средние.
- Кислые.
- Основные.
- Двойные или смешанные.
- Комплексные.
- Кристаллогидраты.
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония Nh5. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная h3SO4 (сульфаты) и сернистая h3SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- Kh3PO4 — дигидрофосфат калия.

Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (Nh4)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (h3O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].

Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10h3O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2h3O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5h3O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства

Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами

Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + h3SO4 → MgSO4 + 2h3O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → h3SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.

Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (Nh5)2SO4 + 2KOH → 2h3O + K2SO4 + 2Nh4↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + h3O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:

- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
nauka.club
Соли — классификация, получение и свойства » HimEge.ru
Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)2 – CaOHCl;
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl2 + H2O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
K2[Zn(OH)4] + 4HBr изб = 2KBr + ZnBr2 + 4H2O
K3[Cr(OH)6] + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)4] = KAlO2 + 2H2O
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3↓
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3↓
Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
himege.ru
10. Соли, их классификация, номенклатура, получение, химические свойства.
Солями называются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие типы солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 и т. д.
3. Основные соли можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей.
Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например,Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], Cu(NH3)4](OH)2
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Способы получения солей
Взаимодействие металла с кислотой.
Zn + 2HCl = ZnCl2 + H2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Взаимодействие основного оксида с кислотой
CaO + 2HCl = CaCl2 + 2H2O
FeO + H2SO4 = FeSO4 + H2O
Взаимодействие основания с кислотой (реакция нейтрализации).
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + H2O
При неполной нейтрализации кислоты основанием образуется кислая соль:
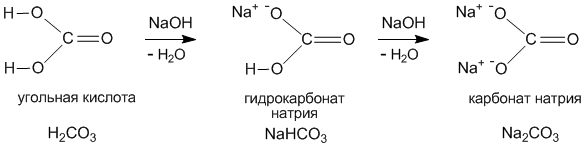
H2SO4 + NaOH = NaHSO4 + H2O
Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль. Для осуществления этой реакции необходимо, что бы взятая кислота была сильнее образующейся или менее летучей.
2NaCl + H2So4 = Na2SO4 + 2HCl↑
Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли:
Na2SO4 + H2SO4 = 2NaHSO4
CaCO3 + CO2 + H2O = Ca(HCO3)2
Взаимодействие основного оксида с кислотным оксидом.
CaО + SiО2 = CaSiO3
Взаимодействие основания с кислотным оксидом
6NaOH + P2O5 = 2Na3PO4 + 3H2O
Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции.
CaCO3 + SiO2 =t CaSiO3 + CO2 ↑
Взаимодействие соли с основанием. Этим способом можно получить как средние соли, так и, при недостатке основания, основные соли. Кислые соли, взаимодействуют с основанием, переходят в средние:
Fe(NO3)3 + 3NaOH = 3NaNo3 + Fe(OH)3 ↓
ZnCl2 + KOH = ZnOHCl + KCl
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Взаимодействие между двумя солями. Образуются две новые соли. Реакция протекает до конца лишь в том случае, если одна из образующихся солей выпадает в осадок:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
AgNO3 + KJ = AgI↓ + KNO3
Взаимодействие между металлом и солью. Вступивший в реакцию металл должен находится в ряду напряжения металлов левее металла, входящего в состав исходной соли.
Fe + CuSO4 = FeSO4 + Cu
Взаимодействие металла с неметаллом
2Fe + 3Cl2= 2FeCl3
Взаимодействие металла со щелочью.
Zn
+ 2NaOHкр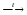 Na2ZnO2 + H2 ↑
Na2ZnO2 + H2 ↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
Взаимодействие металла со щелочью
Cl2 + 2KOH = KCl + KClO + H2O
Взаимодействие неметалла с солью.
Cl2 + KJ = 2KCl + J2
Термическое разложение солей.
2KNO3 2KNO2 + O2↑
2KNO2 + O2↑
2KClO32KCl + 3O2↑
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
studfile.net
Химические свойства солей — урок. Химия, 8–9 класс.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl→Na++Cl−.При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al2SO43→2Al3++3SO42−.2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.
Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Видеофрагмент:
взаимодействие сульфата меди(\(II\)) с железом |
При взаимодействии хлорида меди(\(II\)) с алюминием образуются хлорид алюминия и медь:
2Al+3CuCl2→2AlCl3+3Cu↓.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl2+h3SO4→BaSO4↓+2HCl.
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
CaCO3+2HCl→CaCl2+h3O+CO2↑⏟h3CO3.
Видеофрагмент:
Взаимодействие кислот с солями |
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля(\(II\)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля(\(II\)):
NiNO32+2NaOH→NiOh3↓+2NaNO3.
Видеофрагмент:
Взаимодействие нитрата никеля(\(II\)) с гидроксидом натрия |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na2CO3+CaOh3→2NaOH+CaCO3↓.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Na2S+2AgNO3→NaNO3+Ag2S↓.
Видеофрагмент:
Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
BaNO32+K2SO4→2KNO3+BaSO4↓.
6. Некоторые соли при нагревании разлагаются.
Причём химические реакции, которые протекают при этом, можно условно разделить на две группы:
- реакции, в ходе которых элементы не изменяют степень окисления,
- окислительно-восстановительные реакции.
A. Реакции разложения солей, протекающие без изменения степени окисления элементов.
В качестве примеров таких химических реакций рассмотрим, как протекает разложение карбонатов.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
CaCO3⇄t°CaO+CO2↑.
Видеофрагмент:
| Разложение мела при нагревании |
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:
2NaHCO3⇄t°Na2CO3+h3O+CO2↑.
Видеофрагмент:
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(\(II\)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди(\(II\)):
CuSO4⋅5h3O→t°CuSO4+5h3O.
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO4+5h3O→CuSO4⋅5h3O
Видеофрагмент:
| Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
CaSO4⋅0,5h3O+1,5h3O→CaSO4⋅2h3O
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Окислительно-восстановительные процессы протекают при разложении нитратов.
Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:
2KN+5O−23⟶t°2KN+3O2+O2↑0
Видеофрагмент:
Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца(\(IV\)):
2KMn+7O−24⟶t°K2Mn+6O4+Mn+4O2+O2↑0
www.yaklass.ru
Соли. Названия и классификация солей.
В предыдущих разделах постоянно встречались реакции, в которых образуются соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 4.6. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Таблица 4-6. Построение названий солей.
Соль какой кислоты | Кислот-ный остаток | Валент-ность остатка | Название солей | Примеры |
Азотная HNO3 | NO3 | I | нитраты | Ca(NO3)2 нитрат кальция |
Кремниевая H2SiO3 | SiO32 | II | силикаты | Na2SiO3 силикат натрия |
Серная H2SO4 | SO42 | II | сульфаты | PbSO4 сульфат свинца |
Угольная H2CO3 | CO32 | II | карбонаты | Na2CO3карбонат натрия |
Фосфорная H3PO4 | PO43 | III | фосфаты | AlPO4 фосфат алюминия |
Бромоводородная HBr | Br | I | бромиды | NaBr бромид натрия |
Иодоводородная HI | I | I | иодиды | KI иодид калия |
Сероводородная H2S | S2 | II | сульфиды | FeS сульфид железа (II) |
Соляная HCl | Cl | I | хлориды | NH4Cl хлорид аммония |
Фтороводородная HF | F | I | фториды | CaF2 фторид кальция |
Из таблицы 4-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид».
В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит».Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 4-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
H2SO3 | + | 2 NaOH | = | Na2SO3 | + | 2 H2O |
|
|
|
| сульфит натрия (средняя соль) |
|
|
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
H2SO3 | + | NaOH | = | NaHSO3 | + | H2O |
|
|
|
| гидросульфит натрия (кислая соль) |
|
|
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 H2O |
|
|
|
| хлорид магния(средняя соль) |
|
|
Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | H2O |
|
|
|
| гидроксохлорид магния(основная соль) |
|
|
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Однокислотные основания таких солей образовать не могут.
В таблице 4.6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 4.7).
Таблица 4.7. Международные, русские и традиционные названия некоторых важных солей.
Соль | Международное название | Русское название | Традиционное название | Применение |
Na2CO3 | Карбонат натрия | Натрий углекислый | Сода | В быту – как моющее и чистящее средство |
NaHCO3 | Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода | Пищевой продукт: выпечка кондитерских изделий |
K2CO3 | Карбонат калия | Калий углекислый | Поташ | Применяется в технике |
Na2SO4 | Сульфат натрия | Натрий сернокислый | Глауберова соль | Лекарственное средство |
MgSO4 | Сульфат магния | Магний сернокислый | Английская соль | Лекарственное средство |
KclO3 | Хлорат калия | Калий хлорнова-токислый | Бертолетова соль | Применяется в зажигательных смесях для головок спичек |
Например, ни в коем случае нельзя путать соду Na2CO3 и питьевую соду NaHCO3. Если нечаянно использовать в пищу соду вместо питьевой соды, можно получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода– вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.

Приведем строение и название основной соли, формула которой выглядит: [Fe(OH)2]2CO3 – дигидроксокарбонат железа (III). При рассмотрении структурной формулы такой соли становится ясно, что эта соль –продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:

studfile.net
Что такое соль? Формула, свойства соли (химия) :: SYL.ru
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.

Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
MenmКислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.

По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.

Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
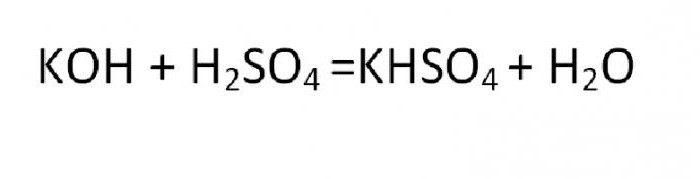
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
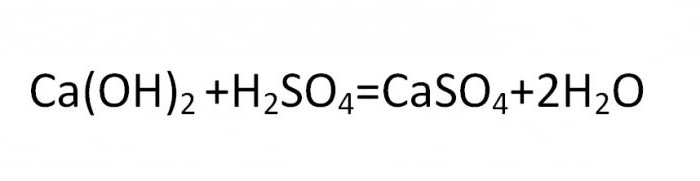
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН—. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.
 Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3—,HCO3 — = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН— . Например, диссоциация хлорида гидроксомагния протекает следующим образом:
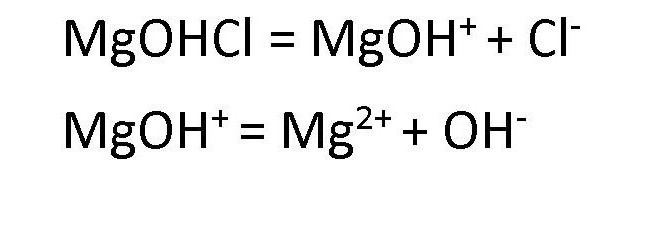
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
www.syl.ru