Хром — Википедија
 Хромиови кристали | |||||||||||||||
| Општи својства | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | хром (Cr) | ||||||||||||||
| Изглед | металик сребрена | ||||||||||||||
| Хромот во периодниот систем | |||||||||||||||
| Атомски број | 24 | ||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 51.9961(6)[1] | ||||||||||||||
| Категорија | преоден метал | ||||||||||||||
| Група и блок | група 6, d-блок | ||||||||||||||
| Периода | IV периода | ||||||||||||||
| Електронска конфигурација | [Ar] 3d5 | ||||||||||||||
по обвивка | 2, 8, 13, 1 | ||||||||||||||
| Физички својства | |||||||||||||||
| Фаза | цврста | ||||||||||||||
| Точка на топење | 2.180 K (1.907 °C) | ||||||||||||||
| Точка на вриење | 2.944 K (2.671 °C) | ||||||||||||||
| Густина близу с.т. | 7,19 г/см3 | ||||||||||||||
| кога е течен, при т.т. | 6,3 г/см3 | ||||||||||||||
| Топлина на топење | 21 kJ/mol | ||||||||||||||
| Топлина на испарување | 347 kJ/mol | ||||||||||||||
| Моларен топлински капацитет | 23,35 J/(mol·K) | ||||||||||||||
парен притисок
| |||||||||||||||
| Атомски својства | |||||||||||||||
| Оксидациони степени | 6, 5, 4, 3, 2, 1, −1, −2, −4 (во зависност од оксидационата состојба, киселински, базичен, или амфотеричен оксид) | ||||||||||||||
| Електронегативност | Полингова скала: 1,66 | ||||||||||||||
| Енергии на јонизација | I: 652,9 kJ/mol II: 1.590,6 kJ/mol II: 2.987 kJ/mol (повеќе) | ||||||||||||||
| Атомски полупречник | емпириски: 128 пм | ||||||||||||||
| Ковалентен полупречник | 139±5 пм | ||||||||||||||
 Спектрални линии на хром Спектрални линии на хром | |||||||||||||||
| Разни податоци | |||||||||||||||
телоцентрична коцкеста (тцк)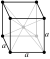 | |||||||||||||||
| Брзина на звукот тенка прачка | 5.940 м/с (при 20 °C) | ||||||||||||||
| Топлинско ширење | 4,9 µм/(m·K) (при 25 °C) | ||||||||||||||
| Топлинска спроводливост | 93,9 W/(m·K) | ||||||||||||||
| Електрична отпорност | 125 nΩ·m (при 20 °C) | ||||||||||||||
| Магнетно подредување | антиферомагнетно (односно: СГБ)[2] | ||||||||||||||
| Модул на растегливост | 279 GPa | ||||||||||||||
| Модул на смолкнување | 115 GPa | ||||||||||||||
| Модул на збивливост | 160 GPa | ||||||||||||||
| Поасонов сооднос | 0,21 | ||||||||||||||
| Викерсова тврдост | 1.060 MPa | ||||||||||||||
| Бринелова тврдост | 687–6.500 MPa | ||||||||||||||
| CAS-број | 7440-47-3 | ||||||||||||||
| Историја | |||||||||||||||
| Откриен и првпат издвоен | Луј Никола Воклен (1797, 1798) | ||||||||||||||
| Најстабилни изотопи | |||||||||||||||
| Главна статија: Изотопи на хромот | |||||||||||||||
| Режимите на распад во загради се предвидени, но сè уште не се забележани | |||||||||||||||
| | наводи | Википодатоци | |||||||||||||||
Хром е хемиски елемент со симбол Cr и атомски број 24. Тоа е првиот елемент во групата 6 . Тоа е старо-сив, сјаен , тврд и кршлив преоден метал . [3] Хромот може да се пофали со висока стапка на употреба како метал кој може да биде високо полиран додека отпорен на оцрнување . Хромот е исто така главниот додаток во нерѓосувачки челик , популарна челична легура поради невообичаено високиот спектрален одраз . Едноставниот полиран хром одразува речиси 70% од видливиот спектар , при што се рефлектираат речиси 90% инфрацрвени светлосни бранови.
Ферохромиевата легура е комерцијално произведена од хромит со силикотермични или алуолетермични реакции и хром метали со печење и процеси на истекување проследено со редукција со јаглерод, а потоа и со алуминиум . Хром метал е од висока вредност за неговата висока отпорност на корозија и цврстина . Главен развој во производството на челик беше откривањето дека челикот може да се направи високо отпорен на корозија и промена на бојата со додавање на метален хром за да се формира нерѓосувачки челик . Нерѓосувачкиот челик и хромирањето ( електроплирање со хром) заедно сочинуваат 85% од комерцијалната употреба.
Во Соединетите Американски Држави, тривалентен хром (Cr (III)) јон се смета за суштински нутриент кај луѓето за инсулин , шеќер и липиден метаболизам .
[6] Сепак, во 2014 година, Европската агенција за безбедност на храната , постапувајќи за Европската унија, заклучи дека нема доволно докази дека хром треба да се препознае како суштина. [7]Додека хром металот и Cr (III) јоните не се сметаат за токсични, хексавалентен хром (Cr (VI)) е токсичен и канцероген . Напуштените места за производство на хром често бараат чистење на животната средина .
Атомски[уреди | уреди извор]
Хром е четвртиот преоден метал што се наоѓа на периодниот систем и има електронска конфигурација на [Ar]3d54s1 . Тоа е, исто така, првиот елемент во периодниот систем, чија основна електронска конфигурација го нарушува принципот Ауфбау . Ова се случува повторно подоцна во периодниот систем со други елементи и нивните електронски конфигурации, како што се бакар , ниобиум и молибден . [8] Ова се случува бидејќи електроните во истата орбитала се одвратуваат едни со други поради нивните слични обвиненија. Во претходните елементи, енергетскиот трошок за промовирање на електрони до следното повисоко ниво на енергија е премногу голем за да се компензира за ослободеното од меѓуэлектронското одбивање. Меѓутоа, во 3d транзициските метали, енергетскиот јаз помеѓу подповршината 3d и следната повисока 4s е многу мал, и бидејќи 3d подслојот е покомпактен од подслоевите 4s, меѓуелектронското одбивање е помало помеѓу 4s електрони отколку помеѓу 3d електрони. Ова го намалува енергетскиот трошок за промоција и ја зголемува енергијата што ја ослободува, така што промоцијата станува енергетски изводлива, а еден или дури два електрони секогаш се промовираат во потсек 4-ти. (Слични промоции се случуваат за секој атом на преоден метал освен еден, паладиум . )
Хромот е првиот елемент во 3d серијата каде што 3d електроните започнуваат да тонат во инертно јадро ; тие на тој начин придонесуваат помалку за металното врзување , а оттаму точките на топење и вриење и енталпијата на атомизација на хром се пониски од оние на претходниот елемент, ванадиум . Хром (VI) е силно оксидирачко средство за разлика од молибден (VI) и волфрам (VI) оксиди.
[10]Целовитост[уреди | уреди извор]
 Примерок од чист метален хром
Примерок од чист метален хромХромот е многу цврст , и е трет најцврст елемент зад јаглеродот ( дијамант ) и бор . Неговата цврстина на Мос е 8,5, што значи дека може да гребе примероци од кварц и топаз , но може да биде изгребан од корунд . Хром е многу отпорен на оцрнување , што го прави корисен како метал што го задржува својот најоддалечен слој од корозија , за разлика од другите метали како што се бакар , магнезиум и алуминиум .
Хромот има точка на топење од 1907 °C (3465 °F), што е релативно ниско во споредба со повеќето транзициони метали. Сепак, тој сè уште ја има втората највисока точка на топење од сите елементи на Период 4 , со што ванадиум е на врвот со разлика 3 °C (5 °F) на температура од 1910 °C (3470 °F). Точката на вриење на 2671 °C (4840 °F), сепак, е релативно помал, со трета најниска точка на вриење надвор од Периодот 4 преодни метали сам
Хромот има невообичаено висока зрачна рефлексија во споредба со онаа на другите транзициски метали. Во 425 μm , се покажа дека хром има релативно максимум одраз на околу 72% рефлексија, пред да влезе во намалување на рефлексивноста, достигнувајќи минимум 62% рефлектанса на 750 μm пред повторно да се издигне и да се рефлектира приближно 90% од 4000 μm инфрацрвени бранови . [4] . Кога хром е формиран во легура од не’рѓосувачки челик и полиран , зрачената рефлексија се намалува со вклучување на дополнителни метали, но сепак е прилично висока во споредба со другите легури. Помеѓу 40% и 60% од видливиот спектар се рефлектира од полиран нерѓосувачки челик.
[4] Објаснувањето за тоа зошто хром покажува толку висок одѕив на рефлектираните фотонски бранови воопшто, особено 90% од инфрацрвените бранови што се рефлектираат, може да се припишат на магнетните својства на хром. [11] Хром има уникатни магнетни својства во смисла дека хром е единствената елементарна цврстина која покажува антиферромагнетско наредување на собна температура (и подолу). Над 38 °C, неговото магнетно нарачување се менува на парамагнетно . . Антиферромагнетните својства, кои предизвикуваат хромовите атоми привремено да се јонизираат и поврзуваат со себе, се присутни затоа што магнетните својства на телото-центрични кубици се диспропорционални на периодичноста на решетката . Ова се должи на фактот дека магнетните моменти на аглите на коцката и центрите на коцка не се еднакви, но се уште се антипаралелни. [11] Оттука, фреквентно-зависната релативна диелектричност на хром, која произлегува од Максвеловите равенки во врска со неговата антиферромагнитност , го остава хромот со највисоки инфрацрвени и видливи светлосни рефлектирања на познатите хемиски елементи.Пасивација[уреди | уреди извор]
Хром металот оставен во воздухот се пасивира со оксидација, формирајќи тенок, заштитен, површински слој. Овој слој е шпинел структура, со дебелина на неколку молекули. Тој е многу густ и го спречува дифузирањето на кислородот во основниот метал. Ова е различно од сунѓерестиот оксид кој се формира на железо и јаглероден челик, преку кој елементарен кислород продолжува да мигрира, достигнувајќи го основниот материјал за да предизвика понатамошно рѓосување . [13] Пасивацијата може да се зголеми со краток контакт со оксидирачки киселини како
Алюминий — Википедия
| Алюминий | |
|---|---|
| ← Магний | Кремний → | |
| мягкий, лёгкий и пластичный металл серебристо-белого цвета. | |
 Алюминий | |
| Название, символ, номер | Алюминий / Aluminium (Al), 13 |
| Группа, период, блок | 13, 3, |
| Атомная масса (молярная масса) | 26,9815386(8)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p1 |
| Электроны по оболочкам | 2, 8, 3 |
| Радиус атома | 143 пм |
| Ковалентный радиус | 121 ± 4 пм |
| Радиус Ван-дер-Ваальса | 184 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность | 1,61 (шкала Полинга) |
| Электродный потенциал | −1,66 В |
| Степени окисления | 0; +3 |
| Энергия ионизации | 1‑я: 577,5 (5,984) кДж/моль (эВ) 2‑я: 1816,7 (18,828) кДж/моль (эВ) |
| Термодинамическая фаза | Твёрдое вещество |
| Плотность (при н. у.) | 2,6989 г/см³ |
| Температура плавления | 660 °C, 933,5 K |
| Температура кипения | 2518,82 °C, 2792 K |
| Уд. теплота плавления | 10,75 кДж/моль |
| Уд. теплота испарения | 284,1 кДж/моль |
| Молярная теплоёмкость | 24,35[2] 24,2[3] Дж/(K·моль) |
| Молярный объём | 10,0 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,050 Å |
| Температура Дебая | 394 K |
| Теплопроводность | (300 K) 237 Вт/(м·К) |
| Скорость звука | 5200 м/с |
| Номер CAS | 7429-90-5 |
 | |
| 13 | Алюминий |
| 3s23p1 | |
 Кодовый символ, указывающий, что алюминий может быть вторично переработан
Кодовый символ, указывающий, что алюминий может быть вторично переработанАлюми́ний (Al, лат. aluminium) — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Название элемента образовалось от лат. alumen — квасцы[4].
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. Он восстановил хлорид этого элемента амальгамой калия при нагревании и выделил металл. Позже способ Эрстеда был улучшен Фридрихом Вёлером, он использовал для восстановления хлорида алюминия до металла чистый металлический калий и он же описал химические свойства алюминия.
Впервые полупромышленным способом алюминий получил в 1854 г. Сент-Клер Девиль по методу Вёлера, заменив калий на более безопасный натрий. Год спустя на Парижской выставке 1855 г. он продемонстрировал слиток металла, а в 1856 г. получил алюминий электролизом расплава двойной соли хлорида алюминия-натрия.
До развития широкомасштабного промышленного электролитического способа получения алюминия из глинозема этот металл был дороже золота. В 1889 году британцы, желая почтить богатым подарком русского химика Д. И. Менделеева, подарили ему аналитические весы, у которых чашки были изготовлены из золота и алюминия[5][6].
В России алюминий назвали в то время «серебром из глины», так как главной составной частью глины является глинозём Al2O3. Промышленный способ получения металла электролизом расплава Al2O3 в криолите разработали независимо друг от друга Ч. Холл и П. Эру в 1886 г.
Соединения алюминия, например, двойная соль алюминия и калия — квасцы KAl(SO4)2 • 12H2O — известны и использовались с глубокой древности.
Распространённость[править | править код]
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %[7].
Природные соединения алюминия[править | править код]
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
- Каолинит — Al2O3·2SiO2 · 2H2O
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия[8].
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л[9].
Изотопы алюминия[править | править код]
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Ar протонами космических лучей с высокими энергиями.
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия до металла из природных оксидов и алюмосиликатов более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления всех его руд, например таких, как бокситы, корунды.
Обычное восстановление до металла обжигом оксида с углеродом (как например, в металлургических процессах восстановления железа) — невозможно, так как сродство к кислороду у алюминия выше, чем у углерода.
Возможно получение алюминия посредством неполного восстановления алюминия с образованием промежуточного продукта — карбида алюминия Al4C3, который далее подвергается разложению при 1900—2000 °С с образованием металлического алюминия. Этот способ производства алюминия изучается, предполагается, что он более выгоден, чем классический электролитический способ производства алюминия процесс Холла — Эру[en], так как требует меньших энергозатрат и приводит к образованию меньшего количества CO2[10].
Современный метод получения, процесс Холла — Эру[en], был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии и поэтому получил промышленное применение только в XX веке.
Электролиз в расплаве криолита:
- 2Al2O3→Na3[AlF6]4Al+3O2{\displaystyle {\mathsf {2Al_{2}O_{3}{\xrightarrow {Na_{3}[AlF_{6}]}}4Al+3O_{2}}}}
Для производства 1000 кг чернового алюминия требуется 1920 кг глинозёма, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодных графитовых электродов и около 17 МВт·ч электроэнергии (~61 ГДж)[11].
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):
- AlCl3+3K→3KCl+Al{\displaystyle {\mathsf {AlCl_{3}+3K\rightarrow 3KCl+Al}}}
 Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм
Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм- Металл серебристо-белого цвета, лёгкий
- плотность — 2712 кг/м³
- температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
- удельная теплота плавления — 390 кДж/кг
- температура кипения — 2518,8 °C
- удельная теплота испарения — 10,53 МДж/кг
- удельная теплоёмкость — 897 Дж/кг·K[3]
- временное сопротивление литого алюминия — 10—12 кг/мм², деформируемого — 18—25 кг/мм², сплавов — 38—42 кг/мм²
- Твёрдость по Бринеллю — 24—32 кгс/мм²
- высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
- Модуль Юнга — 70 ГПа
- Коэффициент Пуассона — 0,34
- Алюминий обладает высокой электропроводностью (37·106См/м — 65 % от электропроводности меди) и теплопроводностью (203,5 Вт/(м·К)), обладает высокой светоотражательной способностью.
- Слабый парамагнетик.
- Температурный коэффициент линейного расширения 24,58⋅10−6 К−1 (20—200 °C).
- Удельное сопротивление 0,0262—0,0295 Ом·мм²/м
- Температурный коэффициент электрического сопротивления 4,3⋅10−3 K−1. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Гидроксид алюминияПри нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с O2, HNO3 (без нагревания), H2SO4(конц), но легко реагирует с HCl и H2SO4(разб). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов[12].
Легко реагирует с простыми веществами:
- 4Al+3O2→2Al2O3{\displaystyle {\mathsf {4Al+3O_{2}\rightarrow 2Al_{2}O_{3}}}}
- 2Al+3Hal2→2AlHal3(Hal=Cl,Br,I){\displaystyle {\mathsf {2Al+3Hal_{2}\rightarrow 2AlHal_{3}(Hal=Cl,Br,I)}}}
- 2Al+3F2→2AlF3{\displaystyle {\mathsf {2Al+3F_{2}\rightarrow 2AlF_{3}}}}
- 2Al+3S→Al2S3{\displaystyle {\mathsf {2Al+3S\rightarrow Al_{2}S_{3}}}}
- 2Al+N2→2AlN{\displaystyle {\mathsf {2Al+N_{2}\rightarrow 2AlN}}}
- 4Al+3C→Al4C3{\displaystyle {\mathsf {4Al+3C\rightarrow Al_{4}C_{3}}}}
Сульфид и карбид алюминия полностью гидролизуются:
- Al2S3+6h3O→2Al(OH)3+3h3S{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}+3H_{2}S}}}
- Al4C3+12h3O→4Al(OH)3+3Ch5{\displaystyle {\mathsf {Al_{4}C_{3}+12H_{2}O\rightarrow 4Al(OH)_{3}+3CH_{4}}}}
Со сложными веществами:
- с водой (после удаления защитной оксидной плёнки, например, амальгамированием или растворами горячей щёлочи):
- 2Al+6h3O→2Al(OH)3↓+3h3↑{\displaystyle {\mathsf {2Al+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}\uparrow }}}
- с парами воды (при высокой температуре):
- 2Al+3h3O→t∘Al2O3+3h3{\displaystyle {\mathsf {2Al+3H_{2}O{\xrightarrow {t^{\circ }}}Al_{2}O_{3}+3H_{2}}}}
- со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}}}}
- 2Al+6NaOH→2Na3AlO3+3h3{\displaystyle {\mathsf {2Al+6NaOH\rightarrow 2Na_{3}AlO_{3}+3H_{2}}}}
- Легко растворяется в соляной и разбавленной серной кислотах:
- 2Al+6HCl→2AlCl3+3h3{\displaystyle {\mathsf {2Al+6HCl\rightarrow 2AlCl_{3}+3H_{2}}}}
- 2Al+3h3SO4→Al2(SO4)3+3h3{\displaystyle {\mathsf {2Al+3H_{2}SO_{4}\rightarrow Al_{2}(SO_{4})_{3}+3H_{2}}}}
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
- 2Al+6h3SO4→Al2(SO4)3+3SO2+6h3O{\displaystyle {\mathsf {2Al+6H_{2}SO_{4}\rightarrow Al_{2}(SO_{4})_{3}+3SO_{2}+6H_{2}O}}}
- Al+6HNO3→Al(NO3)3+3NO2+3h3O{\displaystyle {\mathsf {Al+6HNO_{3}\rightarrow Al(NO_{3})_{3}+3NO_{2}+3H_{2}O}}}
- 8Al+3Fe3O4→4Al2O3+9Fe{\displaystyle {\mathsf {8Al+3Fe_{3}O_{4}\rightarrow 4Al_{2}O_{3}+9Fe}}}
- 2Al+Cr2O3→Al2O3+2Cr{\displaystyle {\mathsf {2Al+Cr_{2}O_{3}\rightarrow Al_{2}O_{3}+2Cr}}}
 Производство алюминия в миллионах тонн
Производство алюминия в миллионах тоннДостоверных сведений о получении алюминия до XIX века нет. Встречающееся иногда со ссылкой на «Естественную историю» Плиния утверждение, что алюминий был известен при императоре Тиберии, основано на неверном толковании источника[14].
В 1825 году датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей плёнкой оксида алюминия.[источник не указан 701 день]
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии[15]) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путём в период с 1854 по 1890 год.[источник не указан 701 день]
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозёма, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозёма внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.[источник не указан 701 день]
Первый алюминиевый завод в России был построен в 1932 году в городе Волхов. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс. тонн алюминия, ещё 2,2 тыс. тонн импортировалось.[источник не указан 701 день]
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.[источник не указан 701 день]
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в
Монетные металлы — Википедия
| Частный символ | Металл / Сплав | Состав сплава | Пример использования | ||
|---|---|---|---|---|---|
| AV — золото и сплавы на его основе | |||||
| AV / AU | Высокопробное золото | Au | Золото с небольшой долей примесей, обусловленной уровнем развития металлургии соответствующей эпохи (в настоящее время — до 0,01 %)[2][3] |  |   |
| Золотой дарик. Империя Ахеменидов (Персия), V век до н. э. | |||||
| AV / AU | Дукатное золото | Au… | Сплав, содержащий 98,5 % золота[2] |  | |
| Дукат | |||||
| AV / AU | Червонное золото | AuCu | Сплав золота (от 90 %) с медью, применявшийся в Российской империи для изготовления червонцев[4] | ||
| Червонец. Российская империя, начало XVIII века | |||||
| AV / AU | Кроновое золото[en] англ. Crown gold | AuCu (AuAg) | Сплав золота (22 карата, 91,67 %) с медью и/или с серебром (2 карата)[2][источник не указан 2879 дней] |  | |
| Золотой соверен. Англия | |||||
| AV / AU | Пистольное золото | Au… | Сплав, содержащий 90,6 % золота[2] |  | |
| Золотой пистоль (луидор). Франция | |||||
| EL | Белое золото, электр (электрум) | AuAg (AgAu) | Природный сплав золота (от 16 до 69 %) с серебром[5] |  | |
| Солид (шиллинг) из электра. Княжество Беневенто (Италия), 817—832 годы н. э. | |||||
| AR — серебро и сплавы на его основе | |||||
| AR | Высокопробное, королевское серебро | Ag | Серебро с небольшой долей примесей (как правило, меди), обусловленной уровнем развития металлургии соответствующей эпохи (в средние века — от 4,2 %, в настоящее время — до 0,01 %)[6][7][8] |  |  |
| Серебряная декадрахма. Сиракузы (Древняя Греция), IV век до н. э. | |||||
| AR | Британское серебро[en] англ. Britannia silver | AgCu | Сплав серебра (95,84 %) с медью[источник не указан 2878 дней] | 200x100px | |
| Подпись | |||||
| AR | Стерлинг | AgCu | Английское название сплава серебра (92,5 %) с медью[9][10] |  | |
| Серебряный пенни. Шотландия, 1280—1286 годы | |||||
| BI | Белая медь, биллон (низкопробное серебро) | CuAg | Сплав серебра (менее 50 %) прежде всего с медью[11] | ||
| Биллонное пиззоло. Далмация, XIII век н. э. | |||||
| Æ / AE — медь и сплавы на её основе | |||||
| AE / Æ | Медь | Cu | Медь с небольшой долей примесей, обусловленной уровнем развития металлургии соответствующей эпохи[12][13] |  | |
| Медная полушка. Российская империя, начало XVIII века | |||||
| AE / Æ | Колыванская медь | CuAuAg | Медь с содержанием золота и серебра («…не малое число серебра и знатная частица золота»)[источник не указан 2880 дней] |  | |
| Сибирская монета достоинством 10 копеек, Российская империя, 1777 год | |||||
| AE / Æ | Пушечная бронза (пушечный, артиллерийский металл) | CuSn | Сплав меди (около 90—91 %) с оловом с возможной примесью цинка и свинца, использовавшийся для изготовления пушек, которые в некоторых случаях переплавлялись в монеты[14][источник не указан 2878 дней] | 200x100px | |
| Копия медного пятака. Российская империя, 1757 год (в действительности 1763 год) | |||||
| BR (B) | Античная оловянная бронза | CuSn | Сплав меди (около 88 %) с оловом с возможными примесями железа, кобальта, никеля, свинца, серебра, цинка (его доля не должна превышать долю других металлов) и других металлов[15][14] |  | |
| Бронзовый асс. Древний Рим, III век до н. э. | |||||
 |  | ||||
| Бронзовый квинкункс. Луцерия (Древний Рим), III век до н. з. | |||||
| AE / Æ | Колокольная бронза (колокольный металл) | CuSn | Сплав меди (около 78 %) с оловом с возможной случайной и незначительной примесью серебра, использовавшийся для изготовления колоколов, которые в чрезвычайных обстоятельствах переплавлялись в монеты[16][14] | 200x100px | |
| Подпись | |||||
| AE / Æ | Мышьяковистая бронза | CuAs | Сплав меди с большим содержанием мышьяка[источник не указан 2880 дней] | 200x100px | |
| Меншиков гривенник. Российская империя, 1726 год | |||||
| P | Потин | CuSnPb | Сплав меди с большим содержанием олова, свинца и других металлов[источник не указан 2880 дней] | ||
| Статер из потина. Боспорское царство, 253—254 годы н. э. | |||||
| B | Жёлтая медь, латунь (аурихалк) | CuZn | Сплав меди (56—67 %) с цинком (в древности с цинковой рудой — галмеем) с добавлением других металлов, например, свинца (до 2,5 %)[17][18][19] |  | |
| Латунный сестерций. Древний Рим, 8—14 годы н. э. | |||||
| Прочие металлы и сплавы | |||||
| ? | Сталь | Fe(C) | Сплав железа с добавлением углерода (до 1,7 %)[20] |  | |
| Шесть оболов, составляющих драхму. Древняя Греция | |||||
| ? | Свинец | Pb | |||
| Свинцовая монета. У-ди из династии Хань (Китай), 141-87 до н. э. | |||||
| ? | Пьютер | Sn… | Сплав олова (85—99 %) с такими металлами, как медь, сурьма, висмут или свинец[источник не указан 2880 дней] | 200x100px | |
| Крейцер из пьютера. Богемия, середина XVIII века | |||||
Чёрные металлы — Википедия
Материал из Википедии — свободной энциклопедии
Чёрные мета́ллы (разг. черме́т) — железо и сплавы на его основе (стали, ферросплавы, чугуны). К чёрным металлам также зачастую относят марганец и, иногда, — хром[1][2][3][4] и ванадий[3][4]. Эти металлы используются главным образом при производстве чугунов и сталей. Чёрные металлы составляют более 90 % всего объёма используемых в экономике металлов, из них основную часть составляют различные стали. Основным элементом, придающим сплавам железа разнообразные свойства, является углерод.
- Чугуны — сплавы железа с углеродом, при содержании углерода более 2,14 % (в некоторых чугунах до 6 %). Чугуны делятся на белые, серые и ковкие.
- Стали — сплавы железа с углеродом при содержании углерода менее 2,14 %.
- низкоуглеродистые (меньше 0,25 %),
- углеродистые (0,25—0,6 %),
- высокоуглеродистые (более 0,6 %).
Кроме углерода, в чугунах и сталях содержатся другие компоненты, которые делятся на
- легирующие (для получения чугунов и сталей с требуемыми свойствами — устойчивость к коррозии, упругость, ковкость, термостойкость): кремний, алюминий, марганец, молибден, медь, никель, хром, ванадий, вольфрам и другие;
- вредные примеси: сера, фосфор, мышьяк, кислород, азот[5].
Придание металлу необходимой формы и свойств достигается обработкой давлением и последующей термической обработкой.
- ↑ Налоговый Кодекс Российской Федерации. Статья 337: Добытое полезное ископаемое.
- ↑ Концепции современного естествознания. Учебник для вузов. Под ред. Л. А. Михайлова (с. 173) // Издательский дом «Питер», 2012 — Science — 338 с.
- ↑ 1 2 Ю. А. Быховский. Черные металлы // . — 1961. — С. 23.
- ↑ 1 2 Р. Р. Синанян. Маркшейдерское дело. — M: «Недра», 1982. — С. 97.
- ↑ Линчевский Б. В., Соболевский А. Л., Кальменев А. А. Металлургия черных металлов. — 2-е. — Москва: Металлургия, 1986. — С. 8. — 360 с.
Серебро — Википедия
| Серебро | |
|---|---|
| ← Палладий | Кадмий → | |
| мягкий металл серебристо-белого цвета | |
 Серебро | |
| Название, символ, номер | Серебро / Argentum (Ag), 47 |
| Атомная масса (молярная масса) | 107,8682(2)[2] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s1 |
| Радиус атома | 144 пм |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+2e) 89 (+1e) 126 пм |
| Электроотрицательность | 1,93 (шкала Полинга) |
| Электродный потенциал | +0,799 |
| Степени окисления | 2, 1 |
| Энергия ионизации | 1‑я: 730,5 кДж/моль (эВ) 3‑я: 3361 кДж/моль (эВ) |
| Плотность (при н. у.) | 10,5 г/см³ |
| Температура плавления | 1235,1 К; 962 °C |
| Температура кипения | 2485 К; 2162°C |
| Уд. теплота плавления | 11,95 кДж/моль |
| Уд. теплота испарения | 254,1 кДж/моль |
| Молярная теплоёмкость | 25,36[3] Дж/(K·моль) |
| Молярный объём | 10,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,086 Å |
| Температура Дебая | 225 K |
| Теплопроводность | (300 K) 429 Вт/(м·К) |
| Номер CAS | 7440-22-4 |
| 47 | Серебро |
| 4d105s1 | |
Серебро́ (Ag от лат. Argentum) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47.
Простое вещество серебро — ковкий, пластичный благородный металл серебристо-белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 962 °C, плотность — 10,5 г/см³.
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. Одним из древнейших центров добычи и обработки серебра была доисторическая Сардиния, где оно было известно с раннего энеолита[4].
В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки юбилейных монет (выход из оборота последних серебряных монет в 1960—1970-е годы примерно совпал с кризисом Бреттон-Вудской валютной системы).
Происхождение названия[править | править код]
Славянские названия металла — рус. серебро, польск. srebro, болг. сребро, ст.‑слав. сьребро — восходят к праславянскому *sьrebro, которое имеет соответствия в балтийских (лит. sidabras, др.-прусск. sirablan) и германских (готск. silubr, нем. Silber, англ. silver) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо происхождение от той же основы, что и анатолийское subau-ro «блестящий», либо раннее заимствование из языков Ближнего Востока: ср. аккад. sarpu «очищенное серебро», от аккад. sarapu «очищать, выплавлять», или из доиндоевропейских языков древней Европы: ср. баск. zilar[5].
Греческое название серебра ἄργυρος, árgyros произошло от индоевропейского корня *H₂erǵó-, *H₂erǵí-, означающего «белый, блистающий». Из того же корня происходит и его латинское название — argentum.
Среднее содержание серебра в земной коре (по Виноградову) — 70 мг/т. Максимальные его концентрации устанавливаются в глинистых сланцах, где достигают 1 г/т. Серебро характеризуется относительно низким энергетическим показателем ионов, что обуславливает незначительное проявление изоморфизма этого элемента и сравнительно трудное его вхождение в решётку других минералов. Наблюдается лишь постоянный изоморфизм ионов серебра и свинца. Ионы серебра входят в решётку самородного золота, количество которого иногда достигает в электруме почти 50 % по массе. В небольшом количестве ион серебра входит в решётку сульфидов и сульфосолей меди, а также в состав теллуридов, развитых в некоторых полиметаллических и особенно, в золото-сульфидных и золото-кварцевых месторождениях.
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40—45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1×1×2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде. По этой же причине растворимость серебра выше и его концентрация в морской воде на порядок больше, чем у золота (около 0,04 мкг/л и 0,004 мкг/л соответственно[6]).
Руда серебра, ПриморьеИзвестно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15—20, в том числе:
Как и другим благородным металлам, серебру свойственны два типа проявлений:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Содержание серебра в рудах цветных металлов 10-100 г/т, в золото-серебряных рудах 200—1000 г/т, а в рудах серебряных месторождений 900—2000 г/т, иногда десятки килограммов на тонну.
Серебро встречается и в каустоболитах: торфах, нефти, угле, битуминозных сланцах.
Месторождения[править | править код]
 Производство серебра по странам (2011 год)
Производство серебра по странам (2011 год)Значительные месторождения серебра расположены на территориях следующих стран:
- Армении,
- Германии,
- Испании,
- Перу,
- Чили,
- Мексики,
- Китая,
- Канады,
- США,
- Австралии,
- Польши,
- России,
- Казахстана,
- Румынии,
- Швеции,
- Чехии,
- Словакии,
- Австрии,
- Венгрии,
- Норвегии[7].
Также месторождения серебра есть на Кипре и на Сардинии[8].
 Самородок серебра
Самородок серебраЧистое серебро — довольно тяжёлый (легче свинца, но тяжелее меди, плотность — 10,5 г/см³), необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга в проходящем свете имеет фиолетовый цвет. С течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая плёнка придаёт тогда металлу характерную розоватую окраску. Обладает самой высокой теплопроводностью среди металлов. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов (удельное электрическое сопротивление 1,59⋅10−8 Ом·м при температуре 20 °C). Относительно тугоплавкий металл, температура плавления 962 °C.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
- Ag+2HNO3(conc)=AgNO3+NO2↑+h3O{\displaystyle {\mathsf {Ag+2HNO_{3(conc)}=AgNO_{3}+NO_{2}{\uparrow }+H_{2}O}}}
Растворяется оно и в хлорном железе, что применяется для травления:
- Ag+FeCl3=AgCl+FeCl2{\displaystyle {\mathsf {Ag+FeCl_{3}=AgCl+FeCl_{2}}}}
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
- 4Ag+2h3S+O2=2Ag2S+2h3O{\displaystyle {\mathsf {4Ag+2H_{2}S+O_{2}=2Ag_{2}S+2H_{2}O}}}
В отсутствие кислорода:
- 2Ag+h3S=Ag2S+h3↑{\displaystyle {\mathsf {2Ag+H_{2}S=Ag_{2}S+H_{2}{\uparrow }}}}
Свободные галогены легко окисляют серебро до галогенидов:
- 2Ag+I2=2AgI{\displaystyle {\mathsf {2Ag+I_{2}=2AgI}}}
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются. На этом явлении основан принцип чёрно-белой фотографии.
При нагревании с серой серебро даёт сульфид:
- 2Ag+S=Ag2S{\displaystyle {\mathsf {2Ag+S=Ag_{2}S}}}.
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы также с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
 Серебряная монета
Серебряная монета- Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий (например, контакты реле, ламели), а также многослойных керамических конденсаторов.
- В составе припоев: медносеребряные припои ПСр-72, ПСр-45 и другие, используется для пайки разнообразных ответственных соединений, в том числе разнородных металлов, припои с высоким содержанием серебра используются в ювелирных изделиях, а со средним — в разнообразной технике, от сильноточных выключателей до жидкостных ракетных двигателей, иногда также как добавка к свинцу в количестве 3 % (ПСр-3), им заменяют оловянный припой.
- В составе сплавов: для изготовления катодов гальванических элементов.
- Применяется как драгоценный металл в ювелирном деле (обычно в сплаве с медью, иногда с никелем и другими металлами).
- Используется при чеканке монет (оборотных — до начала 1970-х годов, сейчас — только юбилейных), а также наград — орденов и медалей.
- Галогениды серебра и нитрат серебра используются в фотографии, так как обладают высокой светочувствительностью.
- Иодистое серебро применяется для смены погоды («разгон облаков»).
- Из-за высочайшей электропроводности и стойкости к окислению применяется:
- в электротехнике и электронике как покрытие ответственных контактов и проводников в высокочастотных цепях;
- в СВЧ-технике как покрытие внутренней поверхности волноводов.
- Используется как покрытие для зеркал с высокой отражающей способностью (в обычных зеркалах используется алюминий).
- Часто используется как катализатор в реакциях окисления, например, при производстве формальдегида из метанола, а также эпоксида из этилена.
- Используется как дезинфицирующее вещество, в основном для обеззараживания воды. Ограниченно применяется в виде солей (нитрат серебра) и коллоидных растворов (протаргол и колларгол) как вяжущее средство. В прошлом применение препаратов серебра было значительно шире.
Области применения серебра постоянно расширяются, и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.
Серебро используется в качестве добавки (0,1—0,4 %) к свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов, имеющих очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление.
Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых радарных поверхностей. Кроме того, хлорид серебра, прозрачный в инфракрасной области спектра, используется в инфракрасной оптике.
Монокристаллы фторида серебра используются для генерации лазерного излучения с длиной волны 0,193 мкм (ультрафиолетовое излучение).[прояснить]
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Фосфат серебра используется для варки специального стекла, используемого для дозиметрии излучений. Примерный состав такого стекла: фосфат алюминия — 42 %, фосфат бария — 25 %, фосфат калия — 25 %, фосфат серебра — 8 %.
Перманганат серебра, кристаллический тёмно-фиолетовый порошок, растворимый в воде; используется в противогазах. В некоторых специальных случаях серебро также используется в сухих гальванических элементах следующих систем: хлор-серебряный элемент, бром-серебряный элемент, йод-серебряный элемент.
Серебро зарегистрировано в качестве пищевой добавки Е174.
В медицине[править | править код]
До середины ХХ века нитрат серебра использовался в качестве наружного антисептика под названием ляпис. На свету он разлагается на свободное серебро, диоксид азота и молекулярный кислород. Однако в настоящее время во всех сферах применяется множество значительно более эффективных антисептиков.
Начиная с 1990 года, в нетрадиционной медицине наблюдается возрождение использования коллоидного серебра в качестве средства для лечения многочисленных болезней. В лабораторных исследованиях получены разные результаты: в одних исследований показано, что антимикробное воздействие серебра весьма незначительно, в то время как другие показали, что раствор 5—30 ppm является эффективным против стафилококка и кишечной палочки. Данное противоречие связано с размерами коллоидных наночастиц серебра — чем меньше их размер, тем более выражен антимикробный эффект[9]. Следует отметить, что подобные свойства наночастиц характерны для большинства переходных металлов и связаны с разрушением клеточной мембраны бактерий при сорбции наночастицы. Это, однако, проявляется только в очень чистых растворах.
Серебро — это тяжёлый металл, содержание которого в питьевой воде регламентировано СанПиН 2.1.4.1074-01 «Вода питьевая» — серебру присвоен класс опасности 2, «высоко-опасное и потенциально-токсичное химическое вещество». Госсанэпидемнадзор официально утвердил гигиенические нормативы содержания вредных веществ в питьевой воде, в этих нормативах содержание серебра в питьевой воде ограничено концентрацией 0,05 мг/л[10].
В США и Австралии препараты на основе коллоидного серебра не признаны лекарствами и предлагаются в продовольственных магазинах. Также в изобилии их можно встретить в Интернет-магазинах по всему миру в качестве БАД (биологически активных добавок), более простое название — пищевые добавки. Законом США и Австралии было запрещено маркетологам приписывать медицинскую эффективность коллоидному серебру. Но некоторые сайты, в том числе на их территории, по-прежнему указывают на благотворное воздействие препарата при профилактике простуды и гриппа, а также на лечебное воздействие при более серьёзных заболеваниях, таких, как диабет, рак, синдром хронической усталости, ВИЧ/СПИД, туберкулёз, и другие заболевания. Нет никаких медицинских исследований, свидетельствующих о том, что коллоидное серебро эффективно для какого-либо из этих заявленных симптомов.
До эпохи доказательной медицины растворы солей серебра широко применяли в качестве антисептических и вяжущих средств. На этом свойстве серебра основано действие таких лекарственных препаратов, как протаргол, колларгол и др., представляющих собой коллоидные формы серебра. В настоящее время препараты серебра применяются всё реже в связи с низкой эффективностью.
Следы серебра (порядка 0,02 мг/кг) содержатся в организмах всех млекопитающих, но его биологическая роль недостаточно изучена. Головной мозг человека характеризуется повышенным содержанием серебра (0,03 мг на 1000 г свежей ткани, или 0,002 % по массе в золе). Интересно, что в изолированных ядрах нервных клеток — нейронов — серебра гораздо больше (0,08 % по массе в золе)[11][неавторитетный источник?].
С пищевым рационом человек получает в среднем около 0,1 мг Ag в сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом[11].
Ионы серебра обладают бактериостатическими свойствами. Однако для достижения бактериостатического эффекта концентрацию ионов серебра в воде необходимо повысить настолько, что она становится непригодной для питья. Бактериостатические свойства серебра известны с древности. В VI веке до н. э. персидский царь Кир II Великий в своих военных походах использовал серебряные сосуды для хранения воды. Покрытие поверхностных ран серебряными пластинами практиковалось ещё в древнем Египте. Очистку больших количеств воды, основанную на бактерицидном действии серебра, особенно удобно производить электрохимическим путём[11].
В начале 1970-х годов нижний предел бактериостатического действия серебра оценивался содержанием его в воде порядка 1 мкг/л[11]. По данным 2009 года — нижний предел действия находится на уровне 50—300 мкг/л[9], что уже опасно для человека.
Как и некоторые другие тяжёлые металлы, серебро при избыточном поступлении в организм токсично[11].
По санитарным нормам США содержание серебра в питьевой воде не должно превышать 0,05 мг/л. Согласно действующим российским санитарным нормам серебро (аргентум) относится к «высоко-опасным» хмическим веществам (класс опасности 2 по санитарно-токсикологическому признаку вредности), и предельно допустимая концентрация серебра в питьевой воде составляет те же 0,05 мг/л[10].
При длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся серой окраской слизистых оболочек и кожи[12], причём преимущественно на освещённых участках тела, что обусловлено отложением частичек восстановленного серебра. Какие-либо расстройства самочувствия заболевших аргирией наблюдаются далеко не всегда. Вместе с тем, немедицинскими источниками отмечалось, что они не подвержены инфекционным заболеваниям[11][неавторитетный источник?].
Ионы серебра оказывают генотоксичный эффект, разрушая целостность молекул ДНК в клетках, в том числе вызывая перестройки в хромосомах и фрагментацию последних. Кроме того, исследователи выявили повреждения генов в сперматозоидах[13][неавторитетный источник?].
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае[14].
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, на Крит и в Грецию[15].
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд[15].
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире[15].
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген[15].
Во II—XIII веках действовало множество рудников по всей Европе, которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце, Тироле (главный центр добычи — Швац), Рудных горах, позднее в Силезии, Трансильвании, Карпатах и Швеции. С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек.[16][нет в источнике] Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии[17].
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо[прояснить] и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи)[18].
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения (Нерчинский горный округ)[19]. В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке[17].
В 2008 году[20] всего добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
На 2008 год лидером добычи серебра в России является компания «Полиметалл», добывшая в 2008 году 535 т[21]. В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Мировая добыча серебра (1990-2017) (1990-2007 — данные U.S. Geological Survey[22], 2008-2017 — данные The Silver Institute[23]):
Мировые запасы серебра оцениваются в 505 тыс. т (на 1986 год), подтверждённые — 360 тыс. т[24].
В мифологии многих народов серебру приписываются магические свойства, способность отгонять всяческую нечисть — оборотней, вампиров, злых духов и так далее[источник не указан 1784 дня].
- ↑ 1 2 Wieser M. E., Coplen T. B. Atomic weights of the elements 2009 (IUPAC Technical Report) // Pure and Applied Chemistry — International Union of Pure and Applied Chemistry, 2010. — Vol. 83, Iss. 2. — P. 359–396. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1351/PAC-REP-10-09-14
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047–1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Чукуров П. М. Серебро // Химическая энциклопедия: в 5 т. / Н. С. Зефиров (гл. ред.). — М.:
Вольфрам — Википедия
| Вольфрам | |
|---|---|
| ← Тантал | Рений → | |
| Тугоплавкий прочный металл, стального цвета или белый | |
 | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 В W ← W6+ 0,68 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Плотность (при н. у.) | 19,25[2] г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F)[2] |
| Температура кипения | 5828 K (5555 °C, 10031 °F)[2] |
| Уд. теплота плавления | 285,3 кДж/кг 52,31[3][4] кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27[5] Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,160 Å |
| Температура Дебая | 310 K |
| Теплопроводность | (300 K) 162,8[6] Вт/(м·К) |
| Номер CAS | 7440-33-7 |
| 74 | Вольфрам |
| 4f145d46s2 | |
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W (лат. Wolframium). При нормальных условиях представляет собой твёрдый блестящий серебристо-серый переходный металл[5].
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод, но он существует в жидком виде только при высоких давлениях. При стандартных условиях вольфрам химически стоек.
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — лат. spuma lupi или нем. Wolf Rahm[5][7]. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирал олово как волк овцу»).
В английском и французском языках вольфрам называется tungsten (от швед. tung sten — «тяжёлый камень»). В 1781 году знаменитый шведский химик Карл Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 2563 дня]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 2563 дня]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трёхокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 · mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения[править | править код]
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
 Вольфрамовый порошок
Вольфрамовый порошокПроцесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C)[2]. Плотность чистого вольфрама составляет 19,25 г/см³[2]. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32⋅10−9). Твёрдость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55⋅10−9 Ом·м, при 2700 °C — 904⋅10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжёлых, твёрдых и самых тугоплавких металлов[5]. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддаётся ковке и может быть вытянут в тонкую нить. Металл обладает высокой устойчивостью в вакууме[8].
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот[9]:
- 2W+4HNO3+10HF⟶WF6+WOF4+4NO↑+7h3O{\displaystyle {\mathsf {2W+4HNO_{3}+10HF\longrightarrow WF_{6}+WOF_{4}+4NO\uparrow +7H_{2}O}}}
Реагирует с расплавленными щелочами в присутствии окислителей[10]:
- 2W+4NaOH+3O2⟶2Na2WO4+2h3O{\displaystyle {\mathsf {2W+4NaOH+3O_{2}\longrightarrow 2Na_{2}WO_{4}+2H_{2}O}}}
- W+2NaOH+3NaNO3⟶Na2WO4+3NaNO2+h3O{\displaystyle {\mathsf {W+2NaOH+3NaNO_{3}\longrightarrow Na_{2}WO_{4}+3NaNO_{2}+H_{2}O}}}
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам[править | править код]
 Нить накаливания
Нить накаливания- Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах[11] или более эффективной при равном весе[12]. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др.[13] либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе[14].
Соединения вольфрама[править | править код]
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
Другие сферы применения[править | править код]
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама[15][править | править код]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни[16].
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Известны изотопы вольфрама с массовыми числами от 158 до 192 (количество протонов 74, нейтронов от 84 до 118), и более 10 ядерных изомеров.[17]
Природный вольфрам состоит из смеси пяти изотопов (180W — 0,12(1)%, 182W — 26,50(16) %, 183W — 14,31(4) %, 184W — 30,64(2) % и 186W — 28,43(19) %)[17]. В 2003 открыта[18] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 1,8⋅1018 лет[19].
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 Tungsten: physical properties (англ.). WebElements. Дата обращения 17 августа 2013.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 6-134. — 2828 p. — ISBN 1420090844.
- ↑ См. обзор измерений в: Tolias P. (2017), «Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications», arΧiv:1703.06302
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ Теплофизические свойства вольфрама
- ↑ Большая советская энциклопедия Гл. ред. А. М. Прохоров. — 3-е изд. — М. : Сов. энцикл., 1969 – 1978
- ↑ Титан — металл будущего (рус.).
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ Brian Wheeler. Tungsten Shielding Helps at Fukushima Daiichi (неопр.). Power Engineering Magazine (1 июля 2011).
- ↑ Murata Taisuke, Miwa Kenta, Matsubayashi Fumiyasu, Wagatsuma Kei, Akimoto Kenta, Fujibuchi Toshioh, Miyaji Noriaki, Takiguchi Tomohiro, Sasaki Masayuki, Koizumi Mitsuru. Optimal radiation shielding for beta and bremsstrahlung radiation emitted by 89Sr and 90Y: validation by empirical approach and Monte Carlo simulations // Annals of Nuclear Medicine. — 2014. — 10 мая (т. 28, № 7). — С. 617—622. — ISSN 0914-7187. — DOI:10.1007/s12149-014-0853-6. [исправить]
- ↑ Kobayashi S., Hosoda N., Takashima R. Tungsten alloys as radiation protection materials // Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. — 1997. — Май (т. 390, № 3). — С. 426—430. — ISSN 0168-9002. — DOI:10.1016/S0168-9002(97)00392-6. [исправить]
- ↑ Soylu H. M., Yurt Lambrecht F., Ersöz O. A. Gamma radiation shielding efficiency of a new lead-free composite material // Journal of Radioanalytical and Nuclear Chemistry. — 2015. — 17 марта (т. 305, № 2). — С. 529—534. — ISSN 0236-5731. — DOI:10.1007/s10967-015-4051-3. [исправить]
- ↑ по данным «Цены на вольфрам»
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь // Палеонтологический журнал. — 2003. — № 6. — С. 33—40
- ↑ 1 2 Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — DOI:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.
- ↑ F. A. Danevich et al. α activity of natural tungsten isotopes (англ.) // Phys. Rev. C : journal. — 2003. — Vol. 67. — P. 014310. — DOI:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. Detection of the natural α decay of tungsten (англ.) // Phys. Rev. C : journal. — 2004. — Vol. 70. — P. 064606. — DOI:10.1103/PhysRevC.70.064606.
Ответы@Mail.Ru: сера-это металл или неметалл?
Сэра — это старая песня Валерия Меладзе, и назвать ее металлом может только совершенно несведущий в музыке человек.
<a rel=»nofollow» href=»http://slovari.yandex.ru/search.xml?text=����» target=»_blank»>http://slovari.yandex.ru/search.xml?text=%F1%E5%F0%E0</a>
переходный элемент
Не металл,. Ведь в табл. Менделеева слева стоят металлы, а справа-неметаллы. Сера как раз где-то справа
Сера не является металом. Она является аморфным веществом.
точто неМе, и точно не из органики (органической химии)
Неметалл — жёлтое хрупкое вещество.
СЕРА — (лат . Sulfur) S, химический элемент VI группы периодической системы Менделеева, атомный номер 16, атомная масса 32,066. Желтые кристаллы. Устойчива в двух модификациях — ромбической (плотность 2,07 г/см3, tпл 112,8 °С) и моноклинной (плотность 1,96 г/см3, tпл 119,0 °С). В воде нерастворима. На воздухе устойчива; при горении дает SO2, с металлами образует сульфиды. В природе — самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и др. методами. Ок. 50% серы идет на получение серной кислоты, 25% — на получение сульфитов (используются в бумажной промышленности), остальная — для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др. Не металл.<br>
Сера — это типичный неметалл. Сера жёлто-зелёного цвета. При нагревании жжёт слизистые по круче убоной горчицы, может лёгкие выжечь. Ладно, что-то я уже не в тему пошёл….
Сера металлом не является.