Физические и химические явления. Признаки химических реакций
Форма проведения: урок.
Тип: комбинированный.
Цели:
- Сформировать представления, о явлениях: физических и химических, признаках и условиях протекания и возникновения химических реакций.
- Развивать умения составлять формулы по валентностям, решать задачи.
- Осуществлять экологическое воспитание и показать важность химических знаний в жизни.
Оборудование:
- Плакат «Круговорот веществ в природе».
- Рыбки с химическими элементами.
- Иллюстрация мультипликационного героя для «Мозайки».
- Надписи к схемам.
- Карточки с формулами.
- Реактивы.
- Тест.
- Карточки с задачами.
- Карточки с последовательностью проведения опытов.
- Компьютерные учебные программы: «Виртуальная лаборатория», «Самоучитель-химия», компьютер.
Ход урока
I. Организационный момент.
II. Актуализация знаний.
— Начнём урок с повторения пройденного материала.
а) два ученика работают у доски по карточкам:
1) – Какова масса 0,5 моль оксида натрия (Na2O)?
2) – Рассчитайте массу углекислого газа CO2, содержащего по 0,6 х 1023 молекул.
б) Дидактическая игра «Рыболовы»
— Что такое валентность?
— Какой она бывает?
— Поймайте элемент на крючок валентности.
(на доске рыбки из бумаги с символами химических элементов, мелом на доске нарисованы крючки)
в) Составление формул по валентности:
— Я показываю карточку с незавершённой формулой, вы записываете элементы из которых она состоит, определяете индексы, согласно валентностям.
На карточках:
СО AlO HS CaO SiO ClO NaO FeO
Проверка: учитель показывает карточку, на обратной стороне которой готовая формула. Учащиеся объясняют алгоритм.
— Что такое оксиды?
— Назовите оксиды среди данных формул.
г) Решение задачи (с последующей взаимопроверкой).
Найдите:
1 в. — w(O) в СО2
2 в. — w(O) в Fe2O3
В это время учитель проверяет работу двух учеников.
Микроитог.
III. Изучение нового материала.
- Сообщение темы (запись в тетради)
- Объяснение учителя.
— В природе постоянно происходит множество различных явлений.
Вспомните круговорот воды в природе.
(учащиеся объясняют по схеме «Круговорот воды в природе»)
Здесь вода встречается в трёх своих состояниях: жидком, твердом, газообразном. То есть происходит изменение агрегатного состояния – здесь мы наблюдаем физическое явление. Но стоит только воде в любом своем состоянии подействовать, например, на гвоздь, гвоздь покрывается ржавчиной.
Итак, учащиеся подытоживают и записывают схему с собственными примерами:
Поскольку химия – это наука о веществах, превращениях, т.е. здесь рассматриваются химические явления или химические реакции.
При химических реакциях исходные вещества превращаются в другие вещества, обладающие другими свойствами.
Об этом можно судить по внешним признакам химических реакций.
Учитель показывает опыты:
а) к 4-5 каплям раствора FeCl3 добавляем 1-2 капли раствора роданида калия KCNS. Образуется вещество вишнево-красного цвета.
б) AgNO3 смешать с раствором HCl, получаем белый творожистый осадок.
Есть и другие признаки.
Просмотр опытов с использованием компьютера и учебных программ «Виртуальная лаборатория», «Самоучитель – химия»
(выделение света, тепла; выделение газа, появление запаха, растворение осадка)
Таким образом:
— Какие условия необходимы, чтобы произошла химическая реакция?
-Что мы делали с веществами, когда проделывали опыты? (смешивали, нагревали).
— Вещества, которые вступают в химическую реакцию, должны быть в измельченном виде, растворённом. И чаще всего, чтобы произошла химическая реакция необходимо нагревание веществ до определенной температуры.
Составляется и записывается схема:
— Но, ребята, бывает так, что нужно прекратить химическую реакцию. Мы живём в столице нефтяного края. Крупная компания ОАО «Татнефть» борется и делает всё для того, чтобы не было порывов, аварий нефтепроводов за счёт применения новых технологий, современного оборудования, т.е. создается экологическая программа. Но аварии случаются в силу разных причин и нефть, нефтепродукты попадают в воду, почву, а если сюда попала горящая спичка, непотушенная сигарета, искра – могут привести к пожару.
— Назовите признаки химической реакции?
— Как можно её остановить?
Водой не гасят, для этого используют огнетушители, содержащие пенообразующие вещества. При их использовании прекращается доступ кислорода, который усиливает горение и происходит охлаждение нефтепродуктов.
В таких случаях очень важны знания химии.
Микроитог проходит в виде игры «Мозайка».
Раздаются тесты, учащиеся выбирают правильный ответ; при сложении всех правильных ответов получается изображение.
Тест «Признаки химических реакций»:
1. Физические явления — это явления:
А) происходящие с веществами с сохранением их молекул;
Б) происходящие с веществами с разрушением молекул;
В) при которых данные вещества не превращаются в другие, а обычно изменяется только агрегатное состояние;
Г) в результате которых из одних веществ образуются другие.
2. Отметьте утверждение, в котором идёт речь о химическом явлении:
А) почернение медной пластинки при нагревании;
Б) измельчение сахара в ступке;
В) плавление льда;
Г) кипение воды.
3. Укажите условия протекания и течения химических реакций:
А) наличие осадка;
Б) контакт веществ и нагревание;
В) действие света;
Г) растворение веществ.
4. Признаком химических реакций не является:
А) появление запаха;
Б) изменение объёма;
В) изменение цвета;
Г) выделение света и тепла.
Ф И З М И Н У Т К А
IV. Закрепление.
№1. №1 с.40 учебника – устно
№2. Лабораторные опыты по рядам (работают в парах).
I вариант
Лабораторные опыты:
1. Положите в пробирку гранулу цинка и прилейте немного (3-5 миллилитров) соляной кислоты (HCl).
- Что наблюдаете?
- О чём это говорит?
2. Налейте в пробирку немного воды из стакана и нагрейте её, соблюдая правила техники безопасности.
- Что наблюдали?
- О чём это говорит?
По окончании работы приведите в порядок своё рабочее место!
II вариант
Лабораторные опыты:
1. Налейте немного двух веществ, поочерёдно, сначала 3-5 миллилитра (мл) CuSO4 , а потом 3-4 мл NaOH.
- Что наблюдаете?
- О чём это свидетельствует?
2. Положите в ложечку для сжигания веществ парафин и нагрейте его над спиртовкой, соблюдая правила техники безопасности.
- Что наблюдаете?
- О чём это говорит?
По окончании работы приведите в порядок своё рабочее место!
III вариант
Лабораторные опыты:
1. Возьмите пробирку с веществом гидроксида меди Cu(OH)2 и добавьте к нему 2-3 миллилитра соляной кислоты ( HCl ).
- Что наблюдаете?
- О чём это свидетельствует?
2. Положите в ложечку для сжигания веществ парафин и нагрейте его над спиртовкой, соблюдая правила техники безопасности.
- Что наблюдаете?
- О чём это свидетельствует?
По окончании работы приведите в порядок своё рабочее место!
Коллективное обсуждение ответов.
V. Итог (выставление оценок)
Домашнее задание: п.8, с.40, № 4 устно
urok.1sept.ru
Урок химии в 8-м классе по теме «Физические и химические явления. Признаки химических реакций»
Цель: совершенствовать умение отличать физические процессы от химических, выяснить признаки химических реакций.
Задачи:
- Усвоить понятия «физические явления», «химические явления», химическая реакция.
- Изучить признаки протекания химических реакций.
- Развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
- Воспитывать трудолюбие, целеустремленность, культуру речи и общения.
Формы работы: коллективно-групповая, индивидуальная.
Тип урока: урок формирования новых знаний.
Оборудование: презентация к уроку, раздаточный материал; спиртовка, пробиркодержатель, спички.
Реактивы: растворы соляной кислоты, гидроксида натрия, сульфата меди (II), цинк, сахарный песок, спирт.
План урока.
1. Вступительное слово (формулировка темы и цели урока).
2. Групповая работа.
3.Формулировка определений – физических и химических явлений, исходя из результатов групповой работы.
4. Лабораторная работа: «Признаки химических реакций».
5. Вывод по результатам лабораторной работы.
6. Домашнее задание.
7. Рефлексия.
Ход урока
Вступление (Приложение: слайд № 1)
«Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции.»
М.В. Ломоносов (слайд)
Как вы понимаете эти слова? (изучение химии невозможно без практики)
Действительно, для того чтобы проводить опыты, нужно знать какие вещества необходимо взять.
Какие классы неорганических веществ вы знаете? Назовите их (оксиды, кислоты, соли, основания)
Вы знаете вещества, знаете их состав, строение. Но ваши знания будут неполными, если вы не изучите явления, происходящие с ними и эти явления вам уже хорошо известны из курса окружающего мира и начальных уроках химии. Что же это за явления? О каких явлениях идет речь? (физические и химические)
Отсюда вытекает тема нашего сегодняшнего урока, как вы ее сформулируете? «Физические и химические явления». А всегда ли вы можете с уверенностью сказать, о каком явлении идет речь – физическом или химическом? (Нет). Что для этого необходимо знать? (Признаки)
Совершенно верно. Поэтому дополняем нашу тему: «Физические и химические явления. Признаки химических реакций» (Приложение: слайд № 2). Исходя из темы органично исходит и цель нашего урока. Чему же вы должны научиться в ходе сегодняшнего урока?
Приложение: слайд № 3)
(Дети формулируют цель урока, учитель ее записывает на доске). Я запишу цели нашего урока, чтобы в конце урока вы к ним вернулись и выяснили, достигли вы этих целей или нет.
Что ж, приступаем к нашему уроку.
Задание № 1 (групповая работа) (Приложение: слайд № 4)
Первоначально нам необходимо вспомнить уже известные вам определения физических и химических явлений. Для этого у вас на столах лежат разрезанные карточки с отдельными словами, относящиеся к определению физических и химических явлений. Я попрошу вас из этих слов восстановить определения данных явлений. Работаете группой. На работу отводится 1 мин. Чтобы я видела, что ваш стол справился с заданием, по окончании поднимите руки. (Я прошу зачитать получившееся определение физических явлений стол № …)
Идем дальше.
Задание № 2 (групповая работа) (Приложение: слайд № 5)
Чтобы вспомнить, что по своей сути представляют физические и хим. явления, я предлагаю вам выполнить следующее задание.
На каждом столе лежит листочек со стихотворением. Каждый стол, ознакомьтесь со своим стихом, выясните о каком явлении в нем идет речь. Приступаем к обсуждению. На работу вам отводится 0,5 мин.
1.
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье.
В багрец и золото, одетые леса.
(А.С.Пушкин)
2.
И трещат сухие сучья,
Разгораясь жарко.
Освящая тьму ночную
Далеко и жарко!
(И.Суриков)
3.
В декабре, в декабре
Все деревья в серебре.
Нашу речку, словно в сказке
За ночь вымостил мороз…
(С.Я.Маршак)
4.
А если медь в печи нагреть.
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте…
(Е.Ефимовский)
5.
Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
(Е.Благинина)
6.
На рукомойнике моем
Позеленела медь.
Но так играет луч на нем,
Что весело смотреть.
(А.Ахматова)
Как видно из примеров, физические и химические явления весьма распространены в природе и многие из них используются во благо человека.
Сегодня мы должны более подробно ознакомиться с химическими явлениями.
Сейчас я вам продемонстрирую опыт – разложение сахара. Вы должны прокомментировать его и сделать вывод — относится ли этот процесс к физическому или к химическому (Показ опыта. Ответ учеников).
По каким признакам вы относите это явление к химическому? (Изменение цвета, запаха). Т. образом, химические реакции всегда сопровождаются видимыми изменениями, поэтому, чтобы научиться отличать химические явления от физических, необходимо научиться, прежде всего, наблюдать, чем мы сейчас с вами и займемся.
Задание № 3 (Приложение: слайд № 6)
Вам предстоит провести лабораторную работу, исходя из которой, вы должны выяснить, какими признаками могут сопровождаться химические реакции. Перед практической работой – инструктаж:
1. при работе с кислотами и щелочами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над столом;
2. растворы веществ наливать в пробирки в небольших количествах, по 1 мл, что соответствует 1 см;
Проведение лабораторной работы
| Названия исходных веществ | Наблюдения |
|
|
|
|
|
|
|
|
|
|
После работы проверка результатов заполнения таблицы (Приложение: слайд № 7)
Исходя из своих наблюдений, сделайте вывод – какими же признаками могут сопровождаться химические реакции (Ответы учеников).
Вывод: химические реакции могут сопровождаться следующими признаками: (Приложение: слайд № 8).
- образованием осадка или его растворением;
- выделением газа;
- выделением (поглощением) тепла, иногда света;
- изменением цвета;
- изменением запаха.
Задание № 4 (Приложение: слайд № 9)
Для того, чтобы проверить, насколько результативным было изучение новой темы, вам сейчас предстоит пройти небольшой индивидуальный тест. На работу 2 мин. + 1 мин. на взаимопроверку.
Вариант 1.
Из приведенных явлений выделите знаком «+» те, которые относятся к физическим:
1) таяние льда;
2) помутнение известковой воды от углекислого газа;
3) растирание кусочка сахара в порошок;
4) растворение сахара в воде;
5) почернение медной пластинки при накаливании.
Вариант 2.
Из приведенных явлений выпишите те, которые относятся к химическим:
1) замерзание воды;
2) прокисание молока;
3) ржавление гвоздя;
4) растворение уксусной кислоты в воде;
5) гниение дерева.
Вариант 3.
Из приведенных явлений выпишите те, которые относятся к химическим:
1) ковка металла;
2) образование снежинок;
3) горение спирта;
4) прокисание яблочного сока;
5) обугливание лучинки.
Вариант 4.
Из приведенных явлений выпишите те, которые относятся к физическим:
а) исчезновение черного налета на серебряных ложках при обработке их раствором уксусной кислоты;
1) испарение спирта;
2) замерзание воды;
3) горение магния;
4) растворение сахара в воде
5) подгорание пищи на сковороде;
Отложите ручки, возьмите в руки карандаши, поменяйтесь тестами с партнером по плечу и проверьте работы друг друга (Приложение: слайд № 10), оцените работы (Приложение: слайд № 11).
Ученика под № 1 за каждым столом я попрошу собрать тесты и сдать их мне.
Ну что ж, возвращаемся к целям урока, которые были поставлены нами вначале занятия и смотрим, достигнуты ли вами цели? Все ли мы с вами повторили и изучили?
Цель урока:
- совершенствовать умения отличать физические явления от химических;
- выяснить признаки химических реакций.
Поднимите руки те, кто не достиг этих целей?
Ваше д/з. Оно будет следующим.
1. Повторение определений.
2. Изучение параграфа 26, в. 1-3 стр. 94-95 (Приложение: слайд № 12)
Благодарю вас за работу на уроке и прежде чем вы покинете кабинет заполните листочек с рефлексией и сдайте его мне, это будет ваш билет на выход.
Рефлексия (2 мин.) (Приложение: слайд № 13)
Продолжите предложение:
Изучая тему «Физические и химические явления»
- Раньше я думал что …
- Теперь я узнал что …
urok.1sept.ru
Признаки химических реакций – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Победитель конкурса «Электронный учебник на уроке».
7-й класс
Цель урока:
- изучение и первичное осознание химических явлений; выяснение признаков и условий протекания химических реакций;
- совершенствование умения отличать физические процессы от химических; формирование практических навыков при работе с химическими реактивами и лабораторным оборудованием.
Задачи урока:
образовательные:
- закрепить знания учащихся о физических и химических явлениях;
- содействовать формированию у учащихся знаний о признаках и условиях протекания химических реакций;
развивающие:
- развивать умение ставить проблемы и решать их, устанавливать межпредметные связи;
- вырабатывать практические умения работать с лабораторным оборудованием и реактивами в соответствии с правилами по ТБ;
- продолжать формирование умений оформлять результаты учебного эксперимента;
- развивать способность к само- и взаимоконтролю.
воспитательные:
- воспитывать культуру общения через работу в парах;
- продолжить формирование представлений о положительной роли химии для объяснения происходящих процессов в природе и в организме человека.
Тип урока: урок изучения и первичного закрепления знаний.
Методы обучения: беседа, рассказ учителя, демонстрационный эксперимент, демонстрация видеофрагментов, использование ЭФУ.
Оборудование: ПК, медиапроектор, наборы для лабораторной работы, рабочая тетрадь.
Средства обучения: мультимедийная презентация.
Этапы урока
- Деятельность учителя
- Деятельность ученика
- Примечание
Ход урока
I. Организационный момент – 1 мин
В течение урока вам предстоит работать с электронными приложениями Я надеюсь, что урок будет интересным и полезным для вас.
Цель: создание положительного эмоционального настроя на усвоение учебного материала, формулирование целей и задач урока, ожидаемых результатов.
II. Проверка домашнего задания – 5 мин
– Ребята, какие явления могут встречаться в нашей жизни?
– Как вы считаете, какие из этих явлений должна изучать физика, а какие — химия?
– Сформулируйте определения физических и химических явлений.
– Химия – одна из наук, помогающая познать тайны природы. Но этому надо учиться. Одно из необходимых умений – это умение наблюдать явлений, отличать, определять принадлежность явления к определенной группе. На экране будут представлены картинки физических и химических явлений.
Физическое явление – это явление, при котором, изменяется агрегатное состояние вещества или форма образованного им тела, а само вещество остаётся без изменений.
Химическое явление – это явление, при котором одно вещество превращается в другое.
III. Мотивация к открытию новых знаний – 2 мин
— Скажите, теперь вы сможете отличить физическое явление от химической реакции?
– Достаточно ли ваших знаний для этого?
– Какой главный отличительный признак химической реакции?
– Ежеминутно в мире протекает миллионы химических реакций – в нашем желудке, когда мы едим, в выпекающемся пироге или в двигателе автомобиля. Но как определить происходит химическая реакция или нет?
При химических процессах происходит превращение одних веществ в другие, которые обладают новыми свойствами, которыми не обладали исходные вещества. Эти превращения сопровождаются яркими и наглядными изменениями. Эти наглядные изменения называются признаки.
– Что ещё вам необходимо знать о химических реакциях, чтобы безошибочно отличать их от физических явлений?
– Поэтому какую тему мы будем изучать сегодня на уроке?
– Должно быть что-то очень заметное
– Знать признаки химический явлений (реакций)
– Признаки химических реакций
Цель: подготовка к осознанному восприятию материала, стимулирование познавательного интереса.
IV. Актуализация субъектного опыта учащихся – 3 мин
“Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”.
М.В. Ломоносов
– Как вы понимаете эти слова?
– Что хотели бы узнать и чему научиться на уроке:
- выявить – (признаки химических реакций)
- определить – (отличия химических и физических явлений)
- познакомиться – (с условиями протекания реакций)
- провести – (химический эксперимент)
- отметить – (значение химических реакций)
Главный признак химической реакции – это образование новых веществ с новыми свойствами. Вы знаете много веществ, но ваши знания будут неполными, если мы не изучим явления происходящие с ними. Вот по этому, сегодня на уроке вы должны провести различные реакции и выяснить их основные признаки.
– Для того чтобы проводить опыты, нужно знать какие вещества необходимо брать для реакции.
(учащиеся формируют цели урока)
Цель: активизация личного опыта каждого ученика и использование его в обучении, подготовка к восприятию нового материала, оценка учителем уровня подготовленности учащихся.
V. Открытие новых знаний, изучение нового материала (лабораторный эксперимент) – 12 мин
– В ходе исследования вы будете выступать в роли юных химиков – экспериментаторов. Нам предстоит работать с реактивами, в том числе с кислотами и щелочами. Вспомните правила ТБ, которые необходимо знать при работе с этими веществами.
– Анализируя лабораторный эксперимент, не забывайте записывать свои наблюдения в рабочую тетрадь и делать выводы. Пользоваться можно глазами, руками, памятью, эрудицией, правилами техники безопасности и реактивами.
– Какие опыты проводили и какие признаки наблюдали?
– Как вы думаете, какие условия необходимо выполнить, чтобы произошла химическая реакция?
(ребята перечисляют правила ТБ)
Условия протекания химических реакций: соприкосновение веществ, нагревание
Цель: формирование новых знаний о химических реакциях, признаках, условиях протекания реакции и классификации реакций по тепловому эффекту.
VI. Закрепление изученного – 5 мин
Используя электронные приложения, ребята закрепляют изученный материал.
– Прочитайте описание явлений и укажите, в какой части текста говориться о физическом явлении, а в какой о химической реакции. Назовите признаки химической реакции.
1) При горении свечи воск сначала плавится и смачивает фитиль, а потом сгорает, образуя углекислый газ и пары воды. Горение сопровождается образованием пламени.
2) В процессе выплавки чугуна из руды образуется металл. Горячий чугун разливают в формы, в которых он постепенно остывает и затвердевает.
3) Для приготовления лимонада в воду высыпают кристаллики лимонной кислоты. Они постепенно растворяются. Затем в воду с кислотой добавляют соду. В результате появляются пузырьки газа.
4) При нагревании воды она испаряется, а при действии на неё электрического тока, воды разлагается на два простых газообразных вещества: кислород и водород.
5) При длительном пережёвывании чёрного хлеба он измельчается. Потом вы почувствуете сладковатый вкус, так как хлеб начинает перевариваться под действием слюны.
6) Для приготовления теста сначала дрожжи растворяют в воде. Затем их добавляют к остальным компонентам теста. В результате появляются пузырьки газа, которые делают тесто воздушным.
– Итак, запишем в рабочую тетрадь признаки и условия протекания реакций
Плавление воска — физическое явление, т.к. меняется его агрегатное состояние, а горение — химическое, в тексте говорится об образовании двух новых веществ.
Превращение руды в чугун – процесс химический, а остывание и затвердевание чугуна — физический.
Растворение кристалликов лимонной кислоты – явление физическое, т.к. меняется размер частиц вещества. После добавления соды произошла химическая реакция – как появляются пузырьки какого-то нового вещества.
Испарение воды – физическое явление, так как меняется агрегатное состояние вещества, а разложение под действием тока — химическое, так как образовались новые вещества.
Измельчение хлеба — физическое явление. Переваривание под действием слюны — химическое.
1-2 минуты дети знакомятся с текстом и обсуждают его. Учитель направляет обсуждение ответов каждой группы остальными детьми.
Включить экран.
VII. Применение изученного – 3 мин
– Молодцы, ребята! Вы на практике узнали о некоторых признаках химических реакций. Но… вся ли информация сейчас прозвучала? Как вы думаете?
– Совершенно верно! Мы ничего не сказали о том, где человек в своей повседневной жизни может встретиться с химическими реакциями и наблюдать за их признаками, какие химические реакции происходят в природе и какими признаками они сопровождаются. Можете привести примеры?
– Наверно, не вся!
– Извержения вулканов. Огромное количество (выделение энергии в виде тепла и света)
– Летом листья на деревьях зелёные, а осенью жёлтые и красные
– Образование пещер, т.к. происходит взаимодействие таких минералов, как известняк, с водой и углекислым газом, что приводит к их растворению?
VIII. Контроль и самоконтроль – 5 мин
1. Установите соответствие
Явления: 1). Растворение соли в воде; 2). Плавление свинца; 3). Загнивание белка; 4). Почернение серебряной ложки.
Название явления: а). Физическое явление; б) Химическое явление.
(1а; 2а; 3б; 4б).
2. Укажите признаки следующих химических реакций
Название химической реакции.
Признак хим. реакции.
- Прокисание молока.
- Горение бензина.
- Разложение сахара.
- Образование накипи в чайнике.
- Открывание бутылки с газированной водой
– Ваше время закончилось. Проверьте свои ответы и выставьте себе оценки. .
Цель: репродуктивное воссоздание изученного материала, систематизация и обобщение, выполнение заданий на изученную тему, первичная проверка усвоения и понимания материала.
IX. Домашнее задание – 1 мин
Приведите пословицы, где речь идёт о явлениях. Определите группу явлений: физические или химические
Цель: разъяснение, постановка домашнего задания.
X. Подведение итогов. Рефлексия – 2 мин
– В ходе урока вы попытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, то есть проводить исследования. Многие учёные прошлых веков опирались в своих изысканиях лишь на интуицию и в результате нередко ошибались. Вы же с помощью опытов нашли свою истину.
Без химических реакций невозможна жизнь и все многообразие веществ. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Продолжите предложение:
- Теперь я знаю, что …
- Теперь я знаю, как …
- Теперь я умею…
- Меня удивило…
– Выразите свое мнение об уроке, выбрав смайлик.
– Что ещё вы хотели бы знать о химических реакциях?
– В заключение я хочу сказать, что химия – это удивительная наука, вы ее только начинаете познавать. Спасибо за сотрудничество.
rosuchebnik.ru
«Физические и химические явления. Признаки химических реакций»
Во многих школах уже не один год работают по программе А.Е. Гуревича, Д.А. Исаева, Л.С. Понтак - “Физика. Химия” для 5-6 классов средней общеобразовательной школы. Наша школа не исключение. Учащиеся получают начальные знания по физике и химии. Однако изучение физики продолжается в 7 классе, а к химии возвращаются лишь в 8 классе, вновь начиная изучение предмета с первоначальных понятий. Тем самым нарушается принцип непрерывности образования, а знания по химии, полученные в 5 — 6-х классах утрачиваются. В нашей школе связующим звеном между программой курса “Физика. Химия” для 5 — 6-х классов и программами курсов химии для 8 -11-х классов средней общеобразовательной школы является пропедевтический курс химии с прикладным содержанием для 7-го класса, который продолжает знакомить учащихся с основными понятиями химии.
Тема: Физические и химические явления. Признаки химических реакций.
Задачи: Сформировать понятия “физические и химические явления”. Познакомить учащихся с признаками химических реакций. Продолжить развивать умение наблюдать, рассуждать, говорить “химическим языком”. Воспитывать коммуникативные навыки, интерес к предмету.
Оборудование: парафин, сахар, растворы гидроксида натрия, соляной кислоты, хлорида железа (III), хлорида меди (II), хлорида бария, сульфата калия, концентрированная серная кислота, магний, карбонат натрия (сухой), фенолфталеин, спиртовка, держатель, фарфоровая чашечка для выпаривания, химический стакан.
Ход урока
I. Организационный момент.
II. Проверка знаний и умений.
1.Знание химических элементов (химического алфавита).
Вы знаете, что известно более 100 химических элементов, которые расположились в периодической системе химических элементов Д.И. Менделеева. И многие химические элементы вам знакомы. Давайте вспомним химический алфавит.
1) Назовите химические элементы, которые начинаются на букву “К”.
2) Назовите химические элементы, которые начинаются на букву “С”.
3) Назовите химические элементы, которые начинаются на букву “М”.
4) Назовите химический элемент, который читается “аш”.
5) Назовите химический элемент, который читается “феррум”.
6) Назовите химический элемент, который читается “силициум”.
7)Назовите химический элемент, который читается “плюмбум”.
2.Знание химических формул (химических слов).
? Умеете ли вы читать химические слова?
Проводится аукцион “Продажа картин”. Учащимся предлагаются карточки с различными формулами: AlCl3, ZnS, Na2O, H2O. Условие: картину купит тот, кто последним даст ей оценку (учащиеся должны дать как можно больше информации об этом веществе).
3.Умение составлять формулы веществ по валентности.
? Какое важное понятие используется в химии, при составлении химических формул? (Валентность).
Работа учащихся по составлению химических формул с помощью моделей атомов на магнитной доске (AlCl3, ZnS, Na2O, H2O).
Работа по рядам, по цепочке (учащиеся по очереди выходят к доске и составляют формулу вещества по валентности; побеждает тот ряд, который быстрее справится с заданием и составит правильно формулы).
| IV | V | III | II | III | IV | I | I | ||
| 1 ряд: | SO, | PO, | NH, | HO, | PbO, | FeO, | NO, | AgO, | NaO. |
| II | I | III | II | IV | II | I | IV | III | |
| 2 ряд: | HgO, | KO, | BO, | ZnO, | MnO, | NiO, | CuO, | SnO, | NiO |
| VI | V | VII | II | IV | II | III | III | V | |
| 3 ряд: | SO, | AsO, | ClO, | MnO, | PbO, | CuO, | AlO, | PH, | NO |
Подведение итогов. Ряд–победитель получает изображение предмета из лабораторного оборудования.
III. Сообщение темы и задач урока.
С начала учебного года вы научились общаться химическим языком, познакомились с различными химическими веществами. Но изучение веществ будет не полным, если не рассмотреть явления, которые с ними могут происходить. Сегодня вы начинаете изучать новый раздел нашего курса, который называется “Химические превращения”, а тема нашего урока “Физические и химические явления. Признаки химических реакций”. Вы познакомитесь с данными явлениями, научитесь их находить при рассмотрении различных процессов, в быту; познакомитесь с новым понятием “химическая реакция” и с признаками химических реакций.
(На доске записана тема урока, учащиеся записывают её в тетрадь)
IV. Изучение нового материала.
1. Физические и химические явления.
Учащимся задаются вопросы:
— Остаются ли вещества неизменными?
— Какие изменения могут происходить с веществами?
— Приведите примеры изменений веществ, которые вы
наблюдали.
(Учащиеся приводят примеры, учитель записывает их на доске)
Лабораторный опыт №1 “Нагревание парафина”.
(На столах учащихся находятся фарфоровая чашечка для выпаривания, парафин, держатель, спиртовка)
Повторение техники безопасности при работе со спиртовкой.
Учитель задаёт вопросы:
— Опишите физические свойства парафина.
(Твердый, жирный на ощупь, имеет цвет)
— Что произошло при нагревании парафина?
(Расплавился)
— Что наблюдали при охлаждении парафина? (Стал
твердым)
— Изменилось ли вещество? (Нет)
— Изменились ли свойства этого вещества? (Нет)
-Какой процесс наблюдали? (Плавление).
Лабораторный опыт №2. “Растворение и нагревание сахара”
(На столах учащихся кусочек сахара, химический стакан с водой, фарфоровая чашечка для выпаривания, спиртовка, держатель.)
Учитель задаёт вопросы:
— Опишите физические свойства сахара. (Твердый,
белый, сладкий, растворяется в воде)
— Что наблюдали при растворении в воде сахара?
(Кристаллики сахара исчезли, процесс
растворения)
— Каким способом можно разделить смесь сахара и
воды? (Выпаривание).
— Изменилось ли само вещество, его свойства? (Нет)
— Какой процесс наблюдали? (Растворение).
— Что наблюдали при нагревании сахара? (Изменение
окраски).
— Что почувствовали? (Запах).
— Какими свойствами обладает полученное
вещество? (Изменился цвет, появился запах)
— Похоже оно на исходное вещество — сахар? (Нет)
— Какой процесс наблюдали? (Сжигание).
— Кто может сказать, когда наблюдали физическое
явление, а когда химическое?
— Что происходит с веществами и их свойствами при
физических явлениях?
— Что происходит с веществами и их свойствами при
химических явлениях?
Учащиеся делают выводы.
Задание: Распределить явления, которые записаны на доске на физические и химические.
(Учащиеся работают самостоятельно, работа проверяется).
2. Признаки химических реакций.
Как распознать химическую реакцию? Для этого существуют признаки, по которым можно отличить химическую реакцию от физического явления. Некоторые из них вы наблюдали при выполнении лабораторных опытов. Какие? (Изменение окраски, запах).
Демонстрация: 1) р-р NaOH +фенолфталеин + кислота;
-Какой признак наблюдали? (Изменение окраски)
-Где в жизни сталкивались с подобными явлениями,
приведите примеры.
2) Na2CO3 (сух.) + HCl;
-Какой признак наблюдали? (Выделился газ)
-Где в жизни сталкивались с подобными явлениями,
приведите примеры.
3) растворение концентрированной серной кислоты в воде; сжигание магния;
-Какие признаки наблюдали? (Выделение тепла и
света)
-Где в жизни сталкивались с подобными явлениями,
приведите примеры.
4) FeCl3 +NaOH; CuCl2+NaOH; BaCl2+K2SO4;
-Какие признаки наблюдали? (Выпадение осадка)
Вывод: Какими признаками характеризуется химическая реакция?
3. Значение физических и химических явлений.
Испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленности металлам, пластмассам и другим материалам придают определённую форму (штампуют, прокатывают), в результате получают многообразные предметы. Большое значение имеют химические реакции. Их используют для получения многих веществ: пластмасс, моющих средств, удобрений, медикаментов. При сгорании топлива получают теплоту, которую используют в быту и промышленности. Очень сложные биохимические процессы протекают в живых организмах, связанные с различными химическими превращениями.
V. Итог урока.
— С какими явлениями познакомились на уроке?
— Какие явления называют физическими?
Химическими? Приведите примеры.
— Какими признаками характеризуется химическая
реакция?
Задание: Определите к физическому или химическому относятся явления, перечисленные на доске: ржавление железа, замерзание воды, горение бензина, плавление алюминия.
(Учащиеся выполняют самостоятельно, взаимопроверка, оценивание).
VI. Задание на дом.
Привести по два примера физических и химических явлений, которые наблюдаете дома.
urok.1sept.ru
Урок по теме:»Физические и химические явления. Химические реакции и сопровождающие их явления.»
НОВОАЗОВСКАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА
I-III СТУПЕНЕЙ №2
Тема:
Физические и химические явления.
Химические реакции и сопровождающие их явления.
Урок в 7 классе
Подготовила: учитель химии
Дмитриченко Л.В.
г. Новоазовск
Тема урока: Физические и химические явления. Химические реакции и сопровождающие их явления.
Цели урока:
Образовательные:
Конкретизировать знания учащихся о физических и химических явлениях, опираясь на знания, полученные из курса природоведения, выяснить их существенные отличия, сформировать представление о химической реакции, рассмотреть внешние эффекты (признаки), которые сопровождают химические реакции, проводя химический эксперимент, раскрыть практическую значимость химических реакций.
Развивающие:
Развивать познавательную активность.
Развивать умение наблюдать окружающий мир, задумываться над его сутью, возможностью влияния на происходящие вокруг нас процессы.
Развивать умения наблюдать явления, узнавать их и делать выводы на основе наблюдений; умение проводить и анализировать химический эксперимент.
Вырабатывать практические умения работать с реактивами, оборудованием в соответствии с правилами техники безопасности .
Воспитательные:
Формировать научное мировоззрение учащихся.
Формировать эстетический вкус при наблюдении красоты явлений природы.
Тип урока: урок изучения нового материала и первичного закрепления знаний.
Методы: словесно-наглядный, практический, частично-поисковый.
Оборудование: компьютер, интерактивная доска, презентация урока в программе Power Point.
Оборудование: нагревательный прибор, спички, штатив с пробирками, пробиркодержатель, фарфоровая чашка, лабораторный штатив, металлическая ложечка.
Материалы: парафиновая свеча, растворы: щёлочи (натрий гидроксида), соляной кислоты, медного купороса, индикатор фенолфталеин, аммоний хлорид, спирт, мрамор.
Ход урока
І. Организационный этап.
Приветствие учащихся учителем.
Проверка готовности учащихся к уроку.
ІІ. Мотивация знаний.
Я хочу начать урок со слов английского учёного Майкла Фарадея «Я, собираюсь изложить вам …ряд сведений по химии, которые можно извлечь из горящей свечи. Я не первый раз провожу беседу на эту тему, и … я бы с удовольствием возвращался к ней ежегодно – до того эта тема интересна, и до того изумительно разнообразны те нити, которыми она связана с различными вопросами естествознания. Явления, наблюдающиеся при горении свечи таковы, что нет ни одного закона природы, который при этом не был бы так или иначе затронут …»
Майкл Фарадей, Лондон, 1860г.
ІІІ. Актуализация опорных знаний.
Учитель:
На уроках природоведения вы получили первоначальные знания о явлениях.
-Что такое явления?
(Явления – это любые изменения, которые происходят в мире.
Как утверждали древние философы: «Всё течёт, всё меняется.» )
Я предлагаю вам посмотреть иллюстративный ряд «Явления», а затем ответить на вопросы:
— На какие группы вы разделили бы все явления ?
— Какое отношение к химии они имеют?
Обсуждение просмотренного материала и обобщение учителя.
Первый вопрос: На какие группы вы разделили бы все явления?
(В зависимости от того, к какой сфере жизни принадлежат явления, их можно разделить на: механические, звуковые, световые, тепловые, магнитные, электрические, физические, химические, биологические, геологические, социальные, политические).
Второй вопрос: Какое отношение к химии они имеют?
(Химия-это наука о веществах и их превращениях, а на этих примерах мы и видим изменения, происходящие с веществами.)
Учитель:
В природе с момента её зарожденья:
Всегда с веществами идут превращенья.
Про эти природные измененья
Мы с вами сказали бы:
Это «Явленья!»
Явленья бывают различными,
Рассмотрим химические и физические.
Должны научиться мы их наблюдать,
А самое главное их различать.
Учитель: запишем тему урока: «Физические и химические явления. Химические реакции и сопровождающие их явления».
Сегодня на уроке мы должны:
— выяснить сущность физических и химических явлении.
— научиться различать физические и химические явления.
— выявить признаки химических реакций.
-развивать умение проводить наблюдения и делать выводы.
— показать значимость химических реакций.
ІV. Изучение нового материала.
Учитель:
Горящая свеча – это универсальный объект, глядя на него можно наблюдать как физические так и химические явления. Во время горения свечи парафин сначала плавится, а затем превращается в газообразные горючие вещества.
Какое это явление? (физическое)
Какие изменения происходят? (изменяется форма и агрегатное состояние.)
А затем пары парафина начинают гореть. При этом образуются углекислый газ и вода. Какое это явление? ( Химическое)
Классификация явлений.
Явления
Физические Химические
Вещество не изменяется
Молекулы сохраняются Вещество изменяется
Изменяется: Изменяется: состав вещ., свойства
Форма тела
Агрегатное состояние
Учитель: химические явления называют ещё химическими процессами или химическими реакциями.
Русский химик, лауреат Нобелевской премии Николай Николаевич Семёнов утверждал: «Химическое превращение, химическая реакция является главным предметом химии». Поэтому важно уметь наблюдать и описывать внешние признаки прохождения химических реакций – явлений, которые принадлежат к макромиру. Ещё важнее уметь объяснять эти явления, анализируя процессы, которые происходят между частичками, принадлежащими к микромиру.
Возникает вопрос: Что происходит с молекулами и атомами при химических реакциях?
Учитель: На доске показана реакция разложения воды под действием электрического тока, с образованием двух простых веществ: кислорода и водорода.
Вещества, которые вступают в химическую реакцию – называют реагентами, или исходными веществами.
Вещества, которые образуются в результате реакции — называют продуктами реакций или конечными веществами.
Реагенты → Продукты реакции
— Что происходит с молекулами воды при протекании химической реакции?
(молекулы разрушаются и образуются отдельные атомы)
-Что происходит с атомами?
(Во время химических реакций атомы сохраняются. Происходит лишь их перегруппировка.)
Вывод: Суть химической реакции состоит в перегруппировке атомов.
Проблемный вопрос: Как отличить химические явления от физических?
Гипотеза первая.
Можно сказать, что если молекулы вещества распадаются, то явление — химическое, а если сохраняются, то – физическое.
Но молекулы очень трудно увидеть даже в микроскоп, потому что они очень маленькие.
Гипотеза вторая.
Если в процессе химической реакции образуются новые вещества с новыми свойствами, то о протекании реакции можно судить по изменению физических свойств веществ.
Учитель: При этом мы будем наблюдать внешние эффекты, которые сопровождают химические реакции или их называют признаки реакции.
Давайте познакомимся с характерными признаками хим. реакций, выполнив небольшую исследовательскую работу: «Проведение химических реакций».
Задание: провести химические опыты, наблюдения и сделать выводы.
Я прошу вас разделится на группы. Каждая группа – это исследовательская лаборатория, где у каждого своя роль: экспериментаторы- проводят эксперимент; наблюдатели – ведут лабораторный журнал; аналитики – анализируют и фиксируют выводы; теоретики – объясняют теоретически.
Напоминаю о правилах ТБ. В каждой инструктивной карте записаны правила, которые необходимо выполнять при проведении данного опыта.
Кроме того каждая группа получает творческое задание.
Группа №1.
Карта – инструкция.
Внимание! Техника безопасности!
— При наливании жидкостей сосуд с реактивом бери так, чтобы этикетка была направлена в сторону ладони, снимай каплю с края горлышка сосуда, иначе жидкость будет стекать по стеклу, портить этикетку, может повредить кожу рук.
-Сосуд, из которого взяли реактив, сразу же закройте пробкой и поставьте на место.
-Особую осторожность проявляй при работе со щелочами. Попадание даже разбавленного раствора щёлочи в глаза может привести к необратимой потере зрения. При попадании раствора щёлочи на руки немедленно смой его большим количеством воды до исчезновения ощущения мылкости.
-при работе с кислотами также следует проявлять осторожность. Особенно надо беречь глаза. При попадании кислоты на руки следует немедленно смыть её большим количеством воды.
Опыт:
Взаимодействие натрий гидроксида с соляной кислотой в присутствии фенолфталеина.
Налейте в пробирку около 2 мл натрий гидроксида, NaOH), затем добавляйте по каплям фенолфталеин.
Что наблюдается?_____________________________________________
Затем налейте соляную кислоту(HCI) до видимых изменений.
Какие изменения наблюдаются? ___________________________________________
Вывод(какой признак свидетельствует о том, что произошла химическая реакция)_______________________________________________________________
Группа№2
Внимание! Техника безопасности!
-При наливании жидкостей сосуд с реактивом бери так, чтобы этикетка была направлена в сторону ладони, снимай каплю с края горлышка сосуда, иначе жидкость будет стекать по стеклу, портить этикетку, может повредить кожу рук.
-Сосуд, из которого взяли реактив, сразу же закрой пробкой и поставьте на место.
-При работе с кислотами также следует проявлять осторожно. Особенно надо беречь глаза. При попадании кислоты на руки следует немедленно смыть её большим количеством воды.
-Не наклоняйся над сосудом, в который наливаешь какую – либо жидкость (особенно едкую), потому что мельчайшие капли могут попасть в глаза.
Карта – инструкция.
Опыт:
Взаимодействие мрамора с раствором соляной кислоты.
Насыпьте в пробирку немного (лишь бы покрылось дно пробирки) мрамора и добавьте 1 мл разбавленной соляной кислоты(HCI).
Что наблюдается?________________________________________________________
Вывод(какой признак свидетельствует о том, что прошла химическая реакция)____________________________________________________________________
Группа№3
Внимание! Техника безопасности!
-При наливании жидкостей сосуд с реактивом бери так, чтобы этикетка была направлена в сторону ладони, снимай каплю с края горлышка сосуда, иначе жидкость будет стекать по стеклу, портить этикетку, может повредить кожу рук.
-Сосуд, из которого взяли реактив , сразу же закрой пробкой и поставьте на место.
-Особую осторожность проявляй при работе со щелочами. Попадание даже разбавленного раствора щёлочи в глаза может привести к необратимой потери зрения. При попадании раствора щёлочи на руки немедленно смой его большим количеством воды до исчезновения ощущения мылкости.
-Не наклоняйся над сосудом, в который наливаешь какую – либо жидкость (особенно едкую), потому что мельчайшие капли могут попасть в глаза.
Карта – инструкция.
Опыт:
Взаимодействие раствора медного купороса с раствором щёлочи .
Налейте в пробирку 1-2 мл раствора медного купороса (CuSO4) и добавляйте раствор щёлочи (NaOH) до видимых изменений.
Что наблюдается?_______________________________________________________
Затем прилейте раствор соляной кислоты(HCI) до видимых изменений.
Какие изменения наблюдаются?____________________________________________
Вывод(какой признак свидетельствует о том, что прошла химическая реакция?)
_____________________________________________________________________
Группа №4
Внимание! Техника безопасности!
При нагревании растворов в пробирке пользуйся деревянным держателем. Внимательно следи за тем, чтобы отверстие пробирки было направлено в сторону от лица работающего, так как жидкость в результате перегрева может быть выброшена из пробирки.
-При нагревании жидкостей следи, чтобы не перегрелись стенки пробирки над жидкостью, потому что при попадании на перегретое стекло капель жидкости пробирка может треснуть.
-Чтобы избежать перегревания, никогда не нагревай пробирку только снизу, а равномерно прогревай всю пробирку, всё её содержимое.
— Нюхай все вещества осторожно, не наклоняйся над пробиркой и не вдыхай полной грудью, а направляй к себе пар или газ движениями руки.
Карта – инструкция.
Опыт:
Взаимодействие аммоний хлорида с раствором щёлочи .
Налейте в пробирку 2 мл раствора аммоний хлорида(NH4CI) и прилейте около 2 мл раствора щёлочи (NaOH). Нагрейте жидкость в пробирке до кипения и осторожно понюхайте выделяющийся газ.
Что наблюдается?_______________________________________________________
Вывод(какой признак свидетельствует о том, что прошла химическая реакция?)
Группа №5.
Внимание техника безопасности!
-Будь особенно осторожным при работе с нагревательными приборами.
-Не дуй на пламя, чтобы погасить его !
-Для прекращения горения сухого горючего накрой пламя колпачком, поднося его сбоку.
Опыт:
Горение спирта.
В лабораторном штативе с помощью муфты закрепите кольцо, поставьте на него фарфоровую чашку с раствором. Зажгите горелку. Кольцо поднимите или опустите в штативе так, чтобы верхняя часть пламени касалась нижней части чашки.
Что наблюдается ?____________________________________________________
Вывод (какой признак свидетельствует о том, что прошла химическая реакция?) __________________________________________________________________
Общий вывод. Признаки химических реакций:
1 изменение цвета;
2 выделение газа;
3 образование или исчезновение осадка;
4 появление, исчезновение или изменение запаха;
5 выделение или поглощение теплоты;
6 появление пламени, иногда – свечение.
Учитель:
Иногда и физические и химические процессы могут сопровождаться одинаковыми внешними эффектами. Например, распространение запаха духов или ситуация, когда мы открываем бутылку с минеральной водой, то наблюдаем выделение углекислого газа.
Работа с творческими(дивергентными заданиями).
Задание 1.
Длина медных проводов изменяется летом и зимой. Объясните это явление
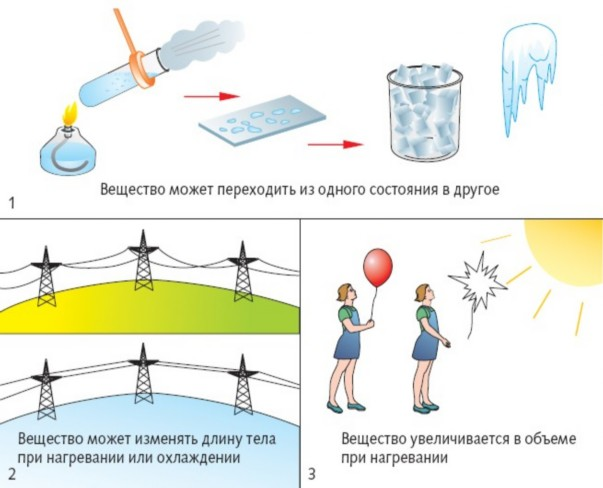
(Вещество может изменять длину тела при нагревании или охлаждении. Увеличивается при нагревании и уменьшается при охлаждении, но вещество при этом не меняется, поэтому данное явление – физическое.)
Задание 2.
Если в стакан насыпать соду и долить уксус, то газ начинает выделятся так активно, что кажется будто жидкость закипает.
Как в этом случае отличить кипение от химической реакции?
(для этого нужно вспомнить, как происходит кипение: жидкость закипает, когда нагревается до определённой температуры – температуры кипения. Для воды это 100 0С. Во время кипения воды пузырьки газа(пара) образуются во всём объёме жидкости. В случае взаимодействия уксуса с содой жидкость не нагревается, а газ выделяется только в том месте, где сода контактирует с раствором, поэтому кипением этот раствор назвать нельзя.)
Задание 3.
Порошок серебра, полученный в пробирке в результате химической реакции, имеет серый цвет. Если его расплавить, а затем расплав охладить, то получим кусочек металла, но не серого, а белого, с характерным блеском. Объясните – это физическое явление или химический процесс.
(это физическое явление. Серебро осталось без изменений, оно не превратилось в другое вещество и сохранило свои свойства. Металлы обладают « металлическим блеском».)
Задание 4.
В коробке с кожаной обувью находится специальное вещество – гранулы силикагеля (высушенный осадок силикатной кислоты). Как вы думаете с какой целью его применяют и какое это явление?
(его применяют для поглощения влаги и запаха. Это физическое явление, т.к. силикагель поглощает молекулы различных веществ без их разрушения и новые вещества не образуются.)
Задание 5.
ПРОАНАЛИЗИРУЕМ ОПЫТ
1. Закроем пробирку пробкой со вставленной в неё трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объём воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объём воздуха уменьшается, и вода входит в пробирку.
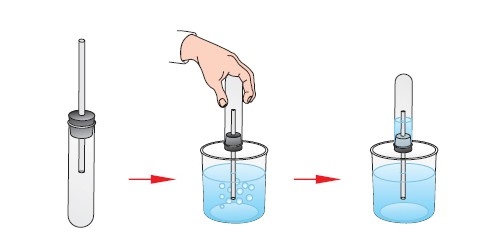
Вопрос: какое это явление?
(объём воздуха увеличивается при нагревании. Изменение объёма воздуха – это физическое явление, т.к. изменения с веществом произошли, но при этом оно не изменилось.)
Учитель:
Чтобы сделать вывод о том какое произошло явление , нужно внимательно наблюдать за ним, а также исследовать вещества до и после эксперимента.
Учитель: Химические реакции имеют большое значение. Они протекают в природе. Многие сопровождают нас в повседневной жизни, а также являются основой многих производств.
На экране примеры реакций: 1) Реакции, которые происходят в природе.
Процесс фотосинтеза, пр. дыхания.
2) Реакции, которые протекают в быту.
Приготовление пищи, приготовление кисломолочных продуктов, сжигание природного газа и другого топлива.
3) Реакции, лежащие в основе химических производств.
Получение металлов из руд, получение строительных материалов, производство удобрений, пластмасс, лекарственных веществ, получение предметов бытовой химии.
V. Закрепление знаний.
Задание 1.Тест на соответствие.
Выберите, какие из перечисленных явлений принадлежат к химическим, а какие к физическим. (1вариант – физические; 2вариант – химические.)
(Физические 1, 3, 5, 6, 8, 10. Химические 2, 4, 7, 9)
Задание 2.
Какими внешними эффектами сопровождаются такие химические превращения:
а) добавление в раствор щёлочи индикатора, б)получение кисломолочных продуктов, в)работа автомобиля(двигателя), г)взаимодействие двух растворов с образованием осадка, д)горение красного фосфора.
VІ. Подведение итогов урока.
Учитель:
Обдумайте всё, что происходило сегодня на уроке.
В случае согласия с утверждением напротив поставьте знак «+».
РЕФЛЕКСИВНЫЙ ТЕСТ
1. Я узнал(а) много нового.
2. Мне это пригодится в жизни.
3. На уроке было над чем подумать.
4. На все возникшие у меня вопросы я получил(а) ответы.
5. На уроке я поработал(а) добросовестно.
Заключительное слово учителя:
« … я могу только выразить вам своё пожелание, чтобы вы могли с честью выдержать сравнение со свечой, т.е. могли бы быть светочем для окружающих, и чтобы во всех ваших действиях вы подражали красоте пламени, честно и произвольно выполняя свой долг перед человечеством».
(Майкл Фарадей)
VІІ. Домашнее задание.
Прочитать § 14, выполнить упр. 2,3,4 стр.112 – 113; §15, стр.115-118 прочитать.
Написать мини – сочинение на тему: Значение химических реакций в природе и жизни человека.
infourok.ru