Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

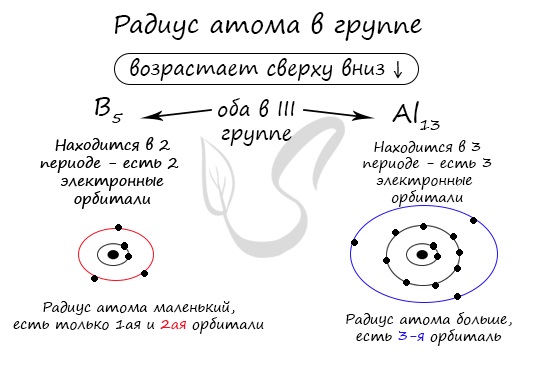
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
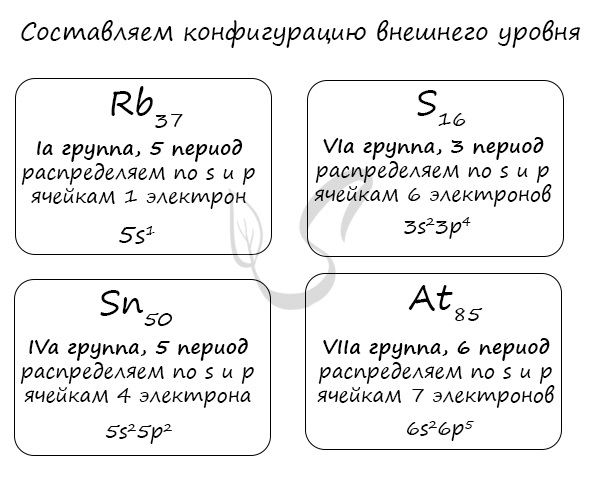
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ПЕРИОДИЧЕСКИЙ ЗАКОН • Большая российская энциклопедия
-

-

-

В книжной версии
Том 25. Москва, 2014, стр. 692-693
-

Скопировать библиографическую ссылку:
Авторы: Ю. Д. Третьяков, Ю. М. Киселёв

Изменение молярных объёмов от порядкового номера элемента.
ПЕРИОДИ́ЧЕСКИЙ ЗАКО́Н, устанавливает периодическое изменение свойств химич. элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств известных в то время элементов и величин их атомных весов. Работа Менделеева «Соотношение свойств с атомным весом элементов», опубликованная в «Журнале Русского химического общества» (1869, т. 1), содержала следующий важный вывод: «Элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств». В 1871 в 1-м изд. «Основ химии» (ч. 2, с. 941) Менделеев дал более точную формулировку П. з.: «физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости … от их атомного веса». Физич. обоснование П. з. получил при разработке ядерной модели атома и эксперим. установлении равенства порядкового номера элемента в периодич. системе заряду ядра (Z) его атома (1913). Совр. формулировка П. з. такова: свойства химич. элементов, а также образуемых ими простых и сложных веществ находятся в периодич. зависимости от заряда ядра атома Z. В рамках квантовой теории атома показано, что по мере возрастания Z периодически повторяется строение внешних электронных оболочек атомов, что определяет свойства и специфику химич. элементов.
Особенность П. з.: в аналитич. виде (в форме уравнения или системы уравнений) он не описывается. При классификации химич. элементов П. з. проявляется в своеобразной «матричной» форме – в виде периодической системы химических элементов. Периодичность иллюстрируется, напр., зависимостью молярных объёмов от величины Z (рис.). Периодично величине Z изменяются также мн. другие характеристики химич. элементов (напр., атомные или ионные радиусы, атомные объёмы). П. з. – фундам. закон природы, действующий во всей Вселенной.
Попытки классификации химических элементов. Открытие периодического закона
Тема: Периодический закон и Периодическая система химических элементов Д.И.Менделеева
Урок: Попытки классификации химических элементов. Открытие периодического закона
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
Триады Дёберейнера.

В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов.
Например, рассмотрим первую триаду: Li, Na, K.
Их атомные массы соответственно равны 7, 23, 39.

Система классификации И.В.Дёберейнера оказалась несовершенной. Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам.
Так, например, триада, содержащая S, Se, Te , не содержала кислорода O.
Ошибка И.В.Дёберейнера заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад.
Но И.В.Дёберейнер был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами.

В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик А.Э. Шанкуртуа в 1862 году предложил свою классификацию химических элементов.

Рис. 1. Спираль Шанкуртуа
Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45 к плоскости основания, так называемая земная спираль. Рис.1. После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
к плоскости основания, так называемая земная спираль. Рис.1. После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.

В 1865 году 18 августа английский ученый Дж.А.Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы.Рис.2.Закон октав он сформулировал следующим образом:
Рис. 2. Октавы Ньюлендса
«Номера аналогичных элементов, как правило, отличаются или на целое число семь или на кратное семи; другими словами члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Он расположил элементы по семь в группы. Таким образом, он заметил, что вертикальные ряды, полученные после такого расположения, включают в себя элементы, схожие по своим химическим свойствам. Дж.А. Ньюлендс был первым, кто соотнес атомные массы химических элементов и их химические свойства и присвоил каждому элементу порядковый номер. Но все же в его таблице не было свободных мест. Он ограничил себя семью клетками в каждом периоде ,и некоторые клетки ему пришлось поместить по несколько элементов. Поэтому научный мир отнесся скептически к его открытию.
В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена.

Рис. 3. Таблица химических элементов Мейера
В 1870 году появилась первая таблица немецкого химика Ю.Л. Мейера под названием « Природа элемента, как функция их атомного веса». В неё были включены 28 элементов, размещенные в 6 столбцов, согласно их валентности. Ю.Л. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерные изменения атомной массы в рядах сходных элементов. Рис. 3.Сходные элементы располагаются в вертикальных рядах таблицы. Некоторые ячейки Ю.Л. Мейер оставил незаполненными.

В марте 1869 года русский химик Д. И. Менделеев представил русскому химическому обществу сообщение об открытии им периодического закона химических элементов. В том же году вышло первое издание Менделеевского учебника «Основы химии», в котором была приведена его периодическая таблица.
В конце 1870 года Д. И. Менделеев делает доклад русскому химическому обществу под названием «Естественные системы химических элементов и применение её к указанию свойств еще неизвестных элементов». В этом докладе Д. И. Менделеев предсказывает существование трех еще неизвестных элементов: экасилиций, экабор и экаалюминий. Он утверждает, что свойства химических элементов, стоящих в одной группе, будут нечто средним между свойствами элементов, стоящих сверху и снизу данного элемента. Если рассматривать этот элемент в периоде, то он будет обладать средними свойствами элементов, стоящими слева и справа от него.

Рис. 4. Таблица химических элементов Менделеева
В 1871 году в итоговой статье « Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса».
Тогда же Д. И. Менделеев придал своей таблице вид, ставшим классическим, так называемый короткий вариант. Рис.4.
Открытие новых химических элементов
В 1875 году П.Л. Буабодран открыл галлий. В 1879 году Л.Ф. Нильсон открыл скандий, а в 1886 году К.Винклер откывает германий. Это соответственно были экабор , экаалюминий, экасилиций, предсказанные Д. И. Менделеевым.
С этого момента периодический закон и периодическая система Д. И. Менделеева становится общепризнанной всем мировым химическим сообществом. Особая заслуга Д. И. Менделеева заключается в том, что он не только расположил химические элементы в определенной последовательности, но и дал описательную характеристику своей периодической системы. При помощи её можно было предсказывать химические свойства различных химических элементов.
По этому поводу Д. И. Менделеев писал: « Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и неожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать — верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы».
Д. И. Менделеев взял на себя смелость оставить пустые клетки в своей таблице и исправить некоторые значения атомных масс химических элементов, предсказать свойства еще неоткрытых целых групп соединений. Таким образом, Д. И. Менделеев является первооткрывателем одного из главных законов природы.
Подведение итога урока
На уроке по теме «Попытки классификации химических элементов. Открытие периодического закона» вы познакомились с подробной исторической справкой о попытках классификации химических элементов учеными-химиками. Узнали о структуре периодического закона химических элементов Д.И. Менделеева, и огромном значении этого закона для химической науки.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
3. Hemi.nsu.ru (Источник).
Рекомендованное домашнее задание
1. №№ 1,2 (с.122) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.:ил.
2. Почему Д.И.Менделеев назвал свой закон периодическим?
3. Сформулируйте Периодический закон. Какие трудности встречались на пути к открытию этого закона?
Периодичности закон — Справочник химика 21
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Согласно формулировке закона Д. И. Менделеева периодичность изменения свойств касается не только химических элементов, но и образуемых ими простых и сложных веществ. Периодичность изменения обнаружена для молярных объемов, температур плавления и кипения, для магнитных и электрических свойств, для теплот образования, теплоемкости и многих других физико-химических свойств, характеризующих простые и сложные вещества. [c.22]
Объяснение физического смысла Периодического закона представляет собой одно из важнейших достижений квантовой механики в химии. Для понимания природы периодичности необходимо иметь в виду следующее [c.100]
Закон периодичности — закон, на котором основана периодическая система элементов периодическое изменение строения электронной оболочки определяет периодичность изменения свойств элементов. [c.373]
I См. также Закон периодичности (стр. 41). [c.281]
ДИАЛЕКТИКА ПЕРИОДИЧНОГО ЗАКОНА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. [c.310]
Как же складывались у Менделеева формулировки основных понятий учения о периодичности закона периодичности и перио- [c.230]
Эта формулировка наводит на ответ столб воздуха должен быть электропроводным при разряде молнии и должен быть неэлектропроводным в остальное время. Разряд молнии сравнительно редкое явление, к тому же очень быстро проходящее. Закон согласования ритмики периодичность появления молниеотвода должна быть та же, что и периодичность появления молнии. [c.196]
Периодический закон периодичность свойств элементов. Периодический закон бы/ открыт Д. И. Менделеевым в 1869 г. и сформулирован им следующим образ
9.Периодический закон и система д.И. Менделеева
Попытки систематизации химических элементов, предпринимались разными учеными и до Менделеева. Однако они не шли дальше установления групп элементов сходных по химическим свойствам или по случайным признакам. Менделеев в основу классификации положил атомную массу элементов и в 1869г. создал периодическую систему, а в 1871 г. сформулировал закон.
Периодический закон: Свойства веществ, а также формы и свойства их соединений находится в периодической зависимости от величины заряда ядра атома (порядкового номера).
Важный этап развития этого закона связан с работами Мозли. 1912г Мозли открыл закон, благодаря которому были рассчитаны заряды ядер многих элементов. Оказалось, совпадают с порядковым номером этих элементов в таблице. Т.о. было установлено, что порядковый номер элемента имеет глубокий физический смысл. Он показывает величину положительного заряда ядра, а, следовательно, и количество электронов в атоме.
Из работ Мозли вытекает вывод: заряды ядер элементов, а значит и количество электронов в атомах изменяются непрерывно, а химические свойства их изменяются периодически. Отсюда следовало, что свойства элементов определяются не общим числом электронов в атоме, а их распределением.
Структуры периодической системы:
Основным принципом построения периодической системы является разделение элементов на группы и периоды. Каждая группа подразделяется на главную и побочную подгруппы.
Группа – совокупность элементов, обладающих химическим сходством при высших значениях окислительных чисел, соответствующих номеру группы.
Подгруппа – это совокупность элементов, обладающих сходством не только в высших степенях окисления, но и общими химическими свойствами, зависящими от исходной структуры электронной оболочки их атомов.
Период — это совокупность элементов, начинающийся щелочным металлом и заканчивающийся благородным газом (кроме I группы).
Периодическая система состоит из 8 групп, 7 периодов (из них 3 малых и 4 больших, седьмой не завершен)
Периодическая система и электронная структура атома
1. Порядковый номер элемента показывает положительный заряд ядра атома этого элемента и общее число электронов в электронной оболочке.
2. Номер периода совпадает с главным квантовым числом внешних электронов атома, показывает кол-во энергетических уровней в электронной оболочке.
3. Число элементов в периодах соответственно равно 2, 8, 8, 18, 18, 32, что соответствует максимально возможному числу электронов на энергетических уровнях.
4. Элементы подгрупп (электронные аналоги) имеют сходные, внешние электронные структуры, что определяет общность их химических свойств.
s-элементы (металлы, кроме водорода; I и II группы главной подгруппы)
p-элементы (металлы, неметаллы; III – VIII группы главной подгруппы)
d— элементы (металлы; все побочные подгруппы)
f-элементы (металлы; лантаноиды, актиноиды)
5. Номер группы соответствует числу электронов на внешнем уровне и показывает, как правило, высшую степень окисления элементов этой группы в соединениях.
6. Физический смысл периодического закона состоит в периодичности повторения сходных электронных конфигураций при возрастании главного квантового числа и объединения элементов по близости их электронного строения.
1 билет
Билет № 1
1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона. Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются.* Сравните: периодичность смены времен года с течением времени. Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе – это не просто очередность, он имеет физический смысл – равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период – это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор – неметалл, и т.д. В конце фтор – галоген и неон – инертный газ.
(Третий период снова начинается щелочным металлом – это и есть периодичность)
1-3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4-7 – большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы – I А, галогены – VII A, инертные газы – VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б – под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.

* точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»
2. Опыт. Проведение реакций, подтверждающих химические свойства хлороводородной кислоты.
Хлороводородная кислота:
Окрашивает растворы индикаторов лакмуса и метилового оранжевого в красный цвет, вследствие диссоциации в водном растворе: HCl → H+ + Cl—
Взаимодействует с металлами, находящимися в ряду напряжений левее водорода, например, с цинком, с образованием соли и газообразного водорода: Zn + 2HCl = ZnCl2 + H2↑
Взаимодействует с оснóвными оксидами с образованием соли и воды: CuO + 2HCl = CuCl2 + H2O (при проведении реакции с оксидом меди (II), пробирку желательно слегка подогреть)
Взаимодействует с основаниями с образованием соли и воды: NaOH + HCl = NaCl + H2O
Вытесняет слабые кислоты из растворов их солей: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Качественная реакция на хлорид-ион – при сливании с раствором соли серебра, образуется белый творожистый осадок, нерастворимый в концентрированной азотной кислоте: AgNO3 + HCl = HNO3 + AgCl↓
13 Периодический закон и периодическая таблица д.И. Менделеева
Д.И. Менделеев, сравнивая изменение атомных масс элементов и их химических свойств, открыл периодический закон:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
В соответствии с современными представлениями о строении атомов главной характеристикой любого элемента является заряд его ядра, поэтому современная формулировка периодического закона имеет вид:
«Свойства элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов».
Отражением периодического закона является периодическая таблица элементов, которую Д.И.Менделеев составил в 1869 г. Она включает периоды и группы.
Период – горизонтальный ряд элементов. В периодической таблице семь периодов. f-элементы (лантаноиды и актиноиды) приведены в виде двух отдельных рядов. В периодах радиусы атомов уменьшаются.
Группа – вертикальный ряд элементов. Группы делятся на главную и побочную подгруппы. У элементов главных подгрупп происходит заполнение внешнего энергетического уровня, а у побочных – предвнешнего. В главных подгруппах расположены металлы и неметаллы, а в побочных – только металлы. Заполнение побочных подгрупп начинается с четвертого периода. В главных подгруппах радиусы атомов увеличиваются. В побочных подгруппах в соответствии с заполнением d- и f-подуровнейпроисходит увеличение электростатического притяжения электронов к ядру, в результате чего радиусы атомов могут даже уменьшаться. Данное явление называют d- и f (лантаноидным)-сжатием. Оно приводит к снижению восстановительной активности и увеличению плотности вещества. Например, для подгруппы меди (Сu, Аg и Аu) плотности данных металлов имеют соответственно значения: 8,96, 10,50 и 19,3 г∕см3.
Элементы, расположенные в одной подгруппе, имеют подобные химические свойства и называются элементами-аналогами. Например:
O, S, Se, Te, Po – расположены в VI главной подгруппе и соответственно являются элементами аналогами;
Cr, Мо, W – расположены в VI побочной подгруппе и также являются элементами аналогами.
Для характеристики химических свойств атомов применяются такие величины, как энергия ионизации, энергия сродства к электрону и электроотрицательность .
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона. Вторая и последующие энергии ионизации – это отрыв электронов от положительно заряженных ионов. Энергия ионизации определяет восстановительные свойства элементов.
Энергия сродства к электрону – это количество энергии, выделяющееся или поглощающееся при присоединении электрона к нейтральному атому. Чем больше энергия сродства атома к электрону, тем более сильным окислителем является данный элемент. Металлы не обладают сродством к электрону.
Электроотрицательность (ЭО) – это величина учитывающая
способность атомов как притягивать, так и отдавать электроны. Относительную электроотрицательность лития условно приняли равной единице и по отношению к ней нашли электроотрицательности остальных элементов. При движении от наименее электоотрицательного элемента – Fr к наиболее электроотрицательному элементу – F электроотрицательность возрастает и соответственно ослабляются металлические и усиливаются неметаллические свойства. Считается, что 22 элемента являются неметаллами, а остальные – металлами.
В периодической таблице в периодах и группах свойства элементов закономерно изменяются, поэтому свойства любого элемента близки к среднеарифметическим значениям свойств элементов, между которыми расположен анализируемый элемент.