Зависимость скорости реакции от природы реагирующих веществ — Студопедия.Нет
ХИМИЧЕСКАЯ КИНЕТИКА.
ХИМИЧЕСКОЕ И ФАЗОВОЕ РАВНОВЕСИЕ. КАТАЛИЗ
Химическая кинетика
Раздел химии, изучающий скорости химических реакций, называется химической кинетикой. Химическая кинетика устанавливает временные закономерности протекания химических реакций, связь между скоростью реакции и условиями ее проведения, выявляет факторы, влияющие на скорость и направление химических реакций.
Процесс химического превращения исходных веществ в продукты реакции, протекающий во всем объеме гомогенной системы, называется гомогенной химической реакцией. Например, при сливании и перемешивании растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
H2SO4 + Na2S2O3 = Na2SO4 + H2O + S + SO2.
Fe + 2HCl = FeCl2 + H2
может протекать только на поверхности металла, потому что только здесь идет соприкосновение реагирующих веществ.
Если реакция протекает в результате непосредственного превращения молекул исходных веществ в молекулы продуктов реакции, то такая реакция называется простой или элементарной. Большинство реакций включают несколько элементарных реакций и называются сложными.
Сложные реакции бывают:
1) Последовательными – если продукт одной из элементарных реакций является исходным веществом в другой и, таким образом, расходуется;
2) Параллельными – если в каждой из элементарных реакций участвует одно и то же исходное вещество;
3) Последовательно-параллельными
– одновременно протекают последовательные и параллельные реакции.В сложных химических реакциях скорость образования конечных продуктов реакции часто зависит от скорости лишь одной, наиболее медленно протекающей элементарной реакции, называемой лимитирующей. Совокупность элементарных реакций, из которых складывается сложная химическая реакция, называется механизмом хим. реакции.
Скорость химической реакции
Скорость химической реакции – это изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции). Это определение можно записать в виде производной:
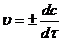
где v – скорость реакции; t – время, c – концентрация.
Если время измерять в секундах, а концентрацию – в молях на литр, то скорость реакции измеряется в единицах моль/(л·с).
Таким образом, скорость реакции не зависит от объема реакционной смеси: при одинаковых условиях она будет одинаковой и в маленькой пробирке, и в многотоннажном реакторе.
Графически скорость процесса будет представлять угловой коэффициент наклона касательной к кривой в точке, соответствующей данному моменту времени (τ1) и равна тангенсу угла наклона.
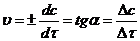
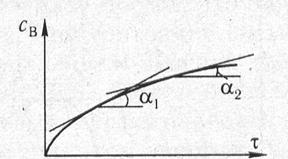
Величина dt всегда положительна, тогда как знак dc зависит от того, как изменяется со временем концентрация – уменьшается (для исходных веществ) или увеличивается (для продуктов реакции). Чтобы скорость реакции всегда оставалась величиной положительной, в случае исходных веществ перед производной ставят знак минус: v = –dc/dt. Если реакция идет в газовой фазе, вместо концентрации веществ в уравнении скорости часто используют давление.
Факторы, влияющие на скорость хим.реакции:
1) Природа реагирующих веществ;
2) Их концентрация;
3) Температура;
4) Присутствие в системе катализаторов.
Зависимость скорости реакции от природы реагирующих веществ
По числу взаимодействующих в элементарном акте молекул определяется молекулярность реакции. Мономолекулярная реакция – реакция, связанная с распадом молекулы на меньшие ее части. Бимолекулярная – реакция, определяемая взаимодействием в элементарном акте 2х молекул. Реакции, требующие одновременного столкновения трех (тримолекулярные) и более молекул, маловероятны и встречаются редко.
Рассмотрим бимолекулярную реакцию.
Чтобы произошла реакция, необходимо сначала преодолеть отталкивание электронных оболочек молекул, разорвать или ослабить связи между атомами исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Для его образования необходима определенная энергия. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием продуктов реакции; при этом энергия выделяется. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не приведет к образованию новой молекулы.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Молекулы, обладающие такой энергией, называются активными. Энергию активации измеряется в кДж/моль. Чем меньше энергия активации молекул, тем выше скорость химической реакции.
Зависимость скорости реакции
от концентраций реагирующих веществ
Скорость большинства реакций со временем постепенно снижается. По мере протекания реакции концентрации исходных веществ падают, снижается и частота столкновений между ними; соответственно уменьшается и частота столкновения активных молекул. Это приводит к уменьшению скорости реакции.
В этом состоит сущность одного из основных законов химической кинетики – закона действия масс (Гульдберг и Вааге, 1867 г.): «Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов».
Математически для реакции
А + 2В = С
это можно записать в виде формулы:
v = k[A][B]2,
где k – постоянная, называемая константой скорости реакции. Приведенное уравнение называется уравнением скорости химической реакции или кинетическим уравнением. Константа скорости для данной реакции не зависит от концентрации реагентов и от времени, но она зависит от природы реагирующих веществ и от температуры в соответствии с уравнением Аррениуса:
k = k0e–Ea/RT.
где k — константа скорости реакции; е — основание натуральных логарифмов; Еа — энергия активации; R — универсальная газовая постоянная; Т — температура по шкале Кельвина; ko —предъэкспоненциальный множитель, указывающий долю числа столкновений между молекулами, которая оканчивается реакцией.
Зависимость скорости химической реакции от концентрации реагирующих веществ справедлива для газов и реакций, протекающих в растворах. В случае твердых веществ, взаимодействие молекул происходит не во всем объеме реагирующих веществ, а лишь на поверхности, от размера которой также зависит скорость реакции.
Константа скорости реакции равна скорости химической реакции при концентрации реагирующих веществ, равных единице.
Формальный порядок (n) – это сумма показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагентов. Для реакции вида
аА + вВ→ ….,
скорость реакции равна υ = k[А]а×[B]b, формальный порядок равен n = а + b.
Кинетический порядок является исключительно экспериментальной величиной.
Влияние температуры на скорость реакции
Ученый Вант-Гофф установил, что, как правило, скорость реакции с повышением температуры возрастает. ПравилоВант-Гоффа: «Повышение температуры на 10 градусов приводит к увеличению скорости реакции в
2… 4, реже более раз». Математическое выражение правила Вант-Гоффа

где υ
γ — температурный коэффициент константы скорости реакции или температурный коэффициент Вант-Гоффа,принимает значения чаще от 2 до 4, (не обязательно значения целых чисел) в зависимости от природы реагирующих веществ. Физический смысл температурного коэффициента: показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов.
Катализ
В 1835 шведский химик Й.Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (от греч. katalysis – расслабление). Как считал Берцелиус, катализаторы обладают особой способностью ослаблять связи между атомами в молекулах, участвующих в реакции, облегчая таким образом их взаимодействие. Большой вклад в развитие представлений о работе катализаторов внес немецкий физикохимик В.Оствальд, который в 1880 дал определение катализатора как вещества, которое изменяет скорость реакции. А явление ускорения химических реакций под действием катализаторов, которые сами в ходе реакции не изменяются, стали называть катализом. Каталитические процессы играют огромную роль в нашей жизни. Без катализаторов не могли бы протекать многие промышленные процессы. Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Применение катализаторов способствовало бурному развитию химической промышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Особую роль играют каталитические процессы в охране окружающей среды.
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими реакциями. Катализаторы, называемые в этом случае ферментами, представляют собой простые или сложные белки. В организме человека находится около 30 000 различных ферментов; каждый их них служит эффективным катализатором соответствующей реакции.
Основные понятия катализа
Катализом называют ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Катализ принято называть положительным, когда катализатор увеличивает скорость реакции, и отрицательным, когда катализатор уменьшает скорость реакции. Вещества, в присутствии которых скорость реакции уменьшается, называются ингибиторами.
Реакции, которые каталитически ускоряются продуктами, получаемыми в этой же реакции, называют автокаталитическими (самоускоряющимися). Скорость этих реакций возрастает во времени. Например, восстановление оксида железа водородом
FeO + H2 = Fe + H2O
катализируется железом, образующимся в результате реакции.
Введение в катализатор некоторых добавок, которые сами не обладают каталитической активностью, может сильно повысить активность катализатора. Такие добавки называют промоторами. Например, синтез аммиака осуществляется на железном катализаторе, к которому добавляют малые количества К2О и Аl2О3.
Каталитические яды – это вещества, которые снижают активность катализатора (мышьяк, сурьма, пары ртути). С целью увеличения срока действия катализаторов в технологических схемах предусматривается тщательная очистка реагирующих веществ от каталитических ядов (в производстве NH3 – от CO, CO2, S–содержащих соединений).
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическое равновесие – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Зависимость скорости химической реакции от природы реагирующих веществ
Скорость химических реакций. Зависимость скорости реакции от природы реагирующих веществ, концентрации и температуры [c.127]Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. [c.89]
ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ [c.52]
Объясните зависимость скорости химической реакции от природы реагирующих веществ, [c.144]
Зависимость скорости реакций от природы реагирующих веществ. Чем выше химическое сродство реагирующих веществ, тем энергичнее и быстрее происходит реакция между ними. Например, водород с фтором реагирует даже при низкой температуре со взрывом, тогда как водород с кислородом взаимодействуют только при высокой температуре. [c.85]
Химическая кинетика. Скорость химических реакций. Зависимость скорости реакции от природы, поверхности соприкосновения и концентрации реагирующих веществ, температуры реакции и катализаторов. Закон действующих масс для скорости химической реакции. Понятие о катализе. Катализаторы и ингибиторы. [c.26]
Зависимость скорости реакций- от природы реагирующих веществ, величины поверхности соприкосновения, концентрации, температуры и катализатора 56—59 Понятие о катализе 58—59 Обратимость химических реакций 59, 62 71, 75. [c.186]
Скорость химических реакций. Зависимость скорости реакции от природы и концентрации реагирующих веществ, температуры. Константа скорости химической реакции. Энергия активации. Катализ и катализаторы. [c.501]
Опыт 4. Иллюстрация зависимости скорости химической реакции от природы реагирующих веществ, размеров поверхности соприкосновения, концентрации. Демонстрируется в пробирках по общей методике. Скорость устанавливают визуальным наблюдением за выделением пузырьков или интервалу времени помутнения растворов от выделяющейся серы. Пробирки надо брать увеличенной высоты — 80 мм, чтобы избежать выброса жидкости. Объектом для такой демонстрации может служить взаимодействие разбавленных растворов серной, соляной или уксусной кислот с металлами цинком, оловом, железом, алюминием различной степени дисперсности (гранулы, порошок). [c.158]
На скорость химических реакций влияет много факторов природа реагирующих веществ, их концентрация, температура, давление, наличие катализаторов и др. В предложенных задачах необходимо учитывать влияние на скорость реакций только двух факторов — концентрации реагирующих веществ и температуры. Кратко охарактеризуем величины, которыми следует оперировать в процессе решения задач, а также закономерности, определяющие зависимости между этими величинами. [c.53]
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. Концентрацию реагирующих веществ чаще всего выражают количеством грамм-молекул в 1 л. Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры и присутствия катализатора. Увеличение концентрации реагирующих веществ приводит к увеличению вероятности столкновения молекул. В зависимости от запаса энергии молекул реагирующих веществ столкновения могут заканчиваться образованием молекул новых веществ. [c.35]
Скорость химической реакции зависит не только от концентрации реагирующих веществ и температуры, но также и от присутствия в реакционной смеси некоторых веществ. Эти вещества, не входя в состав конечных продуктов реакции, изменяют скорость реакции, причем сами не изменяются количественно и остаются химически неизменными. Такие вещества называются катализаторами. Катализаторы, в зависимости от их природы и природы реагирующих веществ, могут увеличивать или уменьшать скорость химической реакции поэтому различают положительный катализ (катализатор увеличивает скорость реакции) и отрицательный катализ (катализатор уменьшает скорость реакции). [c.160]
Как известно, химическая кинетика изучает скорости протекания реакций и зависимость этих скоростей от различных факторов — природы, концентрации реагирующих веществ, давления, температуры, катализаторов и др. Опыт показывает, что скорости химических реакций могут значительно отличаться друг от друга некоторые реакции, сопровождающиеся взрывом, протекают в тысячные доли секунды, другие же совершаются в течение значительно более длительного времени. Так, ржавление железа становится заметным уже через несколько часов после того, как оно пришло в контакт с водой или влажным воздухом, а процессы, совершаемые в земной коре (например, образование антрацита), протекают в течение сотен и тысяч лет. [c.84]
Химическая кинетика изучает скорость и механизм химических процессов, а также зависимость их от различных факторов — природы реагирующих веществ, их концентрации, температуры, наличия катализатора, среды, в которой происходит реакция, и других параметров. [c.65]
Под ферментативной кинетикой понимают закономерности изменения скорости реакции в зависимости от химической природы реагирующих веществ и условий их взаимодействия. Под условиями взаимодействия понимают влияние концентрации реагирующих веществ, температуры, давления, присутствия ингибиторов или активаторов и т. п. В настоящем разделе из всех перечисленных факторов рассматривается только влияние концентрации субстрата и фермента. [c.374]
Под ферментативной кинетикой в широком смысле понимают зависимость скорости реакции, ускоряемой ферментом, от химической природы
1. Зависимость скорости химической реакции от природы реагирующих веществ.
Говорить о скорости химической реакции имеет смысл, если природа реагирующих веществ позволяет им вступать в химическое взаимодействие. Например, природа реагирующих веществ позволяет протекать первой и второй реакции, но не позволяет третьей.
1. Mg + O22MgО
2.
Zn + 2HCl  ZnCl2 + H2↑
ZnCl2 + H2↑
3.
NaOH
+ KOH
≠
2. Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действия масс, который был установлен в 1867г опытным путем Гульдбергом и Вааге.
Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму реакций взаимодействия, протекающих в газах или в разбавленных растворах.
Для гомогенных реакций:
1.aA(Ж) + bB(Ж) ↔ cC(Ж) + dD(Ж) ;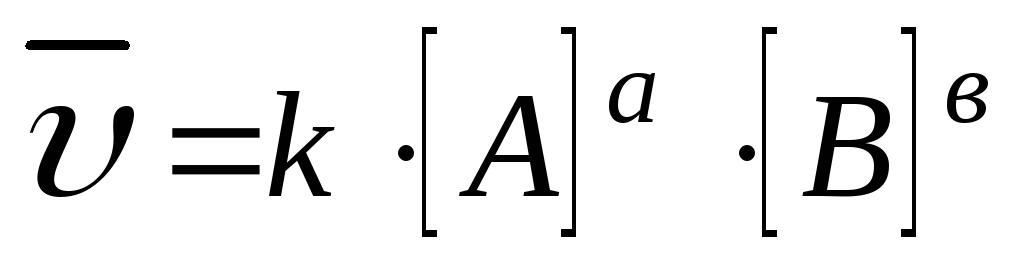 (T=const)
(T=const)
2.
3H2(Г) + N2(Г) ↔ 2NH3(Г); 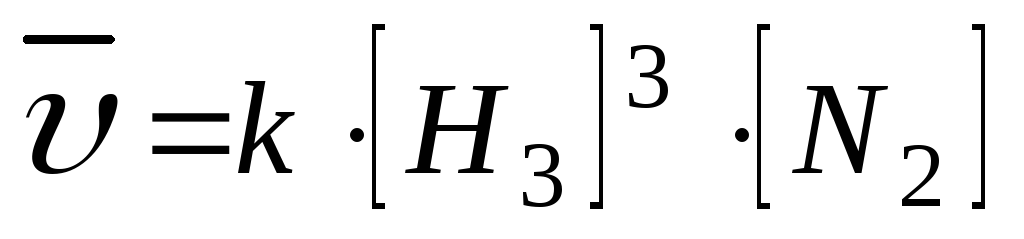
Для гетерогенных реакций:
1.
aA(т) + bB(Г) = cC(Г) + dD(Г); 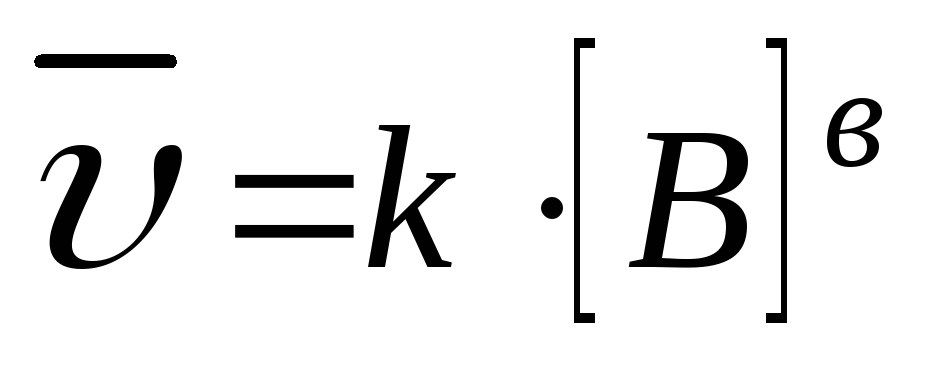 2. С (т)+О2(Г)=СО2(Г);
2. С (т)+О2(Г)=СО2(Г); 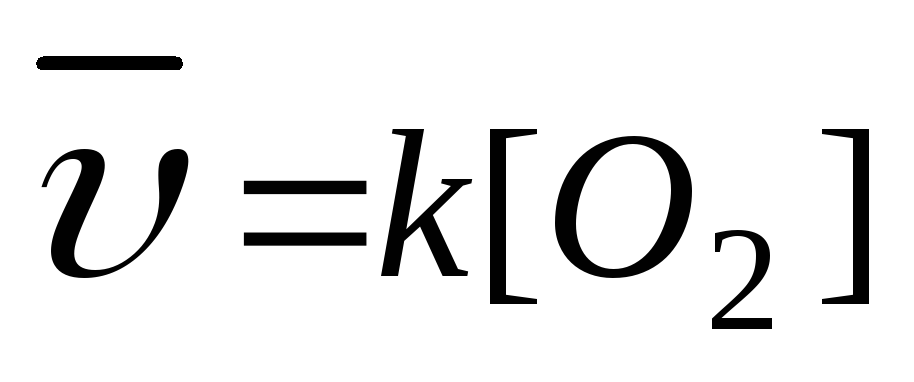
В законе действия масс не учитываются концентрации веществ, находящихся в твердой фазе. Чем больше площадь поверхности твердой фазы, тем выше скорость химической реакции.
k
– константа скорости химической реакции определяется природой реагирующих
веществ и зависит от температуры, от
присутствия в системе катализатора, но
не зависит от концентрации реагирующих
веществ. Константа скорости представляет
собой скорость химической реакции
(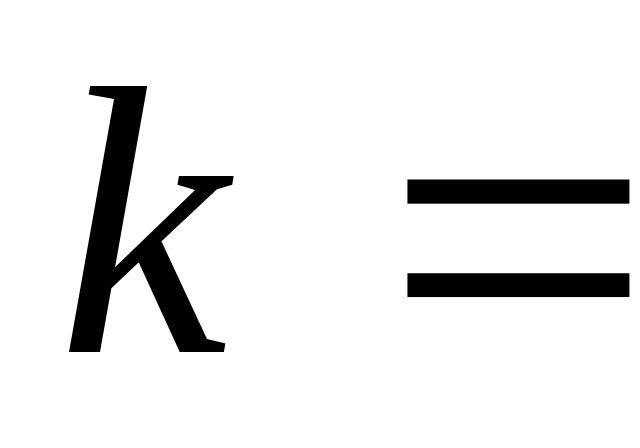
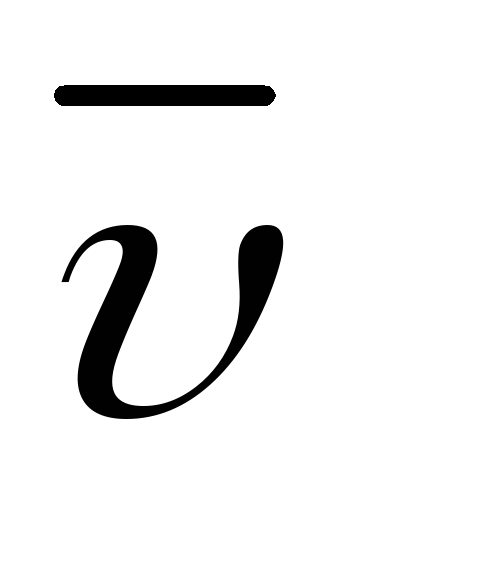 ),
если концентрации реагирующих веществ
),
если концентрации реагирующих веществ .
.
3. Зависимость скорости химической реакции от давления. Для газообразных систем увеличение давления или уменьшение объема, равноценно увеличению концентрации и наоборот.
Задача: Как изменится
скорость химической реакции 2SO2(г) + O2(г) 2SO3(г),
если давление в системе увеличить в 4
раза?
2SO3(г),
если давление в системе увеличить в 4
раза?
В соответствие с законом действия масс для прямой реакции, записываем выражение:
 ,
пусть [SO2]=a
моль/л, [O2]=b
моль/л, тогда по закону действия масс
,
пусть [SO2]=a
моль/л, [O2]=b
моль/л, тогда по закону действия масс 
Уменьшение объема в 4 раза соответствует увеличению концентрации в системе в 4 раза, тогда
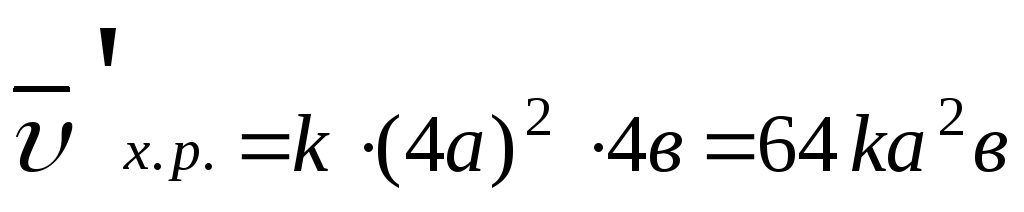 ;
;
 .
.
4. Зависимость скорости химической реакции от температуры.
Влияние температуры на скорость химической реакции приближенно определяется правилом Вант-Гоффа. При повышении температуры на 100С скорость химической реакции возрастает в 2-4раза.
Математическая
запись правила Вант-Гоффа: 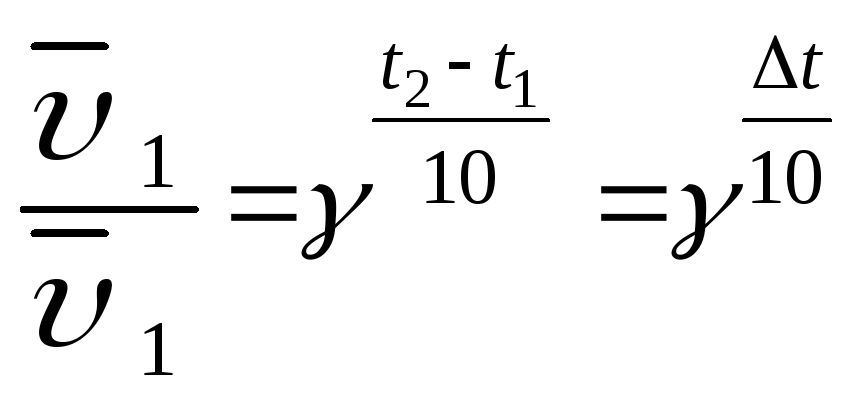 γ
— температурный коэффициент скорости
реакции или коэффициент Вант-Гоффа для большинства
реакций лежит в пределах 2-4.
γ
— температурный коэффициент скорости
реакции или коэффициент Вант-Гоффа для большинства
реакций лежит в пределах 2-4.
Задача. Во сколько раз изменится скорость химической реакции, протекающей в газовой фазе, если температура изменилась от 80 0С до 120 0С (γ = 3)?
В соответствии с правилом Вант-Гоффа записываем:
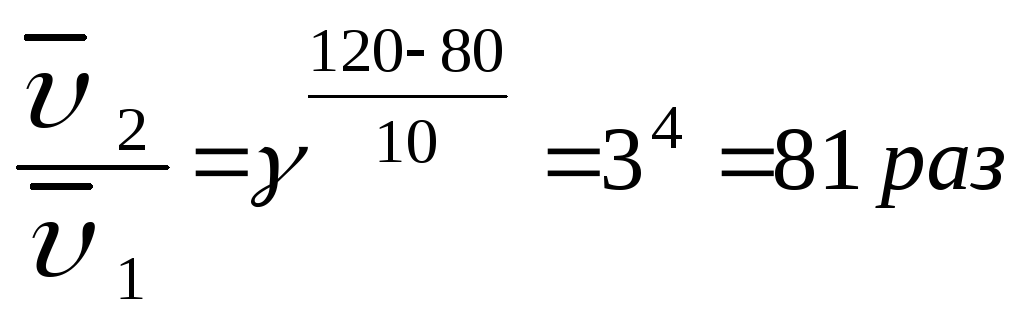
Увеличение
скорости химической реакции при повышении
температуры объясняется не только
увеличением кинетической энергии
взаимодействующих молекул. Например,
число столкновений молекул растет
пропорционально корню квадратному из
абсолютной температуры .
При нагревании веществ от нуля до ста
градусов по Цельсию, скорость движения
молекул возрастает в 1,2 раза
.
При нагревании веществ от нуля до ста
градусов по Цельсию, скорость движения
молекул возрастает в 1,2 раза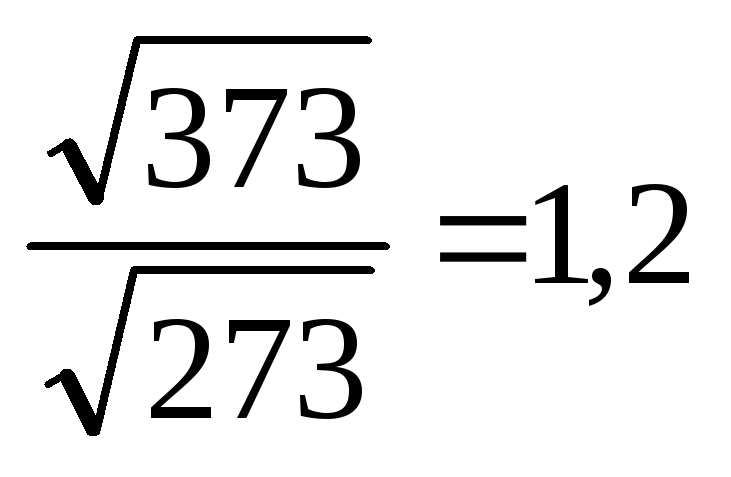 ,
а скорость химической реакции возрастает
примерно в 59 тысяч раз. Такое резкое
увеличение скорости реакции с ростом
температуры объясняется долей активных
молекул, столкновения которых приводит
к химическому взаимодействию. Согласно
теории активных столкновений в реакцию
вступают толькоактивные
молекулы, энергия которых превышает среднюю
энергию молекул данного вещества, т.е.
молекулы, обладающие энергией активации.
,
а скорость химической реакции возрастает
примерно в 59 тысяч раз. Такое резкое
увеличение скорости реакции с ростом
температуры объясняется долей активных
молекул, столкновения которых приводит
к химическому взаимодействию. Согласно
теории активных столкновений в реакцию
вступают толькоактивные
молекулы, энергия которых превышает среднюю
энергию молекул данного вещества, т.е.
молекулы, обладающие энергией активации.
Энергия активации (EА)– это тот избыток энергии по сравнению со средним запасом, которым должны обладать молекулы для осуществления химической реакции. Если ЕА< 40 кДж/моль – реакции протекают быстро, если ЕА > 120 кДж/моль – реакции не идут, если ЕА = 40-120 кДж/моль – реакции протекают в обычных условиях. Повышение температуры снижает энергию активации, делает вещества более реакционно-способными, скорость взаимодействия при этом увеличивается.
Более
точную зависимость скорости химической
реакции от температуры установил C.Аррениус:
константа скорости реакции пропорциональна
основанию натурального логарифма,
возведенного в степень ( –ЕА/RT).  ,
,
А – предэкспоненциальный множитель, определяет число активных
соударений;
е – экспонента (основание натурального логарифма).
Логарифмируя
выражение  ,
получим уравнение:
,
получим уравнение:
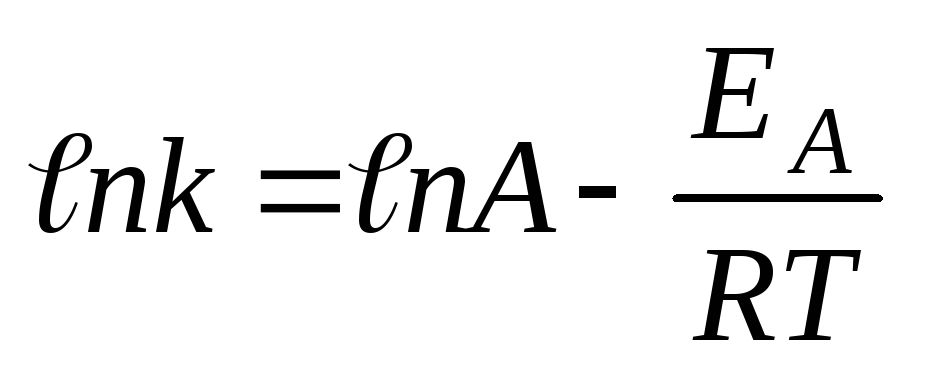 . Уравнение
Аррениуса показывает, что скорость
реакции тем выше, чем меньше энергия
активации. Для снижения энергии активации
используют катализаторы.
. Уравнение
Аррениуса показывает, что скорость
реакции тем выше, чем меньше энергия
активации. Для снижения энергии активации
используют катализаторы.
Урок по химии Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры.
Тема: Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры.
Цели урока: Показать влияние на скорость химических реакций таких факторов, как природа реагирующих веществ, их концентрация, площадь соприкосновения и температура.
Оборудование и реактивы для демонстрационного эксперимента:
«Природа реагирующих веществ» — натрий, калий, вода с фенолфталеином, пробирки.
«Концентрация реаг веществ»- растворы с разной концентрацией карбоната натрия и соляная кислота.
«От температуры» — оксид меди в 3-х пробирках, серная кислота, горячая вода в химическом стакане на лаб. Плитке, держатель для пробирок, спички, спиртовка.
«От площади соприкосновения» — гранулы цинка, цинковые пластинки, соляная кислота.
Ход урока
(План урока на доске не указывается, но структура плана вырисовывается устно в ходе рассмотрения отдельных факторов, влияющих на скорость химических реакций. Ученики активно привлекаются к описанию факторов, предлагают текст дла записи в тетради).
И так, на прошлом уроке мы дали определение скорости химической реакции – 1 ученик определение…
Запишем формулу для вычисления скорости ХР – 1 ученик на доске….
Таким образом, какая единица взята за основу изменения вещества…
Решим задачу: Вычислите среднюю скорость реакции А+ В → 2С, если концентрация вещества А была 0,22 моль/л, а через 10с стала 0,215 моль/л. (0,0005 моль/лс.)
Безусловно, есть ряд факторов, которые оказывают влияние на скорость.
I. Влияние природы реагирующих веществ.
Д. Взаимодействие калия и натрия с водой.
Калий и натрий реагируют с водой, но скорость реакции калия с водой больше. -Почему?
-Влияние природы.
-Что принято понимать под природой?
— Особенности строения атомов.
-Сравним количество электронов на внешнем уровне.
— Сравним радиусы атомов._____________В этом найдем причину различной активности.
II Влияние концентрации реагирующих веществ.
Д. Взаимодействие с соляной кислотой растворов карбоната натрия с различной концентрацией.
— Что пронаблюдали?
-О чём это говорит? – ученики должны в своих ответах применять понятие «концентрация».
Этот эксперимент можно обобщить законом действующих масс:
υр=kСАn+ CBm (k- константа скорости реакции, скорость реакции от концентрации не зависит, а зависит от температуры и природы вещества. не зависит)
Решим задачу по нашему эксперименту:
Концентрация карбоната натрия в растворе была 0,5 мль/л, а конц соляной кислоты 0,25 моль/л, константа скорости данной реакции равна 1. (0,0313моль/лс)
III Влияние температуры.
Д. В 3 пробирки насыпать оксид меди и прилить раствор серной кислоты.
1 пробирку оставить в штативе: 2 пробирку поставить в хим стакан с горячей водой; 3 пробирку нагреть в пламени спиртовки. По интенсивности окрашивания раствора в синий цвет судим о скорости реакции.
Влияние темп было исследовано Вант-Гоффом и представлено им в виде закона.
Закон Вант-Гоффа: При изменении температуры (↓↑) реакции на каждые 10 0С скорость реакции изменяется соответственно (↓↑) 2-4 раза.
IV От площади соприкосновения реагирующих веществ.
Д. Взаимодействие цинка с соляной кислотой.
В три пробирки помещаю гранулу цинка, цинковую пластинку и в третью – порошок цинка, наливаю по 3 мл соляной кислоты.
Эксперимент убедительно доказывает влияние площади соприкосновение на скорость веществ.
VI Исходя из вопроса: все ли реагенты могут быть в одинаковом агрегатном состоянии, делаю переход на фазную классификацию химических реакций.
Гомогенные (однофазные) — реагирующие вещества находятся в одинаковом агрегатном состоянии (Ж-Ж, Г-Г)
Гетерогенные (разнофазные) — реагирующие вещества находятся в разных агрегатных состояниях. (Г-Ж, Г-Т, Т-Ж)
VII Домашнее задание. Выучить материал лекции по тетради.
Скорость химической реакции зависимость от природы веществ
Скорость химических реакций. Зависимость скорости реакции от природы реагирующих веществ, концентрации и температуры [c.127]Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. [c.89]
ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ [c.52]
Объясните зависимость скорости химической реакции от природы реагирующих веществ, [c.144]
Зависимость скорости реакций от природы реагирующих веществ. Чем выше химическое сродство реагирующих веществ, тем энергичнее и быстрее происходит реакция между ними. Например, водород с фтором реагирует даже при низкой температуре со взрывом, тогда как водород с кислородом взаимодействуют только при высокой температуре. [c.85]
Химическая кинетика. Скорость химических реакций. Зависимость скорости реакции от природы, поверхности соприкосновения и концентрации реагирующих веществ, температуры реакции и катализаторов. Закон действующих масс для скорости химической реакции. Понятие о катализе. Катализаторы и ингибиторы. [c.26]
Скорость химических реакций. Зависимость скорости реакции от природы и концентрации реагирующих веществ, температуры. Константа скорости химической реакции. Энергия активации. Катализ и катализаторы. [c.501]
Зависимость скорости реакций- от природы реагирующих веществ, величины поверхности соприкосновения, концентрации, температуры и катализатора 56—59 Понятие о катализе 58—59 Обратимость химических реакций 59, 62 71, 75. [c.186]
Опыт 4. Иллюстрация зависимости скорости химической реакции от природы реагирующих веществ, размеров поверхности соприкосновения, концентрации. Демонстрируется в пробирках по общей методике. Скорость устанавливают визуальным наблюдением за выделением пузырьков или интервалу времени помутнения растворов от выделяющейся серы. Пробирки надо брать увеличенной высоты — 80 мм, чтобы избежать выброса жидкости. Объектом для такой демонстрации может служить взаимодействие разбавленных растворов серной, соляной или уксусной кислот с металлами цинком, оловом, железом, алюминием различной степени дисперсности (гранулы, порошок). [c.158]
На скорость химических реакций влияет много факторов природа реагирующих веществ, их концентрация, температура, давление, наличие катализаторов и др. В предложенных задачах необходимо учитывать влияние на скорость реакций только двух факторов — концентрации реагирующих веществ и температуры. Кратко охарактеризуем величины, которыми следует оперировать в процессе решения задач, а также закономерности, определяющие зависимости между этими величинами. [c.53]
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. Концентрацию реагирующих веществ чаще всего выражают количеством грамм-молекул в 1 л. Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры и присутствия катализатора. Увеличение концентрации реагирующих веществ приводит к увеличению вероятности столкновения молекул. В зависимости от запаса энергии молекул реагирующих веществ столкновения могут заканчиваться образованием молекул новых веществ. [c.35]
Скорость химической реакции зависит не только от концентрации реагирующих веществ и температуры, но также и от присутствия в реакционной смеси некоторых веществ. Эти вещества, не входя в состав конечных продуктов реакции, изменяют скорость реакции, причем сами не изменяются количественно и остаются химически неизменными. Такие вещества называются катализаторами. Катализаторы, в зависимости от их природы и природы реагирующих веществ, могут увеличивать или уменьшать скорость химической реакции поэтому различают положительный катализ (катализатор увеличивает скорость реакции) и отрицательный катализ (катализатор уменьшает скорость реакции). [c.160]
Как известно, химическая кинетика изучает скорости протекания реакций и зависимость этих скоростей от различных факторов — природы, концентрации реагирующих веществ, давления, температуры, катализаторов и др. Опыт показывает, что скорости химических реакций могут значительно отличаться друг от друга некоторые реакции, сопровождающиеся взрывом, протекают в тысячные доли секунды, другие же совершаются в течение значительно более длительного времени. Так, ржавление железа становится заметным уже через несколько часов после того, как оно пришло в контакт с водой или влажным воздухом, а процессы, совершаемые в земной коре (например, образование антрацита), протекают в течение сотен и тысяч лет. [c.84]
Для образования комплекса с карбамидом важны не химиче- ская природа вещества, а конфигурация и размеры-его молекул. Методом ЯМР доказано, что углеводородные молекулы включения имеют некоторую свободу вращения относительно оси, параллельной оси канала. Следовательно, комплексообразование с карбамидом— физическое явление. При образовании-комплекса карбамида с углеводородами устанавливается равновесие так же, как и в случае химических реакций. Следовательно, этот процесс подчиняется законам протекания обратимых реакций и изменение условий комплексообразования влияет на скорость и полноту извлечения комплексообразующ их углеводородов. В зависимости от агрегатного состояния карбамида и н-алкана возможны три. типа процессов [c.211]
От каких факторов зависит скорость химических реакций Дайте определение закона действующих масс. В равенствах, выражающих этот закон, отражена ли зависимость скорости реакции от природы реагирующих веществ [c.165]
При сравнительном изучении восстановления ионов индия на капельном ртутном катоде было найдено [140, 141], что на характер полярографической кривой влияют
6.2.3 Зависимость скорости реакции от температуры
При повышении температуры скорость реакций, как правило, резко возрастает. Например, при комнатной температуре скорость взаимодействия водорода с кислородом практически нулевая, при температуре 400 °С она делается заметной, хотя и остается небольшой, а при температуре 600 °С реакция протекает со взрывом.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С, называется температурным коэффициентом скорости (γ) этой реакции.
Для большинства реакций γ равно 2-3 (правило Вант-Гоффа).
Зная величину γ, а также скорость реакции при одной температуре Т1, можно вычислить ее скорость при другой температуре Т2, воспользовавшись уравнением:
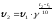 (11)
(11)
При расчетах по этому уравнению нетрудно заметить, что при повышении температуры скорость реакции возрастает очень резко. Так, если γ = 2, то повышение температуры, например, от 0 °С до 100 °С приводит к повышению скорости реакции в 2100/10=210=103 раз.
Объяснить столь резкое увеличение скорости реакции одним только увеличением числа соударений между частицами реагентов за счет возрастания скорости их движения (вычисляемой на основании кинетической теории газов) нельзя.
Если с помощью молекулярно-кинетической теории газов и жидкостей подсчитать число соударений между молекулами тех или иных веществ при определенных условиях, то окажется, что число соударений столь велико, что все реакции должны протекать мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продуктов реакции. Для того чтобы это произошло, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не приведет к образованию новой молекулы. Если же кинетической энергии сталкивающихся молекул достаточно для ослабления или разрыва связей, то столкновение может привести к перестройке атомов с образованием переходного состояния (активированного комплекса) и затем к образованию молекулы нового вещества:
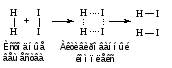
В состоянии активированного комплекса связи в исходных частицах ослаблены, как бы надорваны, и уже образуются новые связи, которые, однако, еще не стали такими же прочными, как в конечных веществах.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Ее определяют опытным путем, обозначают Еа и обычно выражают в [кДж/моль]. Молекулы, обладающие такой энергией, называются активными молекулами.
Если большое число молекул заключено при постоянной температуре в некотором объеме, то за счет хаотических соударений в результате теплового движения запас энергии у разных молекул будет различным. Какая-то доля молекул будет обладать наиболее вероятным запасом энергии Еа. Количество молекул N, обладающих иным запасом энергии, будет меньшим, чем больше их энергия отличается от ЕW.
На рисунке 6.2 (кривая 1) показано типичное распределение молекул по энергии при постоянной температуре t1. При повышении температуры до t2 ЕW возрастает (ЕW2 > ЕW1), и кривая распределения молекул по энергии сдвигается в сторону больших энергий (кривая 2), что приводит к возрастанию во много раз доли молекул, обладающих энергией, равной или большей Еа (заштрихованная область на рисунке). Это и является причиной резкого увеличения скорости химических реакций при повышении температуры.

1 – при температуре t1, 2 – при температуре t2 > t1
Рисунок 6.2 – Распределение молекул по энергии
Зависимость скорости реакции от температуры выражается уравнением Аррениуса:
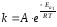 (12)
(12)
где k – константа скорости реакции; А – коэффициент, отражающий природу реагирующих веществ; Еа – энергия активации для данного процесса; R – универсальная газовая постоянная; Т – абсолютная температура.
Зависимость скорости реакции от присутствия катализатора
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции под действием катализаторов называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации (рисунок 6.3). В присутствии катализатора возникают другие активированные комплексы, для образования которых требуется меньше энергии, чем для образования комплексов, возникающих без катализатора. Таким образом, энергия активации понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
В зависимости от того, однородна или неоднородна среда, в которой протекает каталитическая реакция, различают два вида катализа: гомогенный и гетерогенный.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе, газовой или растворе.
При гетерогенном катализе катализатор и реагенты находятся в разных фазах, например газообразная реакционная смесь и твердый катализатор.

Рисунок 6.3 – Изменение энергии реагирующей системы
Гомогенный катализ, как правило, связан с образованием ре-акционноспособных промежуточных соединений. Примером гомогенного катализа может служить окисление сернистого ангидрида до серного в присутствии оксидов азота. Механизм реакции следующий. Молекула NO легко присоединяет кислород:
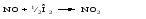
Образовавшаяся молекула отдает кислород на окисление сернистого газа:

Регенерированная молекула NO снова присоединяет кислород и окисляет и т.д.
При гетерогенном катализе реакция протекает на поверхности катализатора, поэтому особую роль играют площадь поверхности, состав и структура поверхностного слоя катализатора. В свою очередь, структура катализатора зависит от способа его приготовления, в частности, от термической обработки. Наилучшими каталитическими свойствами обычно обладают катализаторы, приготовленные при возможно более низкой температуре и потому имеющие несовершенную кристаллическую структуру и большую удельную поверхность. Так, часто применяемый в качестве катализатора оксид алюминия получают обезвоживанием гидроксида при температуре не выше 400 °С. Никелевые катализаторы, которые используются в реакциях гидрирования, получают восстановлением гидроксида никеля водородом при температуре 300 °С; если температура более высокая, то активность катализатора понижается.
Катализаторы отличаются друг от друга по специфичности действия. Так, существуют универсальные катализаторы, применимые к самым разнообразным реакциям. Например, платина может катализировать как реакции окисления, так и реакции гидрирования, хотя по возможности ее стараются заменять более дешевыми веществами.
Некоторые катализаторы способны катализировать целую группу однотипных реакций, т.е. обладают групповой специфичностью. Например, оксид ванадия может служить катализатором для реакций окисления оксида серы, аммиака и других веществ. Никель является хорошим катализатором для реакций гидрирования (присоединения водорода).
Абсолютной специфичностью отличаются многие ферменты – белковые вещества, являющиеся катализаторами биохимических процессов в живых организмах. Так, в организме человека действует несколько десятков тысяч ферментов, большинство из которых катализируют только одну специфическую реакцию.
В качестве катализатора могут выступать продукты самой реакции – такое явление носит название автокатализа. Например, реакция окисления щавелевой кислоты перманганатом калия ускоряется по мере того, как в системе накапливается продукт реакции – ионы Мn2+, играющие роль катализатора.
Обычно каталитическим действием обладает не вся поверхность катализатора, а лишь незначительная часть ее – так называемые активные центры. Есть вещества – «каталитические яды» (ингибиторы), которые, попадая на катализатор, выводят его из строя, «отравляют» его. Например, платиновые катализаторы отравляются соединениями мышьяка, селена и теллура. Отравление катализатора происходит под действием очень небольших количеств каталитических ядов, достаточных для блокирования лишь активных центров. Действие ингибиторов может быть также связано с дезактивацией активных частиц реагентов и промежуточных продуктов.
В качестве ингибиторов могут выступать не только посторонние для данной реакции вещества. Ими могут быть и продукты самой катализируемой реакции в том случае, если они прочно адсорбируются на поверхности катализатора и закрывают доступ к ней молекулам реагирующих веществ.
Ингибиторы используются на практике для защиты металлов от коррозии, а также для стабилизации малоустойчивых веществ. Так, катализаторами разложения пероксида водорода являются соединения меди, железа, марганца, которые легко могут попасть в нее в производственных условиях. Для связывания этих металлов в нерастворимые соединения к пероксиду добавляют в качестве стабилизатора небольшое количество фосфатов, которые играют роль ингибиторов.
Зависимость скорости химической реакции от природы веществ
В пробирке с цинком выделение пузырьков газа протекает интенсивнее, чем в пробирке с железом, т. к. цинк является более активным металлом, чем железо (в ряду активности металлов цинк стоит левее железа).
| 2HCl + Zn ⟶ ZnCl2 + H2↑ 2H+ + 2Cl— + Zn ⟶ Zn2+ + 2Cl— + H2↑ 2H+ + Zn ⟶ Zn2+ + H2↑ Рассмотрим окислительно-восстановительные процессы. |
||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Zn0 — 2ē ⟶ Zn+2 | 1 | восстановитель (окисление) |
| 2HCl + Fe ⟶ FeCl2 + H2↑ 2H+ + 2Cl— + Fe ⟶ Fe2+ + 2Cl— + H2↑ 2H+ + Fe ⟶ Fe2+ + H2↑ Рассмотрим окислительно-восстановительные процессы. |
||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Fe0 — 2ē ⟶ Fe+2 | 1 | восстановитель (окисление) |
В пробирке с соляной кислотой наблюдается более интенсивное выделение газа, чем в пробирке с уксусной кислотой потому, что соляная кислота – сильная кислота, а уксусная кислота – слабая кислота.
| 2HCl + Zn ⟶ ZnCl2 + H2↑ 2H+ + 2Cl— + Zn ⟶ Zn2+ + 2Cl— + H2↑ 2H+ + Zn ⟶ Zn2+ + H2↑ Рассмотрим окислительно-восстановительные процессы. |
||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Zn0 — 2ē ⟶ Zn+2 | 1 | восстановитель (окисление) |
| 2CH3COOH + Zn ⟶ (CH3COO)2Zn + H2↑ Рассмотрим окислительно-восстановительные процессы. |
||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Zn0 — 2ē ⟶ Zn+2 | 1 | восстановитель (окисление) |