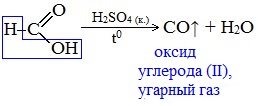
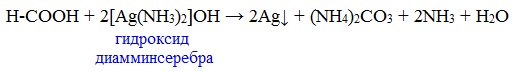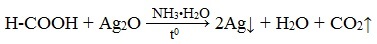Агрегатные состояния вещества схема: Агрегатные состояния вещества – таблица и формулы
Конспект «МКТ. Агрегатные состояния вещества»
МКТ. Агрегатные состояния вещества
Раздел ОГЭ по физике: 2.1. Молекула – мельчайшая частица вещества. Агрегатные состояния вещества. Модели строения газов, жидкостей, твердых тел.
Основы молекулярно-кинетической теории
Существует множество явлений природы, которые можно понять, лишь зная строение вещества. К таким явлениям относятся, например, процессы нагревания и охлаждения тел, превращения вещества из твёрдого состояния в жидкое и газообразное, образования тумана и др.
В основе молекулярно-кинетической теории строения вещества лежат три положения:
- Все вещества состоят из мельчайших частиц – молекул и атомов. Молекулы разделены промежутками.
- Молекулы находятся в беспрерывном хаотическом движении.
- Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся по законам квантовой механики. Размеры атома ~ 10–10 м.
Молекула – наименьшая устойчивая частица вещества, обладающая всеми его химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединённых химическими связями. При уменьшении расстояния между молекулами сила притяжения увеличивается медленнее, чем сила отталкивания.
Доказательством положения 1 МКТ служат факты, установленные в ходе наблюдений и экспериментов. К таким фактам относятся сжимаемость тел, растворимость веществ в воде и др. Так, если растворить немного краски в воде, то вода окрасится. Если каплю этой воды поместить в другой стакан с чистой водой, то эта вода также окрасится, только цвет её будет менее насыщенным. Можно повторить эту операцию ещё несколько раз. В каждом случае раствор будет окрашен, только более слабо, чем в предыдущем. Это значит, что капля краски делится на частицы. Приведённые факты и описанный опыт позволяют сделать вывод о том, что тела не сплошные, они состоят из маленьких частиц.
О том, что тела не сплошные, а между частицами, из которых они состоят, существуют промежутки, свидетельствует то, что газ в цилиндре можно сжать поршнем, можно сжать воздух в воздушном шаре, ластик или кусок резины, тела сжимаются при охлаждении и расширяются при нагревании. Так, ненагретый шарик свободно проходит через кольцо, диаметр которого чуть больше диаметра шарика. Если шарик нагреть в пламени спиртовки, то он в кольцо не пройдет.
Из опытов, которые были рассмотрены выше, следует, что вещество можно разделить на отдельные частицы, сохраняющие его свойства. Однако существует определённый предел деления вещества, т.е. существует самая маленькая частица вещества, которая сохраняет его свойства. Меньшей частицы, которая сохраняет свойства данного вещества, просто не существует. Наименьшая частица вещества, которая сохраняет его химические свойства, называется молекулой.
Слова «химические свойства» означают следующее. Поваренная соль — это вещество, представляющее собой соединение натрия и хлора (NaCl). Это соединение имеет определённые химические свойства, в частности, оно может вступать в реакцию с каким-либо другим веществом. При этом и кристалл соли, и молекула этого химического соединения будут вести себя в реакции одинаково. В этом смысле и говорят, что молекула сохраняет химические свойства данного вещества.
Опыты, которые были описаны, говорят о том, что молекулы имеют маленькие размеры. Увидеть их невооруженным глазом невозможно. Диаметр крупных молекул примерно 10–8 см. Поскольку молекулы так малы, то в телах их содержится очень много. Так, в 1 см3 воздуха содержится 27*1018 молекул.
Масса молекул, так же как и её размеры, очень мала. Например, масса одной молекулы водорода равна 3,3 * 10–24 г или 3,3 * 10–27 кг. Масса молекул одного и того же вещества одинакова. В настоящее время масса и размеры молекул различных веществ определены достаточно точно.
Молекулы состоят из ещё более мелких частиц, которые называются атомами. Например, молекулу воды можно разделить на водород и кислород. Однако водород и кислород уже другие вещества, и они обладают свойствами, отличными от свойств воды. Разложить молекулу воды на такие вещества можно в процессе химической реакции.
Молекула воды состоит из двух атомов водорода и одного атома кислорода; молекула поваренной соли — из одного атома натрия и одного атома хлора. Молекула сахара более сложная: она состоит из б атомов углерода, 12 атомов водорода и 6 атомов кислорода, а молекула белков состоит из тысячи атомов.
Существуют вещества, молекулы которых содержат однородные атомы. Например, молекула водорода состоит из двух атомов водорода, молекула кислорода — из двух атомов кислорода.
В природе есть вещества, которые состоят не из молекул, а из атомов. Их называют простыми. Примерами таких веществ могут служить алюминий, железо, ртуть, олово и др.
Любое вещество, независимо от того, как оно получено, содержит одни и те же атомы. Например, молекула воды, полученная при таянии льда, или из сока ягод, или налитая из-под крана, содержит два атома водорода и один атом кислорода. Молекула кислорода, извлечённая из атмосферного воздуха или полученная в ходе какой-либо химической реакции, содержит два атома кислорода.
- Положение 2 МКТ. Молекулы находятся в непрерывном беспорядочном (хаотическом) движении. Поскольку молекулы малы, то непосредственно наблюдать и доказать их движение невозможно. Однако целый ряд экспериментальных фактов и наблюдаемых явлений является следствием движения молекул. К ним относятся прежде всего броуновское движение и диффузия.
- Положение 3 МКТ. Молекулы взаимодействуют между собой, между ними действуют силы и притяжения и отталкивания.
Наблюдения показывают, что тела не распадаются на отдельные молекулы. Твёрдые тела, например деревянную палку, металлический стержень, трудно растянуть или сломать. Их также трудно и сжать. Нелегко сжать и жидкость в сосуде. Газы сжать легче, но всё равно нужно приложить для этого некоторое усилие.
Если тела не распадаются на молекулы, то очевидно, что молекулы притягиваются друг к другу. Взаимное притяжение удерживает молекулы друг около друга.
Если взять два свинцовых цилиндра и прижать их друг к другу, а затем отпустить, то они разъединятся. Если поверхности цилиндров зачистить и вновь прижать их друг к другу, то цилиндры «слипнутся». Они не разъединятся даже в том случае, если к нижнему цилиндру подвесить груз массой несколько килограммов. Этот результат можно объяснить так: цилиндры удерживаются вместе, поскольку между молекулами действуют силы притяжения.
До того, как цилиндры зачистили, они разъединялись, поскольку поверхности цилиндров имели неровности, которые были устранены при зачистке. Поверхности стали гладкими, и это привело к уменьшению расстояний между молекулами, находящимися на поверхностях цилиндров, когда их прижали друг к другу. Следовательно, силы притяжения между молекулами действуют на малых расстояниях. Эти расстояния равны примерно размерам молекулы. Именно поэтому нельзя разбив чашку и соединив осколки, получить целую чашку. Нельзя, разломив палку на две части и соединив их, получить целую палку.
Наряду с силами притяжения, между молекулами действуют силы отталкивания, которые препятствуют сближению молекул. Это объясняет то, что тела трудно сжать, сжатая пружина принимает первоначальную форму после прекращения действия на неё внешней силы. Это происходит потому, что при сжатии молекулы сближаются и силы отталкивания, действующие между ними, возрастают. Они и приводят пружину в первоначальное состояние.
При растяжении тела сила отталкивания уменьшается в большей степени, чем сила притяжения. При сжатии тела сила отталкивания увеличивается в большей степени, чем сила притяжения.
Три агрегатных состояния
Вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Свойства тел в разных агрегатных состояниях различны.
Так, твёрдое тело имеет определённую форму и определённый объём. Его трудно сжать или растянуть; если его сжать, а потом отпустить, то оно, как правило, восстанавливает свою форму и объём. Исключение составляют некоторые вещества, твёрдое состояние которых близко по своим свойствам к жидкостям (пластилин, воск, вар).
Жидкость принимает форму сосуда, в который она налита. Это говорит о том, что жидкость в условиях Земли не имеет своей формы. Только очень маленькие капли жидкости имеют свою форму — форму шара.
Объём жидкости изменить чрезвычайно трудно. Так, если набрать воду в насос, закрыть отверстие внизу и попытаться сжать воду, вряд ли это удастся. Это означает, что жидкость имеет собственный объём.
В отличие от жидкости объём газа изменить довольно легко. Это можно сделать, сжав руками мяч или воздушный шарик. Газ не имеет собственного объёма, он занимает полностью объём сосуда, в котором находится. То же можно сказать и о форме газа.
Таким образом, твёрдые тела имеют собственные форму и объём, жидкости имеют собственный объём, но не имеют собственной формы, газы не имеют ни собственного объёма, ни собственной формы. Твёрдые тела и жидкости трудно сжать, газы легко сжимаемы.
Объяснить эти свойства тел можно, используя знания о строении вещества.
Поскольку газы занимают весь предоставленный им объём, то очевидно, что силы притяжения между молекулами газа малы. А это значит, что молекулы находятся на сравнительно больших расстояниях друг от друга. В среднем они в десятки раз больше расстояний между молекулами жидкости. Это подтверждается тем, что газы легко сжимаемы.
Малые силы притяжения влияют и на характер движения молекул газа. Молекула газа движется прямолинейно до столкновения с другой молекулой, в результате чего меняет направление своего движения и движется прямолинейно до следующего столкновения.
Твёрдые тела трудно сжать. Это связано с тем, что молекулы находятся близко друг от друга и при небольшом изменении расстояния между ними резко возрастают силы отталкивания. Сравнительно большое притяжение между молекулами твёрдых тел приводит к тому, что они сохраняют форму и объём.
Атомы или молекулы большинства твёрдых тел расположены в определённом порядке и образуют кристаллическую решётку. На рисунке 63 изображена кристаллическая решётка поваренной соли. В узлах кристаллической решётки находятся атомы натрия (Na) и хлора (Сl). Частицы твёрдого тела (атомы или молекулы) совершают колебательное движение относительно узла кристаллической решётки.
В жидкостях молекулы расположены также довольно близко друг к другу. Поэтому их трудно сжать, и они имеют свой объём. Однако силы притяжения между молекулами жидкости не настолько велики, чтобы жидкость сохраняла свою форму.
Модели строения газа, жидкости и твёрдого тела

Конспект урока «Агрегатные состояния вещества».
Следующая тема: «».
Агрегатное состояние вещества
Температура, давление и удельный объем называются термическими параметрами твердого, жидкого или газообразного состояния вещества. Каждое из этих трех состояний называют агрегатным состоянием. В газообразном состоянии атомы и молекулы, совершающие беспорядочное движение, занимают весь доступный объем. В жидком теле они еще имеют некоторую свободу движения, но теперь вещество занимает не весь доступный объем, а лишь тот, который определяется его массой и плотностью. В твердых кристаллических веществах каждый атом имеет фиксированное положение, и все атомы расположены в регулярном порядке, называемом кристаллической решеткой.
Агрегатное состояние определяется не только свойствами данного вещества, но зависит и от внешних воздействий. Изменяя температуру или давление, можно добиться перехода вещества из одного агрегатного состояния в другое (например, из твердого в жидкое), который происходит внезапно при определенной температуре. Так, точка плавления льда в условиях нормального давления равна 0° С. Когда эта температура достигнута, то сразу твердая равномерно построенная кристаллическая решетка нарушается и твердое вещество переходит в жидкое агрегатное состояние. Так же внезапно протекает и противоположный процесс – замерзание воды. В этом случае мы говорим о точке замерзания или кристаллизации, наступающей при 0° С. При этой температуре энергия молекул настолько понижается, что они оказываются в пределах области действия более значительных сил взаимного притяжения и группируются в кристаллическую решетку. И в этом случае изменение жидкого агрегатного состояния вещества на твердое происходит без постепенного перехода.
На рис. 1 показан теоретический график изменения агрегатного состояния воды, полученный при равномерном медленном ее нагревании или охлаждении в условиях нормального давления.
Рис. 1 График изменения агрегатного состояния воды
Температура льда изменяется в зависимости от количества подведенного или отнятого тепла q1, а также от теплоты воды q3 и пара q5. Теплота q2, равная 335 кДж/кг, называется скрытой теплотой плавления или затвердевания, потому что при таянии или замерзании, подводя или отнимая теплоту q2, мы не видим изменения температуры.
При таянии льда теплота расходуется на внутреннюю работу по преодолению сил, удерживающих его молекулы, т. е. на разрушение его кристаллической решетки. На этом физическом явлении основан принцип ледяного охлаждения.
Температура воды при кипении также остается постоянной, пока вся вода не перейдет в пар, хотя теплота q4, равная 2257 кДж/кг, все время подводится. Процесс, протекающий при постоянной температуре, называется изотермическим.
Обычно парообразование происходит не только с поверхности жидкости, но и внутри с подъемом пузырьков пара в пространство над жидкостью. Жидкость кипит при температуре, когда давление ее паров становится равным давлению в окружающем пространстве. Следовательно, температура кипения повышается с увеличением давления, так как молекулы должны преодолеть его для того, чтобы вылететь из жидкости. Уменьшение давления понижает точку кипения жидкости.
В процессе кипения теплота расходуется на внутреннюю работу по преодолению сил, удерживающих молекулы жидкости. Эту теплоту называют скрытой теплотой парообразования. Величина ее зависит от рода жидкости и давления, при котором происходит процесс кипения. Отличие испарения от кипения состоит в том, что испарение происходит при любых температурах и только с поверхности жидкости. Чем теплее и суше воздух, тем быстрее происходит испарение.
Если у полученного пара будем отнимать тепло, то получим жидкость. Это явление называется конденсацией. Для конденсации 1 кг пара нужно отнять столько же тепла, сколько было подведено в процессе кипения 1 кг жидкости при том же давлении.
Конденсация пара возможна лишь при его охлаждении до температуры кипения рассматриваемой жидкости или ниже этой температуры. Если же температура кипения этой жидкости очень низкая, а нам желательно сконденсировать пар при более высокой температуре, то его необходимо сжать до такого давления, которому соответствовала бы температура кипения, равная желательной нам температуре конденсации.
До сих пор мы рассматривали процесс изменения вещества, при котором переход его из твердого состояния в газообразное и наоборот осуществляется через жидкое агрегатное состояние вещества. Это не всегда обязательно. В некоторых случаях твердые вещества, минуя жидкое состояние, переходят в газообразное (рис. 2), что называется возгонкой или сублимацией.
Рис. 2. Схема изменения агрегатного состояния вещества
«Агрегатные состояния вещества» – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Цель урока: изучить физические особенности в строении и свойствах различных веществ.
Обучающая: формирование представлений о свойствах твердых тел, жидкостей,газов. Развивающая: развитие умений учащихся наблюдать, сравнивать, применять ранее усвоенные знания в новой ситуации, анализировать, делать выводы
Воспитательная: воспитание трудолюбия, интереса к предмету. Коррекционные: развитие зрительного восприятия и узнавания; коррекция индивидуальных пробелов в знаниях, умениях, навыках. Тип урока: Урок усвоения нового материала
Оборудование: интерактивная доска, презентация, пробирка, лёд, картинки льда, воды, пара, рабочие тетради по физике
Ход урока
I. Орг. момент.
Проверка готовности к уроку, отчет дежурного ученика.
II. Актуализация знаний.
– Из чего состоит вещество?
— Что такое молекула?
– Дайте понятие «внутренняя энергия тела».
– От чего зависит внутренняя энергия тела?
— Как зависит скорость движения молекул от температуры?
III. Новый материал.
-Посмотрите на картинку какие вещества вы видите? ( Лёд, вода, пар) (слайд2)
-Какие это состояния вещества? (Твердое, жидкое, газообразное).
-Кто может сказать тему нашего урока?(Твердое , жидкое, газообразное состояние вещества).
Данные состояния называются агрегатными состояниями вещества. Любое вещество может находиться в трех агрегатных состояниях. Но свойства веществ в разных состояниях различны. Сегодня мы должны выяснить, какими свойствами обладают тела.
Тема нашего урока «Агрегатные состояния вещества» (Слайд 3)
Какова цель нашего урока? ( Изучить свойства агрегатных состояний и их строение).
Где мы сможем использовать знания по этой теме? (Многие производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях, для получения сплавов, работа паровых турбин, различные природные явления, круговорот воды, и т.д)
Опыт: Беру кусочек льда, кладу в пробирку, нагреваю. (Лед превращается в воду, вода превращается в пар).
— Назовите в каких агрегатных состояниях находилась вода? (Слайд 4)
-Что же отличает одно агрегатное состояние вещества от другого? (Ответы учащихся)
– Каковы особенности молекулярного строения газов, жидкостей и твердых тел? (Ответы учащихся).
– Достаточно ли у вас знаний чтобы обьяснить отличия агрегатных состояний на основе особенностей молекулярного строения веществ?
— Давайте рассмотрим агрегатные состояния вещества на примере воды.
Рассматриваем поочередно особенности расположения молекул в различных агрегатных состояниях вещества (работа в группах с учебником на с. 30-31).
Ответить вопросы:
Сохраняется ли форма (твердого, жидкого, газообразного) тела при неизменной температуре?
Сохраняется ли объем (твердого, жидкого, газообразного) тела при неизменной температуре?
Как располагаются молекулы (твердого, жидкого, газообразного) тела.
Объяснить силы притяжения и отталкивания.
Возможен ли переход (твердого, жидкого, газообразного) тела в другое агрегатное состояние?
Учащиеся каждой группы заполняют таблицу отвечая на вопросы своей группы, представляют свои результаты и выводы с помощью интерактивной доски, остальные учащиеся записывают в тетрадь. (Слайд 5)
|
|
Газообразные тела |
Жидкие тела |
Твердые тела |
|
Форма |
Сохраняют |
Не сохраняют |
Не сохраняют |
|
Объем |
Сохраняют |
Сохраняют |
Не сохраняют |
|
Расположение молекул |
Упорядоченно, не могут свободно перемещаться, расположены вплотную друг к другу. |
Не могут далеко удаляться друг от друга |
Перемещаются свободно по всему объему |
|
Взаимодействия между молекулами |
Сильные |
Значительные |
Слабые |
После выступления каждой группы заполняем схему перехода агрегатных состояний вещества (1 ученик работает с интерактивной доской).
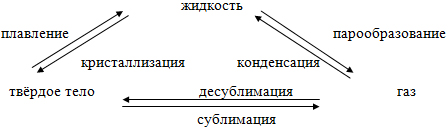
Таким образом, существует шесть процессов, которые определяют варианты перехода из одного агрегатного состояния в другое: плавление, кристаллизация, парообразование, конденсация, сублимация, десублимация.(Слайд 6)
IV. Закрепление.
Фронтальный опрос:
— В каких агрегатных состояниях может находиться одно и тоже вещество?
— Чем определяется то или иное агрегатное состояние вещества?
— Каковы особенности молекулярного строения газов, жидкостей и твердых тел?
— Может ли внутренняя энергия тела изменяться без изменения температуры? Приведите примеры, подтверждающие ваш ответ.
Работа в парах (каждой паре даётся загадка, отгадать и объяснить по каким особенностям определили агрегатное состояние вещества) (Слайд 7)
- Что за невидимка: в дом просится, а дверь откроешь, — прежде людей бежит? (воздух, газ, пар).
- С неба пришел, в землю ушел? (дождь)
- Что в гору не вкатишь? (вода)
- На всех садится, никого не боится? (снег)
V. Самостоятельная работа.
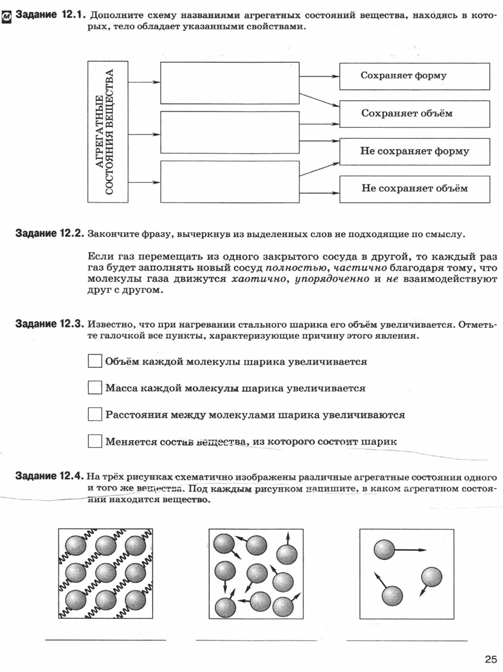
Работа в рабочей тетради (с. 25 задание 12.1-12.4) Т.А. Ханнанова. Рабочая тетрадь по физике (к учебнику А.В.Перышкина) М.:Дрофа,2014
VI. Подведение итогов
— Какую тему изучили сегодня на уроке?
-Чем запомнился урок?
— Что нового узнали на уроке?
— Какое практическое значение имеют явления перехода вещества из одного агрегатного состояния в другое?
VII. Рефлексия. (Слайд 8)
Перед вами лежат картинки с изображением льда, воды и пара.
Лёд- вам было все понятно на уроке и вы получили прочные знания.
Вода – если вы испытывали затруднения при изучении темы.
Пар – все было не понятно.
Выберите нужную картинку и положите на парту.
VIII. Домашнее задание (Слайд 9)
– Параграф 12 стр.30-31, прочитать, ответить на вопросы, выучить особенности молекулярного строения веществ.
– Рабочая тетрадь, стр.26 задание12.5 (заполнить таблицу).
– Индивидуально: придумать сказку о переходе агрегатных состояний или найти занимательные факты переходов одного агрегатного состояния в другой.
Агрегатные состояния вещества | Социальная сеть работников образования
li{counter-increment:lst-ctn-kix_list_1-4}#doc12813570 ol.lst-kix_list_1-1{list-style-type:none}#doc12813570 ol.lst-kix_list_1-2{list-style-type:none}#doc12813570 ol.lst-kix_list_1-6.start{counter-reset:lst-ctn-kix_list_1-6 0}#doc12813570 .lst-kix_list_1-1>li{counter-increment:lst-ctn-kix_list_1-1}#doc12813570 ol.lst-kix_list_1-3.start{counter-reset:lst-ctn-kix_list_1-3 0}#doc12813570 ol.lst-kix_list_1-2.start{counter-reset:lst-ctn-kix_list_1-2 0}#doc12813570 ol.lst-kix_list_1-8.start{counter-reset:lst-ctn-kix_list_1-8 0}#doc12813570 .lst-kix_list_1-0>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «. «}#doc12813570 ol.lst-kix_list_1-5.start{counter-reset:lst-ctn-kix_list_1-5 0}#doc12813570 ol.lst-kix_list_1-7{list-style-type:none}#doc12813570 .lst-kix_list_1-1>li:before{content:»» counter(lst-ctn-kix_list_1-1,lower-latin) «. «}#doc12813570 .lst-kix_list_1-2>li:before{content:»» counter(lst-ctn-kix_list_1-2,lower-roman) «. «}#doc12813570 .lst-kix_list_1-7>li{counter-increment:lst-ctn-kix_list_1-7}#doc12813570 ol.lst-kix_list_1-8{list-style-type:none}#doc12813570 .lst-kix_list_1-3>li:before{content:»» counter(lst-ctn-kix_list_1-3,decimal) «. «}#doc12813570 .lst-kix_list_1-4>li:before{content:»» counter(lst-ctn-kix_list_1-4,lower-latin) «. «}#doc12813570 ol.lst-kix_list_1-0.start{counter-reset:lst-ctn-kix_list_1-0 0}#doc12813570 .lst-kix_list_1-0>li{counter-increment:lst-ctn-kix_list_1-0}#doc12813570 .lst-kix_list_1-6>li{counter-increment:lst-ctn-kix_list_1-6}#doc12813570 .lst-kix_list_1-7>li:before{content:»» counter(lst-ctn-kix_list_1-7,lower-latin) «. «}#doc12813570 .lst-kix_list_1-3>li{counter-increment:lst-ctn-kix_list_1-3}#doc12813570 .lst-kix_list_1-5>li:before{content:»» counter(lst-ctn-kix_list_1-5,lower-roman) «. «}#doc12813570 .lst-kix_list_1-6>li:before{content:»» counter(lst-ctn-kix_list_1-6,decimal) «. «}#doc12813570 ol.lst-kix_list_1-7.start{counter-reset:lst-ctn-kix_list_1-7 0}#doc12813570 .lst-kix_list_1-2>li{counter-increment:lst-ctn-kix_list_1-2}#doc12813570 .lst-kix_list_1-5>li{counter-increment:lst-ctn-kix_list_1-5}#doc12813570 .lst-kix_list_1-8>li{counter-increment:lst-ctn-kix_list_1-8}#doc12813570 ol.lst-kix_list_1-4.start{counter-reset:lst-ctn-kix_list_1-4 0}#doc12813570 .lst-kix_list_1-8>li:before{content:»» counter(lst-ctn-kix_list_1-8,lower-roman) «. «}#doc12813570 ol.lst-kix_list_1-1.start{counter-reset:lst-ctn-kix_list_1-1 0}#doc12813570 ol{margin:0;padding:0}#doc12813570 table td,table th{padding:0}#doc12813570 .c17{margin-left:36pt;padding-top:0pt;padding-left:0pt;padding-bottom:0pt;line-height:1.0;orphans:2;widows:2;text-align:justify}#doc12813570 .c16{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:12pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c1{padding-top:5pt;text-indent:28.4pt;padding-bottom:5pt;line-height:1.5;orphans:2;widows:2;text-align:justify}#doc12813570 .c10{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:11pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c9{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:13pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c4{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:12pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c23{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:16pt;font-family:»Georgia»;font-style:normal}#doc12813570 .c20{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:18pt;font-family:»Times New Roman»;font-style:italic}#doc12813570 .c3{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:16pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c5{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:11pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c18{padding-top:5pt;text-indent:21.3pt;padding-bottom:5pt;line-height:1.5;orphans:2;widows:2;text-align:left}#doc12813570 .c8{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:14pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c0{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:16pt;font-family:»Georgia»;font-style:italic}#doc12813570 .c26{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:72pt;font-family:»Georgia»;font-style:italic}#doc12813570 .c21{color:#000000;font-weight:400;text-decoration:none;vertical-align:baseline;font-size:36pt;font-family:»Georgia»;font-style:italic}#doc12813570 .c2{padding-top:5pt;padding-bottom:5pt;line-height:1.0;orphans:2;widows:2;text-align:center;height:12pt}#doc12813570 .c15{color:#000000;font-weight:700;text-decoration:none;vertical-align:baseline;font-size:14pt;font-family:»Times New Roman»;font-style:normal}#doc12813570 .c19{padding-top:5pt;text-indent:14.2pt;padding-bottom:5pt;line-height:1.5;orphans:2;widows:2;text-align:justify}#doc12813570 .c13{padding-top:0pt;text-indent:14.2pt;padding-bottom:0pt;line-height:1.0;orphans:2;widows:2;text-align:justify}#doc12813570 .c25{padding-top:5pt;padding-bottom:5pt;line-height:1.0;orphans:2;widows:2;text-align:right}#doc12813570 .c6{padding-top:5pt;padding-bottom:5pt;line-height:1.0;orphans:2;widows:2;text-align:left}#doc12813570 .c12{padding-top:5pt;padding-bottom:5pt;line-height:1.0;orphans:2;widows:2;text-align:center}#doc12813570 .c14{padding-top:0pt;padding-bottom:0pt;line-height:1.1500000000000001;orphans:2;widows:2;text-align:left}#doc12813570 .c28{padding-top:0pt;padding-bottom:10pt;line-height:1.1500000000000001;orphans:2;widows:2;text-align:left}#doc12813570 .c24{padding-top:5pt;padding-bottom:5pt;line-height:1.5;orphans:2;widows:2;text-align:justify}#doc12813570 .c7{background-color:#ffffff;max-width:481.9pt;padding:56.7pt 56.7pt 56.7pt 56.7pt}#doc12813570 .c27{padding:0;margin:0}#doc12813570 .c11{margin-left:184.3pt}#doc12813570 .c22{height:12pt}#doc12813570 .title{padding-top:24pt;color:#000000;font-weight:700;font-size:36pt;padding-bottom:6pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 .subtitle{padding-top:18pt;color:#666666;font-size:24pt;padding-bottom:4pt;font-family:»Georgia»;line-height:1.1500000000000001;page-break-after:avoid;font-style:italic;orphans:2;widows:2;text-align:left}#doc12813570 li{color:#000000;font-size:12pt;font-family:»Times New Roman»}#doc12813570 p{margin:0;color:#000000;font-size:12pt;font-family:»Times New Roman»}#doc12813570 h2{padding-top:24pt;color:#000000;font-weight:700;font-size:24pt;padding-bottom:6pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 h3{padding-top:18pt;color:#000000;font-weight:700;font-size:18pt;padding-bottom:4pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 h4{padding-top:14pt;color:#000000;font-weight:700;font-size:14pt;padding-bottom:4pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 h5{padding-top:12pt;color:#000000;font-weight:700;font-size:12pt;padding-bottom:2pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 h5{padding-top:11pt;color:#000000;font-weight:700;font-size:11pt;padding-bottom:2pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 h6{padding-top:10pt;color:#000000;font-weight:700;font-size:10pt;padding-bottom:2pt;font-family:»Times New Roman»;line-height:1.1500000000000001;page-break-after:avoid;orphans:2;widows:2;text-align:left}#doc12813570 ]]>МБОУ Михейковская СШ
Проект
на тему:
Выполнили ученицы 7 класса:
Белякова Валерия,
Лузина Марина,
Евдокимова Екатерина
Руководитель проекта
учитель физики
Лавнюженков С.П.
Агрегатные состояния вещества
План
1.Введение
2.Агрегатное состояние вещества
3.Агрегатное состояние вещества – газ
4.Агрегатное состояние вещества – жидкость
5.Агрегатное состояние вещества – твердое тело
6.Четвертое состояние вещества – плазма
7. Опыт: изменение агрегатного состояния воды
8.Заключение
Введение
Как известно, многие вещества в природе могут находиться в трех состояниях: твердом, жидком и газообразном. А также некоторые могут находиться еще и в четвертом — плазматическом состоянии Мы выбрали данную тему потому что многие вещества используются в жизни и в разных агрегатных состояниях. Целью данной работы является – рассмотреть существующие агрегатные состояния вещества, выявить все их достоинства и недостатки.
Агрегатные состояния вещества
Взаимное расположение, характер движения и взаимодействия молекул одного и того же вещества существенно зависящие от внешних условий (температура, давление), характеризуют его агрегатное состояние. Различают четыре агрегатных состояния вещества: твердое, жидкое, газообразное, плазменное. Фазовый переход – переход системы из одного агрегатного состояния в другое. При фазовом переходе скачкообразно изменяется какая-либо физическая величина (например, плотность, внутренняя энергия) или симметрия системы. Переход вещества из твердого состояния в жидкое называется плавлением, а температуру, при которой это происходит – температурой плавления. Переход вещества из жидкого состояния в твердое называется кристаллизацией, а температуру перехода – температурой кристаллизации. Переход вещества из жидкого состояния в газообразное называется парообразованием. Переход вещества из газообразного состояния в жидкое называется конденсацией. Реализация того или иного агрегатного состояния вещества зависит от соотношения кинетической и потенциальной энергии молекул, входящих в его состав. Потенциальная энергия молекулы характеризует степень ее связи с другими частицами. Между любыми двумя молекулами вещества на расстоянии, большем диаметра молекул, действуют силы притяжения электромагнитного происхождения. Эти силы стремятся связать молекулы в единое целое. Кинетическая энергия молекул препятствует этой тенденции сцепления их между собой.
Газ
Газ (газообразное состояние) – одно из четырех агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Так же термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости. В этом и заключается отличие газа от пара. При повышении давления насыщенный пар частично превращается в жидкость, газ нет. Вещество находится в газообразном состоянии, если средняя кинетическая энергия молекул превышает их среднюю потенциальную энергию. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Газы могут неограниченно расширяться в пространстве, так как силы притяжения между молекулами незначительны. Большая сжимаемость газов по сравнению со сжимаемостью жидкостей и твердых тел объясняется наличием большего межмолекулярного пространства
При сжатии газа уменьшается среднее расстояние между его молекулами. Однако силы взаимного отталкивания молекул на этом расстоянии невелики и практически не препятствуют сжатию.
ЖИДКОСТЬ
Жидкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. Вещество находится в жидком агрегатном состоянии, если средняя кинетическая энергия молекул соизмерима со средней потенциальной энергией их притяжения. Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём. При нагревании твердого тела средняя кинетическая энергия молекул, колеблющихся около положений равновесия, возрастает. Рост кинетической энергии молекул приводит к увеличению амплитуды ее колебаний. Уменьшение энергии связи при нагревании позволяет молекулам перескакивать из одного положения равновесия в другое. В результате нарушается правильное расположение частиц, характерное для кристаллической решетки твердого тела. Происходит фазовый переход вещества из твердого состояния в жидкое. Молекулы в жидкости упакованы так же плотно, как и в твердом теле, так как плотность жидкости и твердого тела примерно одинакова. При упаковке частиц в жидкости, так же как и в твердых телах, упорядоченное расположение частиц наблюдается лишь в пределах двух-трех слоев. Это означает, что при фазовом переходе твердое тело — жидкость происходит нарушение симметрии системы. Относительные положения молекул в жидкости не фиксированы. Под действием внешней силы жидкость течет, сохраняя свой объем, и принимая форму сосуда. Текучесть жидкости объясняется тем, что перескоки молекул из одного положения равновесия в другое происходят преимущественно в направлении действия внешней силы. Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше – в газообразное (происходит испарение). Границы этого интервала зависят от давления. Как правило, вещество в жидком состоянии имеет только одну модификацию. Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей. Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости. Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
ТВЕРДЫЕ ТЕЛА
Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Вещество находится в твердом состоянии, если средняя потенциальная энергия притяжения молекул много больше их средней кинетической энергии. Различают кристаллические и аморфные твёрдые тела. Аморфные тела – конденсированные вещества, атомная структура которых имеет ближний порядок, и не имеет дальнего порядка, характерного для кристаллических структур. Кристаллические тела – твердые тела, в которых атомы расположены закономерно, образую кристаллическую решетку. Молекулы в твердом теле располагаются упорядоченно. Упаковка молекул в пространстве аналогична заполнению плоскости правильными многоугольниками. Частицы твердого тела, образуя кристаллическую решетку, колеблются около некоторых средних положений равновесия, называемых узлами кристаллической решетки. Колебания молекул возможны по различным направлениям и могут иметь разную амплитуду. Значительная средняя потенциальная энергия взаимодействия препятствует изменению среднего расстояния между ними. Следствиями этого является сохранение твердыми телами формы и объема. В прошлом твёрдое тело применялось как конструкционный материал и в основе употребления лежали непосредственно ощутимые механические свойства как твёрдость, масса, пластичность, упругость, хрупкость. В современном мире применение твёрдого тела основывается на физических свойствах, которые зачастую обнаруживаются только при лабораторных исследованиях.
ПЛАЗМА
Разные вещества переходят в состояние плазмы при разной температуре, что объясняется строением внешних электронных Плазма — частично или полностью ионизированный газ, образованный из нейтральных атомов (или молекул) и заряженных частиц (ионов и электронов). Важнейшей особенностью плазмы является то что не смотря на наличие свободных зарядов, суммарный электрический заряд плазмы приблизительно равен нулю, это означает, что объемные плотности положительных и отрицательных заряженных частиц, из которых она образована, оказываются почти одинаковыми. Плазма иногда называется четвёртым (после твёрдого, жидкого и газообразного) агрегатным состоянием вещества. Присутствие свободных электрических зарядов делает плазму проводящей средой, что обуславливает ее заметно большее взаимодействие с магнитным и электрическим полями. Классификация Плазма обычно разделяется на идеальную и неидеальную, низкотемпературную и высокотемпературную, равновесную и неравновесную, при этом довольно часто холодная плазма бывает неравновесной, а горячая равновесной. Плазму делят на низкотемпературную (температура меньше миллиона Kельвин) и высокотемпературную (температура миллион Kельвин и выше). Такое деление обусловлено важностью оболочек атомов вещества: чем легче атом отдает электрон, тем ниже температура перехода в плазменное состояние. В неравновесной плазме электронная температура существенно превышает температуру ионов. Это происходит из-за различия в массах иона и электрона, которое затрудняет процесс обмена энергией. Такая ситуация встречается в газовых разрядах, когда ионы имеют температуру около сотен, а электроны около десятков тысяч Kельвин. В равновесной плазме обе температуры равны. Поскольку для осуществления процесса ионизации необходимы температуры, сравнимые с потенциалом ионизации, равновесная плазма обычно является горячей (с температурой больше нескольких тысяч Kельвин). Степень ионизации для того, чтобы газ перешел в состояние плазмы, его необходимо ионизировать. Степень ионизации пропорциональна числу атомов, отдавших или поглотивших электроны, и больше всего зависит от температуры. Даже слабо ионизированный газ, в котором менее 1 % частиц находятся в ионизированном состоянии, может проявлять некоторые типичные свойства плазмы (взаимодействие с внешним электромагнитным полем и высокая электропроводность). Ионизация- процесс образования ионов из атомов. Для низкотемпературной плазмы характерна малая степень ионизации (до 1%). Так как такие плазмы довольно часто употребляются в технологических процессах, их иногда называют технологичными плазмами Горячая плазма почти всегда полностью ионизирована (степень ионизации ~100%). Обычно именно она понимается под «четвертым агрегатным состоянием вещества». Примером может служить Солнце. Помимо температуры, которая имеет фундаментальную важность для самого существования плазмы, вторым наиболее важным свойством плазмы является плотность. Словосочетание плотность плазмы обычно обозначает плотность электронов, то есть число свободных электронов в единице объёма.
Формы плазмы:
- Искусственно созданная плазма – плазменные ракетные двигатели, плазменные лампы, светящая сфера ядерного взрыва и др.
- Земная природная плазма – молния, северное сияние и др.
- Космическая плазма – Солнце и другие звезды, космическое пространство и др.
Заключение
Газ – агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём.
Жидкость – агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Жидкость, сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, жидкость сохраняет свой объём, имеет свободную поверхность.
Твёрдое тело – одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует.
Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы.
Агрегатные состояния вещества. 7-й класс
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
Образовательная – сформировать представления о некоторых механических свойствах твердых тел, жидкостей, газов.
Развивающая – развивать речевые и мыслительные навыки учащихся, умения анализировать, умения делать выводы по изученному материалу.
Воспитательная – способствовать воспитанию ответственности, стремление к успеху, создать условия повышения интереса к изучаемому предмету.
Оборудование: компьютер, мультимедиа проектор.
Ход урока
I. Оргмомент.
II. Актуализация знаний.
Все любят отгадывать кроссворды. Мы с вами тоже отгадаем кроссворд, но физический (слайд 1).
По горизонтали:
1. Мельчайшая “неделимая” частица. (Атом)
2. Древнегреческий учёный, который ввёл понятие атома. (Демокрит)
3. Процесс консервирования овощей и рыбы, при котором используется явление диффузии. (Засолка)
4. Диффузия доказывает … молекул. (Движение)
5. Один из видов взаимодействия молекул. (Отталкивание)
6. Явление самопроизвольного перемешивания вещества. (Диффузия)
7. Тонкие трубки, по которым поднимается или опускается жидкость из-за взаимодействия молекул. (Капилляр)
8. Явление, доказывающее взаимодействие молекул. (Смачивание)
III. Мотивация.
Нас окружают различные тела. Тела состоят из различных веществ.
Какое вещество вы видите на слайде 2? (Ответ: Вода)
Когда вода замерзает образуется… (лед). (слайд 3)
Лед, какое это состояние воды? (Твердое)
Здесь одновременно существует два различных состояния воды – жидкое и твердое. В атмосфере вода содержится в невидимом глазу состоянии – пар. Когда пара становится много, в атмосфере образуются облака. (Cлайд 4)
В каких состояниях может находиться вода? (Твердое, жидкое, газообразное)
Эти состояния вещества называются агрегатными. Это и будет темой сегодняшнего урока “Агрегатные состояния вещества”. (Cлайд 5, 6) (Дальнейшую демонстрацию можно сопровождать музыкой, которая записана в презентации).
IV. Усвоение новых знаний. (Дальнейший переход к слайдам осуществляется по ссылке на слайде 6)
В различных состояниях вещества обладают разными свойствами. Большинство окружающих нас тел состоят из твёрдых веществ. Это дома, машины, инструменты и т.д.
— Назовите ещё примеры твёрдых тел.
Форму твёрдого тела можно изменить, но для этого необходимо приложить усилие. Например, чтобы согнуть гвоздь, нужно приложить довольно большое усилие.
Для придания твёрдым телам нужной формы и объёма на заводах и фабриках их обрабатывают специальными станками.
— Какое общее свойство объединяет их?
(Твёрдое тело имеет собственную форму и объём). (Cлайд 7)
Второе состояние вещества — жидкое. (Cлайд 8). В отличие от твёрдых тел жидкости легко меняют свою форму. Они принимают форму сосуда в котором находятся.
Например, молоко, наполняющее бутылку, имеет форму бутылки. Налитое же в стакан оно принимает форму стакана. Но, изменяя форму, жидкость сохраняет свой объём.
В обычных условиях только маленькие капельки жидкости имеют свою форму — форму шара. Это, например, капли дождя, или капли, на которые разбивается струя жидкости.
На свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла.
— Давайте сделаем вывод: Жидкости легко меняют свою форму, но сохраняют объём. (Cлайд 9)
— Воздух, которым мы дышим, является газообразным веществом, или газом. Поскольку большинство газов бесцветны и прозрачны, то они невидимы.
Присутствие воздуха можно почувствовать, стоя у открытого окна движущегося поезда. Его наличие в окружающем пространстве можно ощутить, если в комнате возникает сквозняк, а также доказать с помощью простых опытов. (Cлайд 10).
Можно ли заполнить газом сосуд наполовину его объема? Почему?
Вывод: Вещество в газообразном состоянии не имеет собственной формы и объёма.
V. Работа с учебником. Учащиеся читают абзац, выделяют нужную информацию и отвечают на вопросы (слайд 12). Далее совместно с учителем подводят итог. (Cлайд 11, 13)
Газы. Расстояние между молекулами во много раз больше самих молекул, они почти не притягиваются и свободно движутся. Поэтому газы заполняют весь предоставленный объём, не имеют формы и легко сжимаются. Но если газы сильно сжать или охладить они переходят в жидкое состояние.
Жидкости. Молекулы расположены близко друг к другу, расстояние между ними сравнимо с размером молекул. Они скачками меняют свое место – “прыгают”. Поэтому жидкости не сохраняют форму, они могут течь, их легко перелить. Но сжать их трудно, так как при этом молекулы сближаются и между ними возникает отталкивание.
Твердые тела. Молекулы расположены в строгом порядке расстояние между молекулами сравнимо с размером молекул. Молекулы колеблются около определенной точки, не могут перемещаться далеко от неё. Поэтому твердые тела сохраняют форму и объем. Кристаллические тела.
VI. Самостоятельная работа.
Учащиеся выполняют краткий тест по вариантам. Проверка теста. (Слайд 14)
Тест
Вариант 1
1. Какие из указанных свойств принадлежат газам?
А. Имеют собственную форму.
Б. Сохраняют объём.
В. Не имеют собственной формы и постоянного объёма.
2. Как расположены молекулы газа?
А. Двигаясь беспорядочно во всех направлениях, почти не притягиваются друг к другу.
Б. Не расходятся на большие расстояния.
В. Расположены в определенном порядке.
3. В каком состоянии может находиться ртуть?
А. Только в жидком.
Б. В жидком, твердом, газообразном.
В. Только в твердом.
4. Можно ли открытый сосуд заполнить газом на 40% его вместимости?
А. Да, можно.
Б. Нет, нельзя.
В. Определенного ответа нет.
5. Вода замерзла и превратилась в лед. Изменились ли при этом сами молекулы воды?
А. Нет, не изменились.
Б. Да, изменились.
В. Определенного ответа нет.
Вариант 2
1. Какие из указанных свойств принадлежат жидкостям?
А. Имеют собственную форму и объем.
Б. Легко меняют форму, но сохраняют объем.
В. Не имеют собственной формы и постоянного объёма.
2. Как расположены молекулы в твердых телах?
А. Двигаясь беспорядочно во всех направлениях, почти не притягиваются друг к другу.
Б. Не расходятся на большие расстояния.
В. Расположены в определенном (строгом) порядке.
3. В каком состоянии может находиться чугун?
А. Только в жидком.
Б. В жидком, твердом, газообразном.
В. Только в твердом.
4. В бутылке находится вода объемом 0,2 л. Её переливают в колбу вместимостью 0,5 литра. Изменится ли объем воды?
А. Не изменится.
Б. Увеличится.
В. Уменьшится.
5. В помещениях, где пользуются медицинским эфиром, обычно сильно им пахнет. В каком состоянии находится эфир в помещении?
А. Только в жидком.
Б. В жидком, твердом, газообразном.
В. Только в газообразном.
VII. Домашнее задание. Обобщение знаний: заполнить таблицу. (Слайд 15)
VIII. Итог урока.
Учитель отмечает наиболее активных учеников, выставляет оценки.
Агрегатные и фазовые состояния веществ. — Студопедия
Различают агрегатные и фазовые состояния веществ. Вещество может находиться в трех агрегатных состояниях: газообразном, жидком и твердом. Эти состояния отличаются друг от друга характером движения молекул или атомов и плотностью их упаковки.
Для газообразного состояния вещества характерно поступательное, вращательное и колебательное движение молекул. При температурах, значительно превышающих критическую, расстояния между молекулами в газе достаточно велики, т.е. плотность упаковки молекул мала.
Для твердого состояния характерны небольшие расстояния между молекулами (высокая плотность упаковки). Поступательное движение молекул практически отсутствует. Молекулы или группы атомов колеблются около неподвижных центров равновесия с частотой порядка 1013-1014 колебаний в секунду. Малой подвижностью молекул или атомов объясняется сопротивление твердого тела изменению формы – его твердость.
Жидкое агрегатное состояние занимает промежуточное положение между газообразным и твердым. Жидкости по характеру движения молекул приближаются к газам, а по плотности упаковки – к твердым телам. Обладая значительной подвижностью, молекулы жидкости легко перемещаются, их центры равновесия непрерывно изменяют положение. Поэтому жидкость легко меняет форму: течет под влиянием небольших напряжений.
Чтобы иметь ясное представление о фазовом состоянии вещества, необходимо рассмотреть понятие фаза. Существует структурное и термодинамическое понимание
термина “фаза”. В термодинамике фазой называется совокупность гомогенных частей гетерогенной системы, отделенных от других частей поверхностью раздела и отличающихся от них составом и термодинамическими свойствами, не зависящими от массы. Фаза должна обладать достаточной протяженностью (объемом), чтобы можно было говорить о давлении, температуре и других ее термодинамических свойствах. С точки зрения структуры фазы различаются порядком во взаимном расположении молекул. В зависимости от этого порядка различают три фазовых состояния: кристаллическое, жидкое и газообразное.
Кристаллическое фазовое состояние характеризуется наличием трехмерного дальнего порядка в расположении атомов или молекул. Дальним порядком называется порядок, соблюдающийся на расстояниях, превышающих размер молекул в сотни и тысячи раз, причем порядок может существовать в одном, двух или трех измерениях. Дальний порядок в одном измерении имеет идеальная молекулярная цепь полимера, в которой закономерно повторяется одно и тоже звено. Кристаллы представляют собой структуры дальним порядком в трех измерениях (идеальная кристаллическая решетка).
Жидкое фазовое состояние характеризуется отсутствием кристаллической решетки; его часто называют аморфным. В этом состоянии плотность упаковки молекул или атомов примерно такая же, как и в кристаллическом. Поскольку молекулы или атомы вплотную прилегают друг к другу, произвольное их расположение невозможно. В аморфном состоянии наблюдается ближний порядок, т.е. такой, который соблюдается на расстояниях, соизмеримых с размерами молекул. Вблизи данной молекулы ее соседи могут быть расположены в определенном порядке, а на небольшом расстоянии от нее этот порядок уже отсутствует.
Ближний порядок в жидкостях обнаруживается рентгенографически и проявляется во флуктуациях плотности (отклонения плотности от среднего значения), образовании упорядоченных “сиботактических групп”, или “роев” молекул, ассоциативов.
В жидком фазовом состоянии находятся вещества при температурах выше их температуры плавления и все твердые аморфные вещества (например, обыкновенное силикатное стекло, канифоль и др.). Поскольку силикатное стекло не имеет кристаллической решетки, принято все твердые аморфные тела называть стеклообразными или стеклами. Как стеклообразные, так и кристаллические тела находятся в твердом агрегатном состоянии и сильно не различаются по подвижности молекул.
Из всего изложенного следует, что газообразное агрегатное и фазовое состояния практически совпадают. Твердому агрегатному состоянию могут соответствовать два фазовых состояния: кристаллическое и аморфное (стеклообразное). Жидкому фазовому состоянию могут отвечать два агрегатных состояния: твердое (стеклообразное) и жидкое (выше температуры плавления).
5.3. Кристаллизация и стеклование полимеров. Физические состояния аморфных полимеров.
Поскольку твердые тела могут находиться в кристаллическом или аморфном (стеклообразном) состоянии, существуют два принципиально возможных пути перехода из равновесного жидкого состояния в твердое: кристаллизация и стеклование.
Кристаллизация – это процесс перехода из состояния ближнего порядка в состояние дальнего порядка, т.е. процесс образования новой фазы. Кристаллизация является фазовым переходом первого рода.
Стеклование – это процесс перехода легкоподвижной жидкости в твердое состояние без изменения фазы, т.е. с сохранением ближнего порядка; следовательно, стеклование не является фазовым переходом.
Полимеры при охлаждении могут кристаллизоваться и стекловаться. При этом следует различать два понятия: кристаллический полимер, находящийся при данных условиях в кристаллическом состоянии, и кристаллизующийся, т.е. способный к кристаллизации.
При охлаждении расплавленных некристаллизующихся полимеров при определенной температуре, характерной для данного полимера, он переходит в твердое стеклообразное состояние, которое является единственно возможным для него твердом состоянием. Это обычно происходит в некоторой области температур, охватывающей 10-20°, в которой постепенно теряются свойства, характерные для жидкого состояния и приобретают свойства твердого тела. Средняя температура этой области называется температурой стеклования (Тс и Тg).
Процесс кристаллизации полимеров часто происходит очень медленно, так как требуется время для перестройки макромолекул. Если кристаллизующийся полимер охлаждать очень быстро, то он не успевает закристаллизовываться и переохлаждаться. При определенных температурах – значительно ниже температуры кристаллизации – такой полимер также стеклуется, т.е. переходит в стеклообразное состояние. Следовательно, его Тс>Tg.
Стеклообразное состояние полимера характеризуется наличием колебательного движения атомов, входящих в состав цепи, около положения равновесия. Колебательное движение звеньев и перемещение цепи как единого целого практически отсутствуют. При нагревании выше Тс начинают проявляться крутильные колебания звеньев, цепь приобретает способность изгибаться. Это состояние аморфного полимера называется высокоэластическим.
При дальнейшем нагревании линейного полимера реализуется подвижность цепи как целого, полимер может течь, т.е. он переходит в вязко текучее состояние. Это происходит в некоторой области температур, средняя температура которой называется температурой текучести (ТТ).
Эти три состояния аморфных полимеров называются физическими состояниями. Низкомолекулярные аморфные вещества могут находиться в трех физических состояниях. Специфическим для них является высокоэластическое состояние. Эти три физических состояния возможны и у кристаллизующихся полимеров.
Твердому агрегатному состоянию полимера могут соответствовать два фазовых состояния: кристаллическое и аморфное (стеклообразное). Аморфному фазовому состоянию может соответствовать несколько физических состояний.
Общая характеристика агрегатных состояний вещества — ТолВИКИ
Агрегатные состояния вещества
ВодаАгрегатные состояния вещества(от латинского aggrego — присоединяю, связываю) — это состояния одного и того же вещества, переходам между которыми соответствуют скачкообразные изменения свободной энергии, энтропии, плотности и других физических параметров вещества.
Газ (французское gaz, происшедшее от греческого chaos — хаос) — это агрегатное состояние вещества, в котором силы взаимодействия его частиц, заполняющих весь предоставленный им объем, пренебрежимо малы. В газах межмолекулярные расстояния велики и молекулы движутся практически свободно.
- Газы можно рассматривать как значительно перегретые или малонасыщенные пары.
- Над поверхностью каждой жидкости вследствие испарения находится пар. При повышении давления пара до определенного предела, называемого давлением насыщенного пара, испарение жидкости прекращается, так как давление пара и жидкости становится одинаковым.
- Уменьшение объема насыщенного пара вызывает конденсацию части пара, а не повышение давления. Поэтому давление пара не может быть выше давления насыщенного пара. Состояние насыщения характеризуется массой насыщения, содержащейся в 1м массой насыщенного пара, которая зависит от температуры. Насыщенный пар может стать ненасыщенным, если увеличивать его объем или повышать температуру. Если температура пара много выше точки кипения, соответствующей данному давлению, пар называется перегретым.
Плазмой называется частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Солнце, звезды, облака межзвездного вещества состоят из газов — нейтральных или ионизованных (плазмы). В отличие от других агрегатных состояний плазма представляет собой газ заряженных частиц (ионов, электронов), которые электрически взаимодействуют друг с другом на больших расстояниях, но не обладают ни ближним, ни дальним порядками в расположении частиц.
Жидкость — это агрегатное состояние вещества, промежуточное между твердым и газообразным.
- Жидкостям присущи некоторые черты твердого вещества (сохраняет свой объем, образует поверхность, обладает определенной прочностью на разрыв) и газа (принимает форму сосуда, в котором находится).
- Тепловое движение молекул (атомов) жидкости представляет собой сочетание малых колебаний около положений равновесия и частых перескоков из одного положения равновесия в другое.
- Одновременно происходят медленные перемещения молекул и их колебания внутри малых объемов, частые перескоки молекул нарушают дальний порядок в расположении частиц и обусловливают текучесть жидкостей, а малые колебания около положений равновесия обусловливают существование в жидкостях ближнего порядка.
Жидкости и твердые вещества, в отличие от газов, можно рассматривать как высоко конденсированные среды. В них молекулы (атомы) расположены значительно ближе друг к другу и силы взаимодействия на несколько порядков больше, чем в газах. Поэтому жидкости и твердые вещества имеют существенно ограниченные возможности для расширения, заведомо не могут занять произвольный объем, а при постоянных давлении и температуре сохраняют свой объем, в каком бы объеме их не размещали. Переходы из более упорядоченного по структуре агрегатного состояния в менее упорядоченное могут происходить и непрерывно. В связи с этим вместо понятия агрегатного состояния целесообразно пользоваться более широким понятием — понятием фазы.
Фазой называется совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом состоянии. Это оправдано одновременным существованием термодинамически равновесных фаз в многофазной системе: жидкости со своим насыщенным паром; воды и льда при температуре плавления; двух несмешивающихся жидкостей (смесь воды с триэтиламином), отличающихся концентрациями; существованием аморфных твердых веществ, сохраняющих структуру жидкости (аморфное состояние).
Аморфное твердое состояние вещества является разновидностью переохлажденного состояния жидкости и отличается от обычных жидкостей существенно большей вязкостью и численными значениями кинетических характеристик.
Кристаллическое твердое состояние вещества — это агрегатное состояние, которое характеризуется большими силами взаимодействия между частицами вещества (атомами, молекулами, ионами). Частицы твердых тел совершают колебания около средних равновесных положений, называемых узлами кристаллической решетки; структура этих веществ характеризуется высокой степенью упорядоченности (дальним и ближним порядком) — упорядоченностью в расположении (координационный порядок), в ориентации (ориентационный порядок) структурных частиц, или упорядоченностью физических свойств (например, в ориентации магнитных моментов или электрических дипольных моментов). Область существования нормальной жидкой фазы для чистых жидкостей, жидкого и жидких кристаллов ограничена со стороны низких температур фазовыми переходами соответственно в твердое (кристаллизацией), сверхтекучее и жидко-анизотропное состояние.
Что такое агрегатное состояние? Агрегатное состояние вещества
Вопросы о том, что такое агрегатное состояние, какими свойствами и свойствами обладают твердые тела, жидкости и газы, рассматриваются в нескольких учебных курсах. Есть три классических состояния вещества с характерными особенностями строения. Их понимание — важный момент в понимании наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучаются в физике, химии, географии, геологии, физической химии и других научных дисциплинах.Вещества, находящиеся при определенных условиях в одном из трех основных типов состояния, могут изменяться при повышении или понижении температуры и давления. Рассмотрим возможные переходы из одного агрегированного состояния в другое, как они осуществляются в природе, технике и повседневной жизни.
Что такое агрегатное состояние?
Слово латинского происхождения «агрего» в переводе на русский язык означает «прикреплять». Научный термин относится к состоянию одного и того же тела, вещества. Существование твердых тел, газов и жидкостей при определенных значениях температуры и различных давлениях характерно для всех оболочек Земли.Помимо трех основных агрегатных состояний существует еще четвертое. При повышенной температуре и постоянном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, нужно вспомнить мельчайшие частицы, из которых состоят вещества и тела.
На диаграмме вверху показано: а — газ; б — жидкость; c — твердое тело. На этих рисунках кружками обозначены структурные элементы веществ. Это условное обозначение, ведь атомы, молекулы, ионы — это не твердые шары.Атомы состоят из положительно заряженного ядра, вокруг которого с большой скоростью движутся отрицательно заряженные электроны. Знание микроскопической структуры вещества помогает лучше понять различия, существующие между различными формами агрегатов.
Представления о микромире: от Древней Греции до 17 века
Первые сведения о частицах, из которых состоят физические тела, появились еще в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом.Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны двигаться и взаимодействовать друг с другом. Атомизм стал самым передовым для своего времени учением Древней Греции. Но его развитие застопорилось в средние века. С тех пор ученых преследовала инквизиция Римско-католической церкви. Поэтому до нового времени не существовало внятного представления о том, что такое агрегатное состояние вещества. Только после XVII века учёные Р.Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Атомы, молекулы, ионы — микроскопические частицы структуры материи
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных ранее учеными, удалось сложить гармоничную картину микромира.Теории, описывающие состояние и поведение мельчайших частиц материи, довольно сложны, они относятся к области квантовой физики. Чтобы понять характеристики разных агрегатных состояний вещества, достаточно знать названия и особенности основных структурных частиц, образующих разные вещества.
- Атомы — это химически неделимые частицы. Сохраняется в химических реакциях, но разрушается в ядерной. Металлы и многие другие вещества атомной структуры в обычных условиях имеют твердое агрегатное состояние.
- Молекулы — это частицы, которые разрушаются и образуются в ходе химических реакций. В молекулярном строении есть кислород, вода, углекислый газ, сера. Агрегатное состояние кислорода, азота, диоксида серы, углерода, кислорода при нормальных условиях газообразное.
- Ионы — это заряженные частицы, в которые они превращаются атомы и молекулы, когда электроны присоединяются или теряют — микроскопические отрицательно заряженные частицы. В ионной структуре много солей, например кулинарных, железного и медного купороса.
Есть вещества, частицы которых определены, расположены в пространстве. Упорядоченное взаимное расположение атомов, ионов, молекул называется кристаллической решеткой. Обычно для твердых тел характерны ионные и атомные кристаллические решетки, для жидкостей и газов — молекулярные решетки. Алмаз отличается высокой твердостью. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит также состоит из атомов этого химического элемента. Только они по-разному расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество становится жидкостью и аморфной массой.
Вещества в твердом агрегатном состоянии
Твердые вещества при нормальных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок камня или металла. Если нагреть сахар, вещество начинает плавиться, превращаясь в вязкую жидкость коричневого цвета. Прекращаем нагревание — снова получаем твердое вещество. Следовательно, одним из главных условий перехода твердого тела в жидкость является его нагрев или увеличение внутренней энергии частиц вещества.Также можно изменить твердое состояние соли, используемой в пищу. Но чтобы растопить соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль — из заряженных ионов, которые больше притягиваются друг к другу. Твердые тела в жидкой форме не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при плавлении объясняется нарушением связи между ионами в кристаллах.Высвобождаются заряженные частицы, которые могут нести электрические заряды. Расплавы солей проводят электричество, они проводники. В химической, металлургической и машиностроительной отраслях твердые вещества преобразуются в жидкие для образования новых соединений или для придания им другой формы. Широко использовались сплавы металлов. Их можно получить несколькими способами, связанными с изменением агрегатного состояния твердого сырья.
Жидкость — одно из основных агрегатных состояний
Если в круглодонную колбу налить 50 мл воды, то можно увидеть, что вещество сразу принимает форму химического сосуда.Но как только из колбы выливаем воду, жидкость сразу растекается по поверхности стола. Объем воды останется прежним — 50 мл, а ее форма изменится. Эти особенности характерны для жидкой формы существования материи. В жидкостях много органических веществ: спирты, растительные масла, кислоты.
Молоко представляет собой эмульсию, т.е. жидкость, в которой находятся капли жира. Полезное жидкое ископаемое — масло. Его добывают из скважин с помощью буровых установок на суше и в океане.Морская вода также является сырьем для промышленности. Его отличие от пресной воды рек и озер состоит в содержании растворенных веществ, в основном солей. При испарении с поверхности резервуаров в парообразное состояние переходят только молекулы H 2 О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
С полным удалением солей дистиллированной водой. Кипит при 100 ° C, замерзает при 0 ° C.Рассолы закипают и при других температурах превращаются в лед. Например, вода в Северном Ледовитом океане замерзает при температуре поверхности 2 ° C.
Агрегатное состояние ртути при нормальных условиях — жидкое. Этот серебристо-серый металл обычно заполняют медицинскими термометрами. При нагревании столбик ртути поднимается по шкале, вещество расширяется. Почему в уличных градусниках используется спирт, окрашенный красной краской, а не ртуть? Объясняется это свойствами жидкого металла.При 30-градусном морозе агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, и ртуть вылилась наружу, то собирать серебряные шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсично. Детям в таких случаях следует обращаться за помощью к родителям и взрослым.
Газообразное состояние
Газы не могут сохранять ни объем, ни форму. Заполните колбу доверху кислородом (химическая формула O 2) .Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в комнате. Это связано с броуновским движением. Древнегреческий ученый Демокрит считал, что частицы материи находятся в постоянном движении. В твердых телах в нормальных условиях атомы, молекулы, ионы не имеют возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Это возможно только при подаче большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей.Например, жидкое агрегатное состояние кислорода наблюдается только при понижении температуры газа до -183 ° C. При -223 ° C молекулы O 2 образуют твердое тело. Когда температура поднимается выше этих значений, кислород превращается в газ. Именно в таком виде он находится в обычных условиях. На промышленных предприятиях существуют специальные установки для отделения воздуха от атмосферы и получения из нее азота и кислорода. Сначала охлаждают и сжижают воздух, а затем постепенно до температуры i
.состояний вещества: введение
1 Твердые вещества, жидкости и газы
Что отличает твердые тела, жидкости и газы — три основных состояния материи — друг от друга? Давайте начнем с микроскопического уровня с обзора того, что мы знаем о газах, простейшем состоянии, в котором может существовать материя. При обычном давлении молекулы газа так далеко друг от друга, что межмолекулярные силы незначительно влияют на случайные тепловые движения отдельных частиц.При понижении температуры и повышении давления межмолекулярное притяжение становится более важным, и у молекул будет возрастающая тенденция к образованию временных кластеров. Однако они настолько недолговечны, что даже в экстремальных условиях нельзя сказать, что газы обладают «структурой» в обычном смысле.
Контраст на микроскопическом уровне между твердыми телами, жидкостями и газами наиболее отчетливо виден на упрощенных схематических изображениях выше.Молекулярные единицы кристаллических твердых веществ имеют тенденцию быть высокоупорядоченными, причем каждая единица занимает фиксированное положение по отношению к другим. В жидкостях молекулы могут скользить друг вокруг друга, привнося элемент беспорядка и создавая пустоты, уменьшающие плотность. Газы представляют собой картину почти полного беспорядка, практически без ограничений относительно того, где может находиться какая-либо одна молекула.
Твердые тела, жидкости и газы: чем их отличить
Прожив нашу жизнь в мире, состоящем из твердых тел, жидкостей и газов, немногие из нас когда-либо испытывают трудности с определением, в какую из этих категорий попадает данный образец материи.Наше решение чаще всего основывается на чисто визуальных подсказках:
- газ прозрачен и не имеет определенных границ, кроме тех, которые могут быть наложены стенками ограничивающего сосуда.
- Жидкости и твердые тела обладают четко очерченной границей фаз, которая придает твердым телам их определенную форму и чьи светоотражающие свойства позволяют отличить одну фазу от другой.
- Твердые тела могут иметь любую мыслимую форму, а их поверхности обычно слишком неправильны, чтобы показать зеркальное (зеркальное) отражение света.Жидкости, напротив, мобильные ; За исключением случаев, когда жидкости имеют форму крошечных капель, они не имеют собственной формы, но принимают форму своего сосуда и имеют приблизительно плоскую верхнюю поверхность.
Наш опыт также показывает нам, что эти категории весьма различны; фаза , которая, как вы помните, представляет собой область материи с однородными интенсивными свойствами, является либо газом, либо жидкостью, либо твердым телом. Таким образом, три состояния материи — это не просто три точки на континууме; когда обычное твердое тело плавится, оно обычно расплавляется при определенной температуре, явно не проходя через какие-либо состояния, промежуточные между твердым телом и жидкостью.
Некоторые твердые вещества могут течь — медленно! на территории Канады Юкон. Типичные дебиты ледников составляют 10-200 м / год.. []
Хотя эти представления здравого смысла обычно верны, они не безошибочны, и на самом деле есть газы, которые не являются прозрачными, есть твердые вещества, такие как стекла и многие пластмассы, которые не имеют острых точек плавления, а вместо этого претерпевают постепенный переход. от твердого до жидкого, известного как умягчение , и при достаточном давлении твердые вещества могут проявлять некоторые свойства текучести жидкостей (например, ледяной лед).
Макроскопические физические свойства газов
Более научный подход заключался бы в сравнении макроскопических физических свойств трех состояний материи, но даже здесь мы сталкиваемся с трудностями. Верно, например, что плотность газа обычно составляет примерно одну тысячную плотности жидкости или твердого вещества при той же температуре и давлении; таким образом, один грамм водяного пара при 100 ° C и давлении 1 атм занимает объем 1671 мл; когда он конденсируется в жидкую воду при той же температуре, он занимает только 1.043 мл.
| газ на СТП | 22400 см 3 / моль общий объем |
|---|---|
| жидкость | 16,8 см 3 / моль |
| цельный | 13,9 см 3 / моль |
Сравнение молярных объемов неона в трех его состояниях.Для газообразного состояния P = 1 атм и T = 0 ° C. Исключенный объем — это объем, фактически занимаемый атомами неона в соответствии с моделью Ван-дер-Ваальса.
| газ | 22400 см 3 / моль общий объем (42 см 3 / моль без учета объема) |
|---|---|
| жидкость | 16,8 см 3 / моль |
| цельный | 13.9 см 3 / моль |
Здесь мы сравниваем молярные объемы неона в трех его состояниях. Для газообразного состояния P = 1 атм и T = 0 ° C. Исключенный объем — это объем, фактически занимаемый атомами неона в соответствии с.
Именно этот крайний контраст с газообразными состояниями приводит к названию « конденсированных состояний вещества » для жидкостей и твердых тел. Однако газы при очень высоких давлениях могут иметь плотность, превышающую плотности других твердых и жидких веществ, поэтому сама по себе плотность не является достаточно полным критерием для различия между газообразным и конденсированным состояниями вещества.
Точно так же плотность твердого вещества обычно больше, чем плотность соответствующей жидкости при той же температуре и давлении, но не всегда: вы наверняка видели лед, плавающий на воде!
Пример проблемы: плотность газообразного ксенонаСравните плотность газообразного ксенона (молярная масса 131 г) при 100 атм и 0 ° C с плотностью углеводородной жидкости, для которой ρ = 0,104 г / мл при той же температуре.
Решение: Для простоты предположим, что ксенон приближается к идеальному газу в этих условиях, что на самом деле не так.
Идеальный молярный объем при 0 ° C и 1 атм составляет 22,4 л; при 100 атм это будет уменьшено до 0,22 л или 220 мл, что даст плотность ρ = (131 г) / (224 мл) = 0,58 г / мл.
В своем автобиографическом Uncle Tungsten покойный врач / автор описывает свой опыт с заполненными ксеноном воздушными шарами «удивительной плотности — настолько близкими к« свинцовым воздушным шарам », насколько это могло быть [вообразить]. Если покрутить эти ксеноновые шары в руке, а затем остановиться, тяжелый газ, благодаря своему импульсу, продолжит вращаться в течение минуты, почти как жидкость.«Другие физические свойства, такие как сжимаемость, поверхностное натяжение и вязкость, несколько более полезны для различения различных состояний вещества. Однако даже они не дают четко очерченных разделительных линий между различными состояниями.
Вместо того, чтобы пытаться разработать строгую схему классификации трех состояний материи, будет более полезным просто представить несколько обобщений.
Если вы не знаете значение одного из терминов в столбце «свойство» в таблице, просто наведите на него указатель мыши, чтобы вызвать краткое определение.
.Что такое агрегатное состояние? Агрегатное состояние вещества
Вопросы о том, что такое агрегатное состояние, какими свойствами и свойствами обладают твердые тела, жидкости и газы, рассматриваются в нескольких учебных курсах. Есть три классических состояния вещества с характерными особенностями строения. Их понимание — важный момент в понимании наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучаются в физике, химии, географии, геологии, физической химии и других научных дисциплинах.Вещества, находящиеся при определенных условиях в одном из трех основных типов состояния, могут изменяться при повышении или понижении температуры и давления. Рассмотрим возможные переходы из одного агрегированного состояния в другое, как они осуществляются в природе, технике и повседневной жизни.
Что такое агрегатное состояние?
Слово латинского происхождения «агрего» в переводе на русский язык означает «прикреплять». Научный термин относится к состоянию одного и того же тела, вещества. Существование твердых тел, газов и жидкостей при определенных значениях температуры и различных давлениях характерно для всех оболочек Земли.Помимо трех основных агрегатных состояний существует еще четвертое. При повышенной температуре и постоянном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, нужно вспомнить мельчайшие частицы, из которых состоят вещества и тела.
На диаграмме вверху показано: а — газ; б — жидкость; c — твердое тело. На этих рисунках кружками обозначены структурные элементы веществ. Это условное обозначение, ведь атомы, молекулы, ионы — это не твердые шары.Атомы состоят из положительно заряженного ядра, вокруг которого с большой скоростью движутся отрицательно заряженные электроны. Знание микроскопической структуры вещества помогает лучше понять различия, существующие между различными формами агрегатов.
Представления о микромире: от Древней Греции до 17 века
Первые сведения о частицах, из которых состоят физические тела, появились еще в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом.Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны двигаться и взаимодействовать друг с другом. Атомизм стал самым передовым для своего времени учением Древней Греции. Но его развитие застопорилось в средние века. С тех пор ученых преследовала инквизиция Римско-католической церкви. Поэтому до нового времени не существовало внятного представления о том, что такое агрегатное состояние вещества. Только после XVII века учёные Р.Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Атомы, молекулы, ионы — микроскопические частицы структуры материи
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных ранее учеными, удалось сложить гармоничную картину микромира.Теории, описывающие состояние и поведение мельчайших частиц материи, довольно сложны, они относятся к области квантовой физики. Чтобы понять характеристики разных агрегатных состояний вещества, достаточно знать названия и особенности основных структурных частиц, образующих разные вещества.
- Атомы — это химически неделимые частицы. Сохраняется в химических реакциях, но разрушается в ядерной. Металлы и многие другие вещества атомной структуры в обычных условиях имеют твердое агрегатное состояние.
- Молекулы — это частицы, которые разрушаются и образуются в ходе химических реакций. В молекулярном строении есть кислород, вода, углекислый газ, сера. Агрегатное состояние кислорода, азота, диоксида серы, углерода, кислорода при нормальных условиях газообразное.
- Ионы — это заряженные частицы, в которые они превращаются атомы и молекулы, когда электроны присоединяются или теряют — микроскопические отрицательно заряженные частицы. В ионной структуре много солей, например кулинарных, железного и медного купороса.
Есть вещества, частицы которых определены, расположены в пространстве. Упорядоченное взаимное расположение атомов, ионов, молекул называется кристаллической решеткой. Обычно для твердых тел характерны ионные и атомные кристаллические решетки, для жидкостей и газов — молекулярные решетки. Алмаз отличается высокой твердостью. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит также состоит из атомов этого химического элемента. Только они по-разному расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество становится жидкостью и аморфной массой.
Вещества в твердом агрегатном состоянии
Твердые вещества при нормальных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок камня или металла. Если нагреть сахар, вещество начинает плавиться, превращаясь в вязкую жидкость коричневого цвета. Прекращаем нагревание — снова получаем твердое вещество. Следовательно, одним из главных условий перехода твердого тела в жидкость является его нагрев или увеличение внутренней энергии частиц вещества.Также можно изменить твердое состояние соли, используемой в пищу. Но чтобы растопить соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль — из заряженных ионов, которые больше притягиваются друг к другу. Твердые тела в жидкой форме не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при плавлении объясняется нарушением связи между ионами в кристаллах.Высвобождаются заряженные частицы, которые могут нести электрические заряды. Расплавы солей проводят электричество, они проводники. В химической, металлургической и машиностроительной отраслях твердые вещества преобразуются в жидкие для образования новых соединений или для придания им другой формы. Широко использовались сплавы металлов. Их можно получить несколькими способами, связанными с изменением агрегатного состояния твердого сырья.
Жидкость — одно из основных агрегатных состояний
Если в круглодонную колбу налить 50 мл воды, то можно увидеть, что вещество сразу принимает форму химического сосуда.Но как только из колбы выливаем воду, жидкость сразу растекается по поверхности стола. Объем воды останется прежним — 50 мл, а ее форма изменится. Эти особенности характерны для жидкой формы существования материи. В жидкостях много органических веществ: спирты, растительные масла, кислоты.
Молоко представляет собой эмульсию, т.е. жидкость, в которой находятся капли жира. Полезное жидкое ископаемое — масло. Его добывают из скважин с помощью буровых установок на суше и в океане.Морская вода также является сырьем для промышленности. Его отличие от пресной воды рек и озер состоит в содержании растворенных веществ, в основном солей. При испарении с поверхности резервуаров в парообразное состояние переходят только молекулы H 2 О, растворенные вещества остаются. По этому свойству методы получения полезной подстанции
.совокупное состояние Википедия
Четкие формы, которые принимают различные фазы материи
Четыре общих состояния материи. По часовой стрелке сверху слева они представляют собой твердое тело, жидкость, плазму и газ, представленные ледяной скульптурой, каплей воды, электрической дугой от катушки Тесла и воздухом вокруг облаков соответственно.В физике состояние вещества — одна из различных форм, в которых может существовать материя. В повседневной жизни можно наблюдать четыре состояния вещества: твердое, жидкое, газообразное и плазменное.Известно, что существует множество промежуточных состояний, таких как жидкий кристалл, а некоторые состояния существуют только в экстремальных условиях, таких как конденсаты Бозе-Эйнштейна, нейтронно-вырожденная материя и кварк-глюонная плазма, которые возникают, соответственно, только в экстремальных ситуациях. холод, чрезвычайная плотность и чрезвычайно высокая энергия. Полный список всех экзотических состояний вещества см. В списке состояний вещества.
Исторически различие проводится на основе качественных различий в свойствах.Материя в твердом состоянии сохраняет фиксированный объем и форму, при этом составляющие частицы (атомы, молекулы или ионы) сближаются и фиксируются на месте. Вещество в жидком состоянии сохраняет фиксированный объем, но имеет переменную форму, которая адаптируется к своему контейнеру. Его частицы все еще находятся близко друг к другу, но свободно перемещаются. Вещество в газообразном состоянии имеет переменный объем и форму, приспосабливаясь к своему контейнеру. Его частицы не находятся ни близко друг к другу, ни на месте. Материя в плазменном состоянии имеет переменный объем и форму и содержит нейтральные атомы, а также значительное количество ионов и электронов, которые могут свободно перемещаться.
Термин фаза иногда используется как синоним состояния материи, но система может содержать несколько несмешивающихся фаз одного и того же состояния материи.
Четыре основных состояния []
Цельный []
В твердом теле составляющие частицы (ионы, атомы или молекулы) плотно упакованы вместе. Силы между частицами настолько велики, что частицы не могут свободно двигаться, а могут только колебаться. В результате твердое тело имеет устойчивую определенную форму и определенный объем.Твердые тела могут изменять свою форму только под действием внешней силы, например, при разрыве или разрезании.
В кристаллических твердых телах частицы (атомы, молекулы или ионы) упакованы в регулярно упорядоченный повторяющийся узор. Существуют различные кристаллические структуры, и одно и то же вещество может иметь более одной структуры (или твердой фазы). Например, железо имеет объемно-центрированную кубическую структуру при температурах ниже 912 ° C (1674 ° F) и гранецентрированную кубическую структуру между 912 и 1394 ° C (2541 ° F). Лед имеет пятнадцать известных кристаллических структур или пятнадцать твердых фаз, которые существуют при различных температурах и давлениях. [1]
Стекла и другие некристаллические аморфные твердые тела без дальнего порядка не являются основными состояниями теплового равновесия; поэтому ниже они описаны как неклассические состояния вещества.
Твердые вещества могут быть преобразованы в жидкости путем плавления, а жидкости могут быть преобразованы в твердые тела путем замораживания. Твердые вещества также могут напрямую превращаться в газы в процессе сублимации, а газы могут также напрямую превращаться в твердые тела в результате осаждения.
Жидкость []
Структура классической одноатомной жидкости.У атомов есть много ближайших соседей в контакте, но дальний порядок отсутствует.Жидкость — это почти несжимаемая жидкость, которая повторяет форму своего сосуда, но сохраняет (почти) постоянный объем независимо от давления. Объем определен, если температура и давление постоянны. Когда твердое тело нагревается выше точки плавления, оно становится жидким, если давление выше тройной точки вещества. Межмолекулярные (или межатомные, или межионные) силы по-прежнему важны, но у молекул достаточно энергии, чтобы двигаться относительно друг друга, и структура подвижна.Это означает, что форма жидкости не определена, но определяется ее емкостью. Объем обычно больше, чем у соответствующего твердого вещества, наиболее известным исключением является вода, H 2 O. Самая высокая температура, при которой может существовать данная жидкость, является ее критической температурой. [2]
Газ []
Промежутки между молекулами газа очень большие. Молекулы газа имеют очень слабые связи или совсем не связаны. Молекулы в «газе» могут двигаться свободно и быстро.Газ — сжимаемая жидкость.Мало того, что газ будет соответствовать форме своего контейнера, он также расширится, чтобы заполнить контейнер.
В газе молекулы обладают достаточной кинетической энергией, поэтому влияние межмолекулярных сил невелико (или равно нулю для идеального газа), а типичное расстояние между соседними молекулами намного больше, чем размер молекулы. Газ не имеет определенной формы или объема, но занимает весь контейнер, в котором он заключен. Жидкость может быть преобразована в газ путем нагревания при постоянном давлении до точки кипения или же путем снижения давления при постоянной температуре.
При температурах ниже его критической температуры газ также называют паром, и его можно сжижать только путем сжатия без охлаждения. Пар может существовать в равновесии с жидкостью (или твердым телом), и в этом случае давление газа равно давлению пара жидкости (или твердого тела).
Сверхкритическая жидкость (SCF) — это газ, температура и давление которого выше критической температуры и критического давления соответственно. В этом состоянии исчезает различие между жидкостью и газом.Сверхкритическая жидкость имеет физические свойства газа, но ее высокая плотность в некоторых случаях придает свойства растворителя, что приводит к полезным применениям. Например, сверхкритический диоксид углерода используется для извлечения кофеина при производстве кофе без кофеина. [3]
Плазма []
В плазме электроны отрываются от своих ядер, образуя электронное «море». Это дает ему возможность проводить электричество.Как и газ, плазма не имеет определенной формы или объема.В отличие от газов, плазма электропроводна, создает магнитные поля и электрические токи и сильно реагирует на электромагнитные силы. Положительно заряженные ядра плавают в «море» свободно движущихся диссоциированных электронов, подобно тому, как такие заряды существуют в проводящем металле, где это электронное «море» позволяет материи в состоянии плазмы проводить электричество.
Газ обычно превращается в плазму одним из двух способов, например, либо из-за огромной разницы напряжений между двумя точками, либо путем воздействия на него чрезвычайно высоких температур.Нагревание вещества до высоких температур заставляет электроны покидать атомы, в результате чего появляются свободные электроны. Это создает так называемую частично ионизированную плазму. При очень высоких температурах, таких как те, что присутствуют в звездах, предполагается, что по существу все электроны «свободны», и что плазма очень высокой энергии — это, по сути, голые ядра, плавающие в море электронов. При этом образуется так называемая полностью ионизированная плазма.
Состояние плазмы часто понимают неправильно, и хотя оно не существует свободно в нормальных условиях на Земле, оно довольно часто генерируется либо молнией, электрическими искрами, флуоресцентным светом, неоновым светом или в плазменных телевизорах.Корона Солнца, некоторые типы пламени и звезды — все это примеры освещенного вещества в плазменном состоянии.
Фазовые переходы []
Эта диаграмма иллюстрирует переходы между четырьмя фундаментальными состояниями материи.Состояние вещества также характеризуется фазовыми переходами. Фазовый переход указывает на изменение структуры и может быть распознан по резкому изменению свойств. Отдельное состояние материи можно определить как любой набор состояний, отличающийся от любого другого набора состояний фазовым переходом.Можно сказать, что вода имеет несколько различных твердых состояний. [4] Появление сверхпроводимости связано с фазовым переходом, поэтому существуют сверхпроводящие состояния. Точно так же ферромагнитные состояния разграничиваются фазовыми переходами и обладают отличительными свойствами. Когда изменение состояния происходит поэтапно, промежуточные этапы называют мезофазами. Такие фазы использовались благодаря внедрению жидкокристаллической технологии. [5] [6]
Состояние или фазы данного набора материи может изменяться в зависимости от условий давления и температуры, переходя в другие фазы по мере того, как эти условия меняются в пользу их существования; например, твердое тело переходит в жидкость при повышении температуры.Вблизи абсолютного нуля вещество существует как твердое тело. Когда к этому веществу добавляется тепло, оно плавится в жидкость при температуре плавления, кипит в газ при температуре кипения, и при достаточно высоком нагреве переходит в состояние плазмы, в котором электроны получают такую энергию, что покидают свои родительские атомы.
Формы материи, которые не состоят из молекул и организованы разными силами, также могут считаться разными состояниями материи. Примеры — сверхтекучая жидкость (например, фермионный конденсат) и кварк-глюонная плазма.
В химическом уравнении состояние вещества химических веществ может быть показано как (я) для твердого вещества, (l) для жидкости и (g) для газа. Водный раствор обозначается (водн.). Материя в состоянии плазмы редко (если вообще используется) в химических уравнениях, поэтому нет стандартного символа для ее обозначения. В редких уравнениях, в которых используется плазма, она обозначена как (p).
Неклассические состояния []
Стекло []
Схематическое изображение стеклообразной формы со случайной сеткой (слева) и упорядоченной кристаллической решетки (справа) идентичного химического состава.
Стекло — это некристаллический или аморфный твердый материал, который проявляет стеклование при нагревании до жидкого состояния. Стекла могут быть сделаны из самых разных классов материалов: неорганических сеток (таких как оконное стекло, сделанное из силиката с добавками), металлических сплавов, ионных расплавов, водных растворов, молекулярных жидкостей и полимеров. Термодинамически стекло находится в метастабильном состоянии по отношению к своему кристаллическому аналогу. А вот конверсия практически равна нулю.
Кристаллы с некоторой степенью беспорядка []
Пластиковый кристалл — это молекулярное твердое тело с дальним позиционным порядком, но с составляющими молекулами, сохраняющими свободу вращения; в ориентационном стекле эта степень свободы заморожена в закаленном неупорядоченном состоянии.
Аналогично в спиновом стекле замораживается магнитный беспорядок.
Состояния жидкого кристалла []
Жидкокристаллические состояния обладают промежуточными свойствами между подвижными жидкостями и упорядоченными твердыми телами.Как правило, они могут течь как жидкость, но с дальним порядком. Например, нематическая фаза состоит из длинных стержневидных молекул, таких как пара-азоксианизол, который является нематиком в диапазоне температур 118–136 ° C (244–277 ° F). [7] В этом состоянии молекулы текут, как в жидкости, но все они указывают в одном направлении (в пределах каждой области) и не могут свободно вращаться. Подобно кристаллическому твердому телу, но в отличие от жидкости, жидкие кристаллы реагируют на поляризованный свет.
Другие типы жидких кристаллов описаны в основной статье по этим состояниям.Некоторые типы имеют технологическое значение, например, в жидкокристаллических дисплеях.
Магнитно-упорядоченный []
Атомы переходных металлов часто имеют магнитные моменты из-за чистого спина электронов, которые остаются неспаренными и не образуют химических связей. В некоторых твердых телах магнитные моменты на разных атомах упорядочены и могут образовывать ферромагнетик, антиферромагнетик или ферримагнетик.
В ферромагнетике, например в твердом железе, магнитный момент каждого атома ориентирован в одном направлении (в пределах магнитного домена).Если домены также выровнены, твердое тело представляет собой постоянный магнит, который является магнитным даже в отсутствие внешнего магнитного поля. Намагниченность исчезает, когда магнит нагревается до точки Кюри, которая для железа составляет 768 ° C (1414 ° F).
Антиферромагнетик имеет две сети равных и противоположных магнитных моментов, которые компенсируют друг друга, так что суммарная намагниченность равна нулю. Например, в оксиде никеля (II) (NiO) половина атомов никеля имеет моменты, ориентированные в одном направлении, а половина — в противоположном направлении.
В ферримагнетике две сети магнитных моментов противоположны, но не равны, так что компенсация является неполной и имеется ненулевая суммарная намагниченность. Примером является магнетит (Fe 3 O 4 ), который содержит ионы Fe 2+ и Fe 3+ с разными магнитными моментами.
Квантовая спиновая жидкость (КСЛ) — это неупорядоченное состояние в системе взаимодействующих квантовых спинов, которое сохраняет свой беспорядок до очень низких температур, в отличие от других неупорядоченных состояний.Это не жидкость в физическом смысле, а твердое тело, магнитный порядок которого по своей природе неупорядочен. Название «жидкость» связано с аналогией с молекулярным беспорядком в обычной жидкости. КСЛ не является ни ферромагнетиком, где магнитные домены параллельны, ни антиферромагнетиком, где магнитные домены антипараллельны; вместо этого магнитные домены ориентированы случайным образом. Это можно реализовать, например, геометрически нарушенными магнитными моментами, которые не могут указывать равномерно параллельно или антипараллельно.При охлаждении и переходе в какое-либо состояние домен должен «выбрать» ориентацию, но если возможные состояния близки по энергии, одно из них будет выбрано случайным образом. Следовательно, несмотря на сильный ближний порядок, дальний магнитный порядок отсутствует.
Микрофазно-разделенные []
Блок-сополимер SBS в сополимерах TEMможет подвергаться микрофазовому разделению с образованием разнообразного набора периодических наноструктур, как показано в примере блок-сополимера стирола, бутадиена и стирола, показанного справа.Микрофазовое разделение можно понять по аналогии с разделением фаз между маслом и водой. Из-за химической несовместимости между блоками блок-сополимеры претерпевают аналогичное фазовое разделение. Однако, поскольку блоки ковалентно связаны друг с другом, они не могут макроскопически расслаиваться, как вода и масло, и поэтому вместо этого блоки образуют структуры нанометрового размера. В зависимости от относительной длины каждого блока и общей топологии блока полимера можно получить множество морфологий, каждая из которых имеет свою собственную фазу вещества.
Ионные жидкости также демонстрируют микрофазовое разделение. Анион и катион не обязательно совместимы и в противном случае могли бы расслоиться, но притяжение электрического заряда препятствует их разделению. Их анионы и катионы, по-видимому, диффундируют в разделенных слоях или мицеллах, а не свободно, как в однородной жидкости. [8]
Низкотемпературные состояния []
сверхтекучая []
Жидкий гелий в сверхтекучей фазе ползет по стенкам стакана пленкой Роллина, в конечном итоге капая из стакана.Близко к абсолютному нулю некоторые жидкости образуют второе жидкое состояние, описываемое как сверхтекучий , потому что оно имеет нулевую вязкость (или бесконечную текучесть, т.е. течет без трения). Это было открыто в 1937 году для гелия, который образует сверхтекучую среду при температуре ниже лямбда 2,17 К (-270,98 ° C; -455,76 ° F). В этом состоянии он попытается «вылезти» из контейнера. [9] Он также имеет бесконечную теплопроводность, так что в сверхтекучей жидкости не может образоваться температурный градиент.Помещение сверхтекучей жидкости во вращающийся контейнер приведет к квантованным вихрям.
Эти свойства объясняются теорией, согласно которой обычный изотоп гелий-4 образует конденсат Бозе – Эйнштейна (см. Следующий раздел) в сверхтекучем состоянии. Совсем недавно сверхтекучие фермионные конденсаты были образованы при еще более низких температурах редкими изотопами гелием-3 и литием-6. [10]
Конденсат Бозе – Эйнштейна []
Скорость в газе рубидия при его охлаждении: слева исходный материал, справа конденсат Бозе – Эйнштейна.В 1924 году Альберт Эйнштейн и Сатьендра Нат Бозе предсказали «конденсат Бозе – Эйнштейна» (БЭК), который иногда называют пятым состоянием материи. В БЭК вещество перестает вести себя как независимые частицы и коллапсирует в единое квантовое состояние, которое можно описать единой однородной волновой функцией.
В газовой фазе конденсат Бозе – Эйнштейна долгие годы оставался непроверенным теоретическим предсказанием. В 1995 году исследовательские группы Эрика Корнелла и Карла Вимана из JILA в Университете Колорадо в Боулдере экспериментально получили первый такой конденсат.Конденсат Бозе – Эйнштейна «холоднее» твердого тела. Это может произойти, когда атомы имеют очень похожие (или одинаковые) квантовые уровни при температурах, очень близких к абсолютному нулю, -273,15 ° C (-459,67 ° F).
Фермионный конденсат []
Фермионный конденсат похож на конденсат Бозе – Эйнштейна, но состоит из фермионов. Принцип исключения Паули предотвращает переход фермионов в одно и то же квантовое состояние, но пара фермионов может вести себя как бозон, и несколько таких пар могут без ограничений входить в одно и то же квантовое состояние.
Молекула Ридберга []
Одним из метастабильных состояний сильно неидеальной плазмы является ридберговское вещество, образующееся при конденсации возбужденных атомов. Эти атомы также могут превращаться в ионы и электроны, если они достигают определенной температуры. В апреле 2009 года журнал Nature сообщил о создании ридберговских молекул из ридберговского атома и атома в основном состоянии, [11] , подтверждая, что такое состояние материи могло существовать. [12] Эксперимент проводился на ультрахолодных атомах рубидия.
Квантовое состояние Холла []
Квантовое состояние Холла вызывает квантованное напряжение Холла, измеряемое в направлении, перпендикулярном току. Квантовое спиновое состояние Холла является теоретической фазой, которая может открыть путь для разработки электронных устройств, которые рассеивают меньше энергии и выделяют меньше тепла. Это результат квантового холловского состояния материи.
Фотонное вещество []
Фотонная материя — это явление, при котором фотоны, взаимодействующие с газом, приобретают кажущуюся массу и могут взаимодействовать друг с другом, даже образуя фотонные «молекулы».Источником массы является массивный газ. В этом отличие от фотонов, движущихся в пустом пространстве, которые не имеют массы покоя и не могут взаимодействовать.
Капля []
«Квантовый туман» электронов и дырок, которые текут друг вокруг друга и даже колеблются, как жидкость, а не существуют как отдельные пары. [13]
Высокоэнергетические состояния []
Вырожденное вещество []
Под чрезвычайно высоким давлением, как в ядрах мертвых звезд, обычная материя претерпевает переход в серию экзотических состояний материи, вместе известных как вырожденная материя, которые поддерживаются в основном квантово-механическими эффектами.В физике «вырожденный» относится к двум состояниям, которые имеют одинаковую энергию и поэтому взаимозаменяемы. Вырожденная материя поддерживается принципом исключения Паули, который не позволяет двум фермионным частицам занимать одно и то же квантовое состояние. В отличие от обычной плазмы, вырожденная плазма мало расширяется при нагревании, потому что импульсных состояний просто не остается. Следовательно, вырожденные звезды коллапсируют до очень высокой плотности. Более массивные вырожденные звезды меньше, потому что сила гравитации увеличивается, но давление не увеличивается пропорционально.
Вырожденное электроном вещество находится внутри белых карликов. Электроны остаются связанными с атомами, но могут переходить к соседним атомам. Нейтронно-вырожденное вещество находится в нейтронных звездах. Огромное гравитационное давление сжимает атомы так сильно, что электроны вынуждены объединяться с протонами через обратный бета-распад, что приводит к сверхплотному скоплению нейтронов. Обычно свободные нейтроны вне ядра атома распадаются с периодом полураспада чуть менее 15 минут, но в нейтронной звезде распад происходит за счет обратного распада.Холодное вырожденное вещество также присутствует на таких планетах, как Юпитер, и в еще более массивных коричневых карликах, у которых, как ожидается, будет ядро с металлическим водородом. Из-за вырождения более массивные коричневые карлики не намного больше. В металлах электроны можно моделировать как вырожденный газ, движущийся в решетке невырожденных положительных ионов.
Кварковая материя []
В обычной холодной материи кварки, фундаментальные частицы ядерной материи, удерживаются сильным взаимодействием в адронах, состоящих из 2–4 кварков, таких как протоны и нейтроны.Кварковая материя или квантово-хромодинамическая (КХД) материя — это группа фаз, в которых преодолевается сильное взаимодействие, и кварки деконферируются и могут двигаться. Фазы кварковой материи возникают при чрезвычайно высоких плотностях или температурах, и не существует известных способов получения их в равновесии в лаборатории; в обычных условиях любая образовавшаяся кварковая материя сразу подвергается радиоактивному распаду.
Странная материя — это тип кварковой материи, которая, как предполагается, существует внутри некоторых нейтронных звезд, близких к пределу Толмена – Оппенгеймера – Волкова (примерно 2–3 массы Солнца), хотя прямых доказательств ее существования нет.В странной материи часть доступной энергии проявляется в виде странных кварков — более тяжелого аналога обычного нижнего кварка. После образования он может быть стабильным в состояниях с более низкой энергией, хотя это неизвестно.
Кварк-глюонная плазма — это очень высокотемпературная фаза, в которой кварки становятся свободными и могут двигаться независимо, а не постоянно связаны в частицы, в море глюонов, субатомных частиц, которые передают сильную силу, связывающую кварки вместе. Это аналогично освобождению электронов от атомов в плазме.Это состояние на короткое время достигается при столкновении тяжелых ионов чрезвычайно высоких энергий в ускорителях частиц и позволяет ученым наблюдать свойства отдельных кварков, а не только теоретизировать. Кварк-глюонная плазма была открыта в ЦЕРНе в 2000 году. В отличие от плазмы, которая течет как газ, взаимодействия внутри КГП сильные, и она течет как жидкость.
Предполагается, что кварки при высоких плотностях, но относительно низких температурах образуют кварковую жидкость, природа которой в настоящее время неизвестна. Он образует отчетливую фазу с фиксированным цветом и вкусом (CFL) при еще более высоких плотностях.Эта фаза является сверхпроводящей для цветного заряда. Эти фазы могут встречаться в нейтронных звездах, но в настоящее время они являются теоретическими.
Конденсат цветного стекла []
Конденсат цветного стекла — это вещество, которое, согласно теории, существует в атомных ядрах, движущихся со скоростью, близкой к скорости света. Согласно теории относительности Эйнштейна, высокоэнергетическое ядро кажется сжатым или сжатым по длине в направлении своего движения. В результате глюоны внутри ядра кажутся стационарному наблюдателю как «глюонная стена», движущаяся со скоростью, близкой к скорости света.Видно, что при очень высоких энергиях плотность глюонов в этой стенке сильно увеличивается. В отличие от кварк-глюонной плазмы, образующейся при столкновении таких стенок, конденсат цветного стекла описывает сами стенки и является внутренним свойством частиц, которое можно наблюдать только в условиях высоких энергий, например, на RHIC и, возможно, при а также Большой адронный коллайдер.
Состояния с очень высокой энергией []
Различные теории предсказывают новые состояния вещества при очень высоких энергиях.Неизвестное состояние создало барионную асимметрию во Вселенной, но об этом мало что известно. В теории струн температура Хагедорна предсказывается для суперструн на уровне примерно 10 30 К, где суперструны образуются в большом количестве. При температуре Планка (10 32 K) гравитация становится значительной силой между отдельными частицами. Никакая современная теория не может описать эти состояния, и они не могут быть получены с помощью каких-либо предсказуемых экспериментов. Однако эти состояния важны в космологии, потому что Вселенная могла пройти через эти состояния во время Большого взрыва.
Гравитационная сингулярность , предсказанная общей теорией относительности для существования в центре черной дыры, является , а не фазой материи; это вовсе не материальный объект (хотя масса-энергия вещества способствовала его созданию), а скорее свойство пространства-времени. Поскольку пространство-время там разрушается, сингулярность следует рассматривать не как локализованную структуру, а как глобальную топологическую особенность пространства-времени. [14] Утверждалось, что элементарные частицы принципиально не материальны, но являются локализованными свойствами пространства-времени. [15] . В квантовой гравитации сингулярности могут фактически отмечать переходы в новую фазу материи. [16]
Другие предлагаемые состояния []
Supersolid []
Супертвердое тело — это пространственно упорядоченный материал (то есть твердое тело или кристалл) со сверхтекучими свойствами. Подобно сверхтекучей жидкости, сверхтвердое тело может двигаться без трения, но сохраняет жесткую форму. Хотя супертвердое тело является твердым телом, оно проявляет так много характерных свойств, отличных от других твердых тел, что многие утверждают, что это другое состояние вещества. [17]
Жидкость для струн-нетто []
В жидкости, состоящей из струнных сеток, атомы имеют явно нестабильное расположение, как жидкость, но по-прежнему согласованы в общей структуре, как твердое тело. В нормальном твердом состоянии атомы вещества выстраиваются в сетку, так что спин любого электрона противоположен спину всех электронов, касающихся его. Но в жидкости, состоящей из струнных сеток, атомы расположены по некоторому шаблону, который требует, чтобы у некоторых электронов были соседи с таким же спином. Г. Мурти; и другие. (1997). «Сверхтекучие жидкости и сверхтвердые тела на расслоенных двумерных решетках». Физический обзор B . 55 (5): 3104. arXiv: cond-mat / 9607217. Bibcode: 1997PhRvB..55.3104M. DOI: 10.1103 / PhysRevB.55.3104.
Внешние ссылки []
- 2005-06-22, MIT News: Физики Массачусетского технологического института создают новую форму материи Citat: «… Они стали первыми, кто создал новый тип материи, газ из атомов, который показывает высокотемпературную сверхтекучесть.«
- 10-10 2003, Science Daily: Металлическая фаза для бозонов предполагает новое состояние вещества
- 15.01.2004, ScienceDaily: Вероятное открытие новой сверхтвердой фазы материи. Читат: «… По-видимому, мы впервые наблюдали твердый материал с характеристиками сверхтекучей жидкости … но потому что все его частицы находятся в одинаковом квантовом состоянии, он остается твердым, даже несмотря на то, что составляющие его частицы непрерывно текут … «
- 29.01.2004, ScienceDaily: Ученые NIST / Университета Колорадо создают новую форму материи: фермионный конденсат
- Короткие видеоролики, демонстрирующие состояния материи, твердых тел, жидкостей и газов проф.Дж. М. Мюррелл, Университет Сассекса,



 Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться! Уже в первые дни после рождения ребенка, мать должна подумать, как сбалансировать свой рацион, потому что все потребляемые ей продукты поступают к ребенку через молоко. Чтобы питание было полноценным, в меню должно быть мясо. Лучшим вариантом является говядина, в первый месяц грудного вскармливания из-за своего состава, можно ли ее употреблять – да, и продукт пойдет на пользу, но нужно знать основные правила выбора и приготовления.
Уже в первые дни после рождения ребенка, мать должна подумать, как сбалансировать свой рацион, потому что все потребляемые ей продукты поступают к ребенку через молоко. Чтобы питание было полноценным, в меню должно быть мясо. Лучшим вариантом является говядина, в первый месяц грудного вскармливания из-за своего состава, можно ли ее употреблять – да, и продукт пойдет на пользу, но нужно знать основные правила выбора и приготовления. Говядина – популярное в РФ мясо, которое рассматривают как диетическое и часто используют для правильного питания. Помимо этого качества, оно отличается приятным вкусом. Чаще всего врачи советуют кормящим мамам употреблять в первый месяц грудного вскармливания говядину, но только в форме бульона, приготовленного из нее. Позже можно вводить в меню простое, отварное мясо, паровые котлеты, тефтели и фрикадельки.
Говядина – популярное в РФ мясо, которое рассматривают как диетическое и часто используют для правильного питания. Помимо этого качества, оно отличается приятным вкусом. Чаще всего врачи советуют кормящим мамам употреблять в первый месяц грудного вскармливания говядину, но только в форме бульона, приготовленного из нее. Позже можно вводить в меню простое, отварное мясо, паровые котлеты, тефтели и фрикадельки. При выборе продукта для питания кормящей мамы нужно внимательно осматривать место продажи. Не стоит покупать субпродукты и мясо на стихийных рынках, где не соблюдаются правила гигиены. Магазин должен быть оборудован рукомойником.
При выборе продукта для питания кормящей мамы нужно внимательно осматривать место продажи. Не стоит покупать субпродукты и мясо на стихийных рынках, где не соблюдаются правила гигиены. Магазин должен быть оборудован рукомойником.
 Вводить продукт в рацион можно на 2-3 месяце. При первом употреблении нужно попробовать небольшую порцию и контролировать состояние ребенка. Если аллергическая реакция отсутствует – продукт можно ввести в меню. Перечень основных правил, регламентирующих процесс употребления языка при ГВ, включает:
Вводить продукт в рацион можно на 2-3 месяце. При первом употреблении нужно попробовать небольшую порцию и контролировать состояние ребенка. Если аллергическая реакция отсутствует – продукт можно ввести в меню. Перечень основных правил, регламентирующих процесс употребления языка при ГВ, включает: Говядину можно употреблять только после тщательной термической обработки. Жареное мясо непозволительно вводить в меню женщины в период лактации. Не нужно использовать специи и приправы, если мясо приготовлено качественно, усилители вкуса не требуются, оно получается очень вкусным. Нужно помнить о нормах потребления продукта в сутки. Меню должно быть разнообразным, потому есть его каждый день, не следует.
Говядину можно употреблять только после тщательной термической обработки. Жареное мясо непозволительно вводить в меню женщины в период лактации. Не нужно использовать специи и приправы, если мясо приготовлено качественно, усилители вкуса не требуются, оно получается очень вкусным. Нужно помнить о нормах потребления продукта в сутки. Меню должно быть разнообразным, потому есть его каждый день, не следует. Мясо нарезают порционными кусочками и отбивают. Каждую порцию посыпают солью и перцем, оставляют на 20 минут. Выкладывают на сковороду с оливковым маслом и обжаривают по 2 минуты с каждой стороны. Заготовку закладывают в керамический горшочек, добавляют картофель и другие овощи по вкусу. Блюдо отправляют в духовку, прогретую до 180 градусов на 1,5 часа.
Мясо нарезают порционными кусочками и отбивают. Каждую порцию посыпают солью и перцем, оставляют на 20 минут. Выкладывают на сковороду с оливковым маслом и обжаривают по 2 минуты с каждой стороны. Заготовку закладывают в керамический горшочек, добавляют картофель и другие овощи по вкусу. Блюдо отправляют в духовку, прогретую до 180 градусов на 1,5 часа. Говядину вымачивают в воде не менее 2 часов, это нужно, чтобы суп получился полезным. Выкладывают мясной ингредиент в кастрюлю и отправляют ее на плиту. Первый бульон сливают. После повторного кипения добавляют лавровый лист и несколько горошин перца. Лавр вынимают из кастрюли через 10 минут.
Говядину вымачивают в воде не менее 2 часов, это нужно, чтобы суп получился полезным. Выкладывают мясной ингредиент в кастрюлю и отправляют ее на плиту. Первый бульон сливают. После повторного кипения добавляют лавровый лист и несколько горошин перца. Лавр вынимают из кастрюли через 10 минут. Для приготовления паровых котлет, хлеб замачивают в молоке, а затем перекручивают в фарш вместе с луком и мясом. Добавляют куриное яйцо, соль и перец по вкусу. Котлеты по этому рецепту готовят в пароварке или мультиварке с функцией приготовление на пару. Блюдо часто используется в качестве гарнира для картофельного или овощного пюре и каш. Его можно ввести в рацион ребенка после исполнение 1 года.
Для приготовления паровых котлет, хлеб замачивают в молоке, а затем перекручивают в фарш вместе с луком и мясом. Добавляют куриное яйцо, соль и перец по вкусу. Котлеты по этому рецепту готовят в пароварке или мультиварке с функцией приготовление на пару. Блюдо часто используется в качестве гарнира для картофельного или овощного пюре и каш. Его можно ввести в рацион ребенка после исполнение 1 года. Для приготовления рагу, мясо нарезают на порционные кусочки и отваривают в слегка подсоленной воде около 30 минут. В глубокий казан наливают растительное масло и обжаривают морковь, картофель, лук, рубленый чеснок и другие овощи до готовности. Говядину вынимают с бульона и отправляют к овощам, обжаривают около 5 минут со всех сторон. Добавляют в казан кипящий бульон и накрывают его крышкой. Массу тушат до полного загустевания. Рагу нужно выдержать под закрытой крышкой не менее 30 минут.
Для приготовления рагу, мясо нарезают на порционные кусочки и отваривают в слегка подсоленной воде около 30 минут. В глубокий казан наливают растительное масло и обжаривают морковь, картофель, лук, рубленый чеснок и другие овощи до готовности. Говядину вынимают с бульона и отправляют к овощам, обжаривают около 5 минут со всех сторон. Добавляют в казан кипящий бульон и накрывают его крышкой. Массу тушат до полного загустевания. Рагу нужно выдержать под закрытой крышкой не менее 30 минут. Приготовление ежиков из говядины начинается с подготовки качественного мясного фарша. Подходит шейная часть и вырезка. Мясо нужно предварительно обрабатывают и зачищают. При помощи мясорубки с любой мощностью готовят фарш. Отваривают круглозернистый рис и обжаривают тертую на мелкой терке морковь на любом растительном масле. Все компоненты соединяют, добавляют соль по вкусу.
Приготовление ежиков из говядины начинается с подготовки качественного мясного фарша. Подходит шейная часть и вырезка. Мясо нужно предварительно обрабатывают и зачищают. При помощи мясорубки с любой мощностью готовят фарш. Отваривают круглозернистый рис и обжаривают тертую на мелкой терке морковь на любом растительном масле. Все компоненты соединяют, добавляют соль по вкусу. Говядина полезна в тушеном виде и ее просто приготовить. Для этого в казан выкладывают мелкорубленую мякоть, слегка обжаривают на небольшом огне и добавляют любимые овощи. Можно использовать морковь, лук, зелень. После добавления овощей массу тушат около 15 минут на среднем огне постоянно помешивая. После готовности овощей, состав заливают водой, накрывают крышкой и тушат около часа.
Говядина полезна в тушеном виде и ее просто приготовить. Для этого в казан выкладывают мелкорубленую мякоть, слегка обжаривают на небольшом огне и добавляют любимые овощи. Можно использовать морковь, лук, зелень. После добавления овощей массу тушат около 15 минут на среднем огне постоянно помешивая. После готовности овощей, состав заливают водой, накрывают крышкой и тушат около часа.
 Для кормящей матери говядину отваривают, готовят бульоны или супы на мясе.
Для кормящей матери говядину отваривают, готовят бульоны или супы на мясе. витамины группы В (1, 2, 4, 5, 6, 9, 12) – влияют на работоспособность нервной системы, участвуют в формировании тканей организма, влияют на перистальтику кишечника, выводят токсины;
витамины группы В (1, 2, 4, 5, 6, 9, 12) – влияют на работоспособность нервной системы, участвуют в формировании тканей организма, влияют на перистальтику кишечника, выводят токсины; Первое на что стоит обратить внимание это цвет и запах мяса. Запах должен быть приятным, без примесей , а цвет яркий красный или бордовый. Более темные оттенки говорят о старости животного.
Первое на что стоит обратить внимание это цвет и запах мяса. Запах должен быть приятным, без примесей , а цвет яркий красный или бордовый. Более темные оттенки говорят о старости животного. Новый продукт вводится в меню кормящей постепенно, обязательно наблюдается реакция малыша – чтобы не было высыпаний, вздутия, нарушения стула. После родов через три-четыре дня можно пить около 200 грамм бульона, но первая порция не больше 50 грамм.
Новый продукт вводится в меню кормящей постепенно, обязательно наблюдается реакция малыша – чтобы не было высыпаний, вздутия, нарушения стула. После родов через три-четыре дня можно пить около 200 грамм бульона, но первая порция не больше 50 грамм.



 [1], [2], [3], [4], [5]
[1], [2], [3], [4], [5]










 Вместе с тем африканские страны хотят быть независимыми, иметь свой голос на мировой арене. Экономисты говорят о том, что юг беден, потому что так сложилось исторически. Так же к причинам экономической отсталости относят ошибки политических лидеров этих стран, неблагоприятный климат и сохранение традиционной, многоукладной экономики. Малоразвитые и бедные страны принято называть «странами третьего мира».
Вместе с тем африканские страны хотят быть независимыми, иметь свой голос на мировой арене. Экономисты говорят о том, что юг беден, потому что так сложилось исторически. Так же к причинам экономической отсталости относят ошибки политических лидеров этих стран, неблагоприятный климат и сохранение традиционной, многоукладной экономики. Малоразвитые и бедные страны принято называть «странами третьего мира».  Все это отражается как на их политике, так и на экономике. Второй серьезной проблемой является распространение новых и, уже казалось бы, побежденных инфекций: лихорадка Эбола, сонная болезнь, ВИЧ, коронавирус MERS и т.д. Все это вызывает беспокойство и заставляет искать пути решения.
Все это отражается как на их политике, так и на экономике. Второй серьезной проблемой является распространение новых и, уже казалось бы, побежденных инфекций: лихорадка Эбола, сонная болезнь, ВИЧ, коронавирус MERS и т.д. Все это вызывает беспокойство и заставляет искать пути решения.  Ежегодно туда доставляется гуманитарная помощь, проводятся акции поддержки. Не остаются в стороне мировая общественность и известные личности. Известная голливудская актриса Анджелина Джоли известна не только яркими киноролями, но и своей активной деятельностью в рамках гуманитарных миссий. Также актриса усыновила троих детей — из Камбоджи, Эфиопии и Вьетнама. В среде селебрити активными участниками помощи Югу являются Жизель Бундхен, Дэвид Бекхэм, Рикки Мартин, Шакира и другие знаменитости.
Ежегодно туда доставляется гуманитарная помощь, проводятся акции поддержки. Не остаются в стороне мировая общественность и известные личности. Известная голливудская актриса Анджелина Джоли известна не только яркими киноролями, но и своей активной деятельностью в рамках гуманитарных миссий. Также актриса усыновила троих детей — из Камбоджи, Эфиопии и Вьетнама. В среде селебрити активными участниками помощи Югу являются Жизель Бундхен, Дэвид Бекхэм, Рикки Мартин, Шакира и другие знаменитости. Л. ЕМЕЛЬЯНОВА магистрант кафедры глобальных социальных процессов и работы с молодежью факультета глобальных процессов МГУ имени М.В. Ломоносова*
Л. ЕМЕЛЬЯНОВА магистрант кафедры глобальных социальных процессов и работы с молодежью факультета глобальных процессов МГУ имени М.В. Ломоносова* Они оказывают влияние на политическую и экономическую составляющую, а также на социальную стабильность и экологическую ситуацию всех стран мира1.
Они оказывают влияние на политическую и экономическую составляющую, а также на социальную стабильность и экологическую ситуацию всех стран мира1. Однако в современной науке достаточно часто фигурирует термин «проблема «Север-Юг», который вводит в заблуждение относительно подхода к рассматриваемому вопросу.
Однако в современной науке достаточно часто фигурирует термин «проблема «Север-Юг», который вводит в заблуждение относительно подхода к рассматриваемому вопросу.
 ХХ в. происходит становление транснациональных корпораций обусловленное либерализацией
ХХ в. происходит становление транснациональных корпораций обусловленное либерализацией Однако правительства стран «Севера», в которых расположены головные компании ТНК и чья экономика напрямую зависит от их деятельности, поддерживают ТНК, страхуя прямые зарубежные инвестиции, предоставляя определенные государственные гарантии, защищая инвестиции ТНК за рубежом, создавая институты международного арбитража в инвестиционной сфере и выгодные инвестиционные условия. Для стран «Севера» ТНК -это инструмент их мягкой силы, навязывания демократических ценностей, политических взглядов, которым они
Однако правительства стран «Севера», в которых расположены головные компании ТНК и чья экономика напрямую зависит от их деятельности, поддерживают ТНК, страхуя прямые зарубежные инвестиции, предоставляя определенные государственные гарантии, защищая инвестиции ТНК за рубежом, создавая институты международного арбитража в инвестиционной сфере и выгодные инвестиционные условия. Для стран «Севера» ТНК -это инструмент их мягкой силы, навязывания демократических ценностей, политических взглядов, которым они В. Экономическое сознание общества и массовая коммуникация // Экономика и предпринимательство, 2015, № 9-2, с. 159-163.
В. Экономическое сознание общества и массовая коммуникация // Экономика и предпринимательство, 2015, № 9-2, с. 159-163. Основным итогом такой деятельности помимо непоправимого ущерба окружающей среде является ухудшение условий труда в странах третьего мира. Рабочие не имеют гарантий занятости, а также преимуществ при различных схемах трудоустройства. Работники получают заработную плату ниже установленного минимума, не могут образовывать профсоюзы, так как они запрещены на законодательном уровне с целью привлечения ТНК, и не получают льгот, предусмотренных законом. ТНК используют слабую государственную экономику и избыток дешевой рабочей силы, готовой взять на себя любой труд и принять устаревшие производственные мощности для своего собственного развития2.
Основным итогом такой деятельности помимо непоправимого ущерба окружающей среде является ухудшение условий труда в странах третьего мира. Рабочие не имеют гарантий занятости, а также преимуществ при различных схемах трудоустройства. Работники получают заработную плату ниже установленного минимума, не могут образовывать профсоюзы, так как они запрещены на законодательном уровне с целью привлечения ТНК, и не получают льгот, предусмотренных законом. ТНК используют слабую государственную экономику и избыток дешевой рабочей силы, готовой взять на себя любой труд и принять устаревшие производственные мощности для своего собственного развития2. В конечном итоге становится заметна разница между интересами верхушек стран «Севера» и «Юга» и интересами их населения3. Таким образом, деятельность ТНК оказывает значительное влияние на уровень развития стран «Юга», усиливая социальную, экономическую, политическую нестабильность
В конечном итоге становится заметна разница между интересами верхушек стран «Севера» и «Юга» и интересами их населения3. Таким образом, деятельность ТНК оказывает значительное влияние на уровень развития стран «Юга», усиливая социальную, экономическую, политическую нестабильность
 е. глобальные проблемы должны затрагивать интересы всего человечества;
е. глобальные проблемы должны затрагивать интересы всего человечества; Р., Ильин И.В., Иванов А.В. Введение в палеоглобалистику: Учеб. пособие. М., 2011, с. 30.
Р., Ильин И.В., Иванов А.В. Введение в палеоглобалистику: Учеб. пособие. М., 2011, с. 30. Страны «Юга» нуждаются в финансировании со стороны международных организаций и других государств, так как все без исключения заинтересованы в улучшении экономики, стабилизации социального фактора и восстановлении политической стабильности в странах «Юга», что соответствует третьему критерию глобальности, которому процесс «Север-Юг» отвечает в полной мере. Всему мировому сообществу необходимо приложить все возможные усилия для решения этой проблемы.
Страны «Юга» нуждаются в финансировании со стороны международных организаций и других государств, так как все без исключения заинтересованы в улучшении экономики, стабилизации социального фактора и восстановлении политической стабильности в странах «Юга», что соответствует третьему критерию глобальности, которому процесс «Север-Юг» отвечает в полной мере. Всему мировому сообществу необходимо приложить все возможные усилия для решения этой проблемы.


 Различные значения темпов экономического роста приводят к увеличению разрыва между богатыми и бедными странами.
Различные значения темпов экономического роста приводят к увеличению разрыва между богатыми и бедными странами.









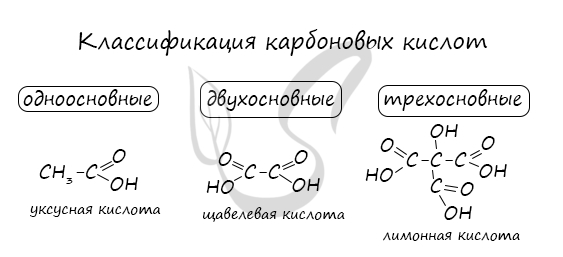


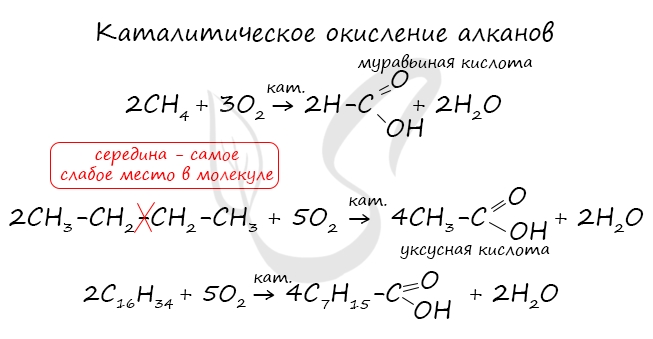
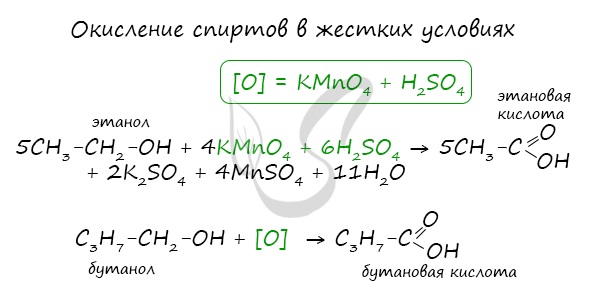





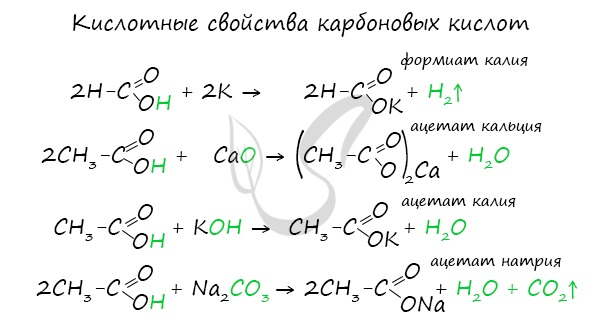


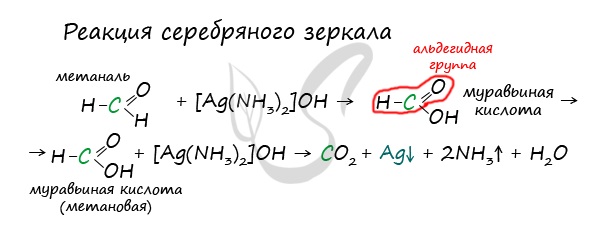


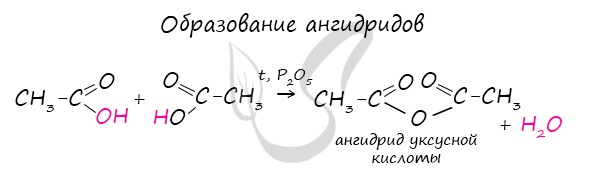

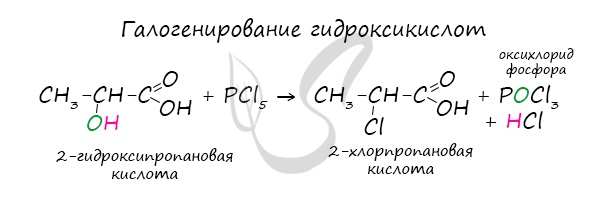
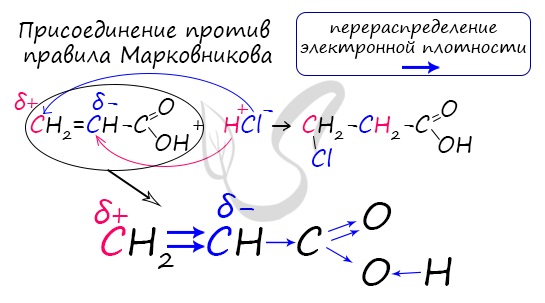
 неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
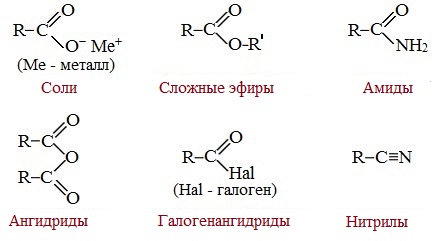






























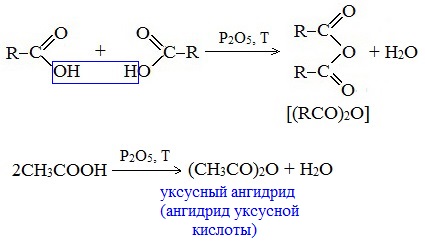



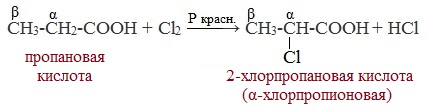

 При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:

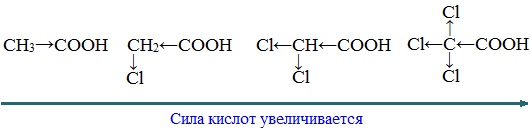


 Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.