Как звучит теорема фалеса: Урок 5. теорема фалеса — Геометрия — 8 класс
Урок 5. теорема фалеса — Геометрия — 8 класс
Возьмем лист бумаги с параллельными краями, отложим не нем произвольный отрезок AB и проведем прямые, перпендикулярные AB. Согнем лист по этим перпендикулярам, повторим сгибы несколько раз и раскроем лист. Измерим отрезки А1В1, В1С1, С1Д1, Д1E1.
Повторим такие же действия с листом бумаги, у которого края не параллельны. Измерим отрезки А1В1, В1С1, С1Д1, Д1E1.
И в первом и во втором случае отрезки А1В1, В1С1, С1Д1, Д1E1 равны. Их равенство доказывается теоремой, которую нызывают по имени греческого математика Фалеса Милетского.
Формулировка теоремы Фалеса:
Если на одной из двух прямых отложить последовательно несколько равных отрезков и через их концы провести параллельные прямые, пересекающие вторую прямую, то они отсекут на второй прямой равные между собой отрезки. В теореме нет ограничений на взаимное расположение секущих (она верна как для пересекающихся прямых, так и для параллельных).
Дано: А1А2 = А2А3
c || d || e
Доказать: В1В2 = B2В3
Доказательство:
А) пусть a || b
А1А2 = В1В2
А2А3 = B2В3
Как противоположные стороны параллелограммов. По условию А1А2 = А2А3, следовательно В1В2 = B2В3
Б) пусть a ≠ b
Проведем прямую k, параллельную прямой a, она пересечет прямую с в точке F, прямую d в точке В2, прямую e в точке Е.
A1FB2A2 – параллелограмм, значит А1А2 = FB2
Аналогично доказывается, что А2А3 = B2E, по условию А1А2 = А2А3, значит FB2 = B2E. Треугольники B1FB2 и B2B3E равны по стороне и двум углам.
Следовательно, В1В2 = B2В3
В общем виде теорема Фалеса формулируется так: если на одной из двух прямых отложить последовательно несколько отрезков и через их концы провести параллельные прямые, пересекающие вторую прямую, то они отсекут на второй прямой пропорциональные отрезки.
Есть и более короткая формулировка: параллельные прямые отсекают на секущих пропорциональные отрезки.
Доказанная выше теорема является частным случаем общей теоремы Фалеса, так как равные отрезки пропорциональны с коэффициентом, равным единице.
Для теоремы Фалеса верно обратное утверждение:
Если прямые, пересекающие две другие прямые (параллельные или нет), отсекают на обеих из них равные (или пропорциональные) отрезки, начиная от вершины, то такие прямые параллельны.
В этой теореме важно, что равные отрезки начинаются от вершины.
С помощью теоремы Фалеса можно разделить данный отрезок на n равных частей.
Пусть дан отрезок AB длиной 8 см. Требуется разделить его на 7 равных частей.
Решение:
Проведем луч с началом в точке А, отличный от отрезка АВ, и отложим на нем с помощью циркуля последовательно семь равных отрезков, начиная от точки А.
Конец последнего отрезка соединим с точкой B и проведем параллельные прямые через каждую из точек до пересечения с отрезком АВ.
Отрезок АВ разделится на 7 частей, они равны между собой по теореме Фалеса.
Фалес Милетский – родился приблизительно в 625 г. умер в середине VI в. до н.э. – родоначальник европейской науки и философии математик, астроном и политический деятель. Фалес происходил из знатного финикийского рода, был современником Солона и Креза, среди сограждан пользовался большим уважением.
В геометрии Фалесу приписывают открытие и доказательство ряда теорем: о делении круга диаметром пополам, о равенстве углов при основании равнобедренного треугольника, о равенстве вертикальных углов, один из признаков равенства прямоугольных треугольников и другие.
Фалес впервые ввел в науку, и в частности в математику, доказательство.
Теорема Фалеса используется не только в геометрии, но и в морской навигации. Она выступает в качестве правила о том, что столкновение судов, двигающихся с постоянной скоростью, неизбежно, если сохраняется курс судов друг на друга.
Обобщённая теорема Фалеса
Основные понятия
Прежде чем сформулировать теорему Фалеса и доказать её, напомним несколько ключевых определений геометрии:
- четырёхугольник;
- параллелограмм;
- трапеция.{\circ}$. Можно убедиться, что сумма всех углов данной трапеции действительно равна $360$.
Владея ключевыми понятиями, можем перейти к теореме Фалеса и её доказательству.
Теорема Фалеса
Теорема названа в честь древнегреческого ученого Фалеса Милетского. Звучит она следующим образом:
Теорема 1
Если последовательно отложить на прямой несколько равных друг другу отрезков и провести через их концы параллельные прямые, которые пересекают вторую проведённую прямую, то эти параллельные прямые отсекут на ней также равные отрезки.
Доказательство теоремы Фалеса
Докажем эту теорему.
Рассмотрим рисунок:
Рисунок 3. Доказательство теоремы Фалеса. Автор24 — интернет-биржа студенческих работ
На прямой $a$ отложены следующие отрезки: $A_1 A_2, A_2 A_3, A_3 A_4,…$. Через эти отрезки проведены несколько параллельных прямых, пересекающих прямую $b$ в соответствующих точках $B_1,B_2,B_3,B_4,…$. Докажем, что отрезки $B_1 B_2, B_2 B_3, B_3 B_4,…$ равны между собой. Для начала упростим задачу и докажем следующее: $B_1 B_2 = B_2 B_3$.
На рисунке прямые $a$ и $b$ параллельны. Следовательно, $A_1 B_1 B_2 A_2$ и $A_2 B_2 B_3 A_3$ — параллелограммы. Это означает, что противоположные стороны параллелограммов равны, следовательно, $A_1 A_2 = B_1 B_2, A_2 A_3 = B_2 B_3$. И из $A_1 A_2=A_2 A_3$ следует, что $B_1 B_2= B_2 B_3$.
Есть и другой случай, когда прямые $a$ и $b$ не параллельны:
Рисунок 4. Доказательство теоремы Фалеса. Автор24 — интернет-биржа студенческих работ
Проведём такую прямую $c$, которая параллельна $a$:
Рисунок 5. Доказательство теоремы Фалеса. Автор24 — интернет-биржа студенческих работ
Прямая $c$ пересекает $A_2 B_2$ и $A_3 B_3$ соответственно в т. $C_1, C_2$. Так как $A_1 A_2=A_2 A_3$, то, по аналогии в предыдущем случае, $B_1 C_1 = C_1 C_2$.
Рассмотрим $\triangle C_2 B_1 B_3$. $C_1$ — середина $B_1 C_2$. $B_2 C_1$ параллельна $B_3 C_2$.
Проведём через точку $B_3$ такую прямую, которая параллельна $B_1 C_2$.
Рисунок 6. Доказательство теоремы Фалеса. Автор24 — интернет-биржа студенческих работ
Точкой $D$ обозначено пересечение $B_2 C_1$ с проведённой прямой. Получаем параллелограмм $C_1 C_2 B_3 D$. Так как $C_1$ — середина $B_1 C_2$, а $C_1 C_2= B_3 D$ (как противоположные стороны параллелограмма), следовательно, $C_1 B_1 = B_3 D$.
Рассмотрим $\triangle C_1 B_1 B_2$ и $\triangle B_2 B_3 D$ Они равны согласно второму признаку равенства треугольников. То есть так как выполняются равенства $C_1 B_1 = B_3 D$, $\angle C_1 B_1 B_2 = \angle B_2 B_3 D$ и $\angle B_1 C_1 B_2=\angle B_2 D B_3$ (как лежащие накрест углы при пересечении параллельных прямых $B_1 C_2$ и $B_3 D$ секущими $B_1 B_3$ и $C_1 D$).
Следовательно, $B_1 B_2= B_2 B_3$.
Аналогично доказывается равенство $B_2 B_3=B_3 B_4$ и другие.
Таким образом, в данной статье мы полностью разобрали теорему Фалеса, произвели подробное её доказательство, фигурируя известными понятиями.
Лестницы. Входная группа. Материалы. Двери. Замки. Дизайн
Как звучит теорема фалеса. Фалес Милетский, или о том, как важно знать подобие треугольников и теорему Фалеса
называется пропорцией . При этом говорят, что:
x 1 относится к x 2 как y 1 относится к y 2 ,
отношение чисел x 1 и x 2 равно отношению чисел y 1 и y 2 ,
числа x 1 и x 2 соотносятся так же, как числа y 1 и y 2 ,
или, наконец,
числа x 1 и y 1 (!) пропорциональны числам x 2 и y 2 (то есть числители пропорциональны знаменателям).
Входящие сюда числа x 1 , x 2 , y 1 и y 2 называются членами пропорции. Обычно все они положительны, но это необязательно. Предполагается, однако, что ни одно из них не равно нулю. Особого названия это равенство удостоилось по той причине, что оно часто встречается при решении разных математических задач.
Пропорции можно преобразовывать, перенося члены «с верху» одной части равенства «в низ» другой части равенства и наоборот. Эту процедуру легко обосновать следующим образом. Допустим мы хотим перенести x 1 из левой части в правую. Для этого умножим обе части пропорции на 1/x 1:
то есть переменная x 1 у нас переместилась «по диагонали сверху вниз». Перенесем теперь «влево наверх» переменную y 2 . Это достигается умножением на нее обеих частей данного равенства. В результате имеем
числители x 1 и y 1 соотносятся между собой точно так же, как и соответствующие им знаменатели x 2 и y 2 .
Обобщенная теорема Фалеса
Теорема Фалеса, рассмотренная в прошлый раз, допускает следующее обобщение.
Пусть две произвольные прямые x и y пересекаются тремя параллельными прямыми n 1 , n 2 и n 3 в точках X 1 , X 2 , X 3 и Y 1 , Y 2 , Y 3 , как показано на рисунке:
Тогда длины отсекаемых отрезков образуют следующую пропорцию
представляет собой рациональное число, то есть может быть выражено в виде несократимой дроби
где a и b — некоторые натуральные числа, a b . Разобьем отрезок X 1 X 3 на b одинаковых частей. (При этом точка X 2 окажется одной из точек деления.) Проведем через каждую точку деления прямые, параллельные n 1 , n 2 и n 3 . (Одна из этих прямых совпадет с прямой n 2 .)
По теореме Фалеса (в ее первоначальном варианте), отрезок Y 1 Y 3 также делится этими прямыми на b равных частей, из которых a частей составляют отрезок Y 1 Y 2 . Следовательно,
|Y 1 Y 2 |
|X 1 X 2 |
|Y 1 Y 3 |
b
|X 1 X 3 |
что и требовалось доказать. Из нашего построения следует также, что
|Y 2 Y 3 |
|X 2 X 3 |
|Y 1 Y 3 |
b
|X 1 X 3 |
|Y 2 Y 3 |
|X 2 X 3 |
|Y 1 Y 2 |
a
|X 1 X 2 |
Пользуясь свойствами пропорций, эти равенства можно переписать в виде одной цепочки:
|Y 1 Y 2 |
|Y 2 Y 3 |
|Y 1 Y 3 |
|X 1 X 2 |
|X 2 X 3 |
|X 1 X 3 |
Таким образом, отрезки отсекаемые на прямой y пропорциональны соответствующим отрезкам на прямой x .
Теоретически возможна также ситуация, когда отношение длин
не является рациональным числом, поскольку длины отрезков |X 1 X 2 | и |X 1 X 3 | могут, в принципе, выражаться иррациональными числами. Однако на практике такой случай никогда не встречается. Для определения длин отрезков мы всегда пользуемся каким-либо измерительным прибором (например, школьной линейкой), который выдает лишь округленные результаты в виде конечной десятичной дроби.
Важное следствие
Пусть даны несовпадающие прямые x и y , которые пересекаются в точке O, и еще — две параллельные прямые n 1 и n 2 , которые пересекают прямую x в точках X 1 и X 2 и прямую y в точках Y 1 и Y 2 , как показано на рисунке.
Введем обозначения:
x 1 = |OX 1 |, x 2 = |OX 2 |;
y 1 = |OY 1 |, y 2 = |OY 2 |;
z 1 = |X 1 Y 1 |, z 2 = |X 2 Y 2 |.
Действительно, оба равенства в этой цепочке непосредственно следует из обобщенной теоремы Фалеса. Для первого равенства это ясно сразу, а для второго это становится очевидным после того, как мы через точку Y 1 проведем прямую m , параллельную прямой x .
Верно и обратное утверждение. Пусть дана та же геометрическая конструкция и известно, что
Тогда прямые n 1 и n 2 параллельны. В самом деле, проведем через точку X 1 вспомогательную прямую, параллельную прямой n 2 . По обобщенной теореме Фалеса, эта вспомогательная прямая проходит через точку Y 1 . Следовательно, она совпадает с прямой n 1 . Таким образом, прямая n 1 параллельна прямой n 2 .
Масштаб
Выйдем на улицу, прихватив с собой лист бумаги и карандаш. Расположим наш лист горизонтально и поставим на нем приблизительно посередине точку O. Из этой точки проведем мысленно лучи в направлении различных примечательных точек на местности, расположенных в радиусе примерно ста метров, — деревьев, столбов, углов зданий и того подобного.
Допустим, у нас есть возможность измерить расстояния до этих примечательных точек. Пусть, например, расстояние до ближайшего дерева равно 10 м. Мысленно отложим от точки O в направлении этого дерева отрезок, длина которого в 1000 раз меньше данного расстояния, и отметим карандашом на бумаге положение второго его конца. Нетрудно рассчитать, что расстояние от точки O до отметки составит 10 м/1000 = 1 см.
Подобным же образом, пусть расстояние до какого-то другого примечательного объекта равно x 1 . Умножим это расстояние на число k , равное 1/1000. Мысленно отложим от точки O отрезок длиной x 2 = kx 1 вдоль луча, направленного на данный объект. В том месте на бумаге, где находится второй конец отрезка, сделаем отметку карандашом. Проделаем такую процедуру со всеми примечательными точками на местности, используя всё время одно и то же значение параметра k . Если какие-либо из этих точек соединены между собой забором или стеной или же чем-то подобным, то между соответствующими метками на бумаге также проведем линии.
В результате на нашем листе бумаги получится карта местности. В силу теоремы Фалеса и свойств пропорций, все соотношения между расстояниями на бумаге будут в точности такими же, как и в действительности. Более того, все линии на бумаге окажутся параллельны соответствующим линиям на местности. Эта параллельность, конечно, нарушится, когда мы унесем наш лист куда-нибудь в другое место, однако углы между линиями сохранятся.
Параметр k , который мы использовали в нашем построении, называется масштабным коэффициентом или просто масштабом . Разумеется, он необязательно должен быть равен 1/1000. Он может, в принципе, принимать любое значение, важно лишь, чтобы это значение оставалось всё время неизменным в процессе построения карты.
На настоящих географических картах масштаб обязательно указывается в легенде, при этом вместо дробной черты обычно используется двоеточие. Например, масштаб 1:100 000 означает, что один сантиметр на карте соответствует 100000 сантиметрам (то есть одному километру) на местности.
Технические чертежи также всегда выполняются, как говорят, в определенном масштабе. Масштаб 1:1 означает, что деталь начерчена в натуральную величину. А масштаб 10:1 говорит о том, что чертеж выполнен с десятикратным увеличением.
Замечание о параллельных прямых
Мы назвали параллельными такие несовпадающие прямые, угол между которыми равен нулю. Мы отметили, что такие прямые нигде не пересекаются. Докажем теперь, что если прямые лежат в одной плоскости и не параллельны (то есть угол между ними отличен от нуля), то тогда они обязательно где-нибудь пересекутся.
Пусть на плоскости даны две прямые — x и n . Отметим на них произвольные точки — O и Y — и проведем через эти точки третью прямую — y . Если исходить из того, что угол между прямыми x и n не равен нулю, то смежные углы должны оказаться не равны друг другу. Пусть для определенности α 1 > α 2 , как показано на рисунке.
Проведем через точку O прямую n 1 , параллельную прямой n . Отметим на ней со стороны угла α 1 произвольную точку N 1 и проведем через эту точку прямую y 1 , параллельную прямой y . При этом образуется параллелограмм, обозначенный на рисунке серым фоном.
Это значит, что прямая y 1 пересекает прямую n в некоторой точке, которую мы обозначим через N . Прямая x , заходя на «территорию» параллелограмма в точке O , обязательно должна где-то оттуда выйти. Она может это сделать либо через отрезок YN , либо через отрезок N 1 N . В первом случае сразу становится очевидно, что прямая x пересекает прямую n . Рассмотрим второй случай. Обозначим точку пересечения прямой x и отрезка N 1 N через X 1 . Проведем через нее прямую n 2 , параллельную прямой n . Эта прямая разбивает параллелограмм ON 1 NY на два новых параллелограмма и пересекает прямую y в некоторой точке Y 1 . Отметим на прямой x такую точку X , для которой выполняется соотношение
Проведем через точки X и Y прямую. Согласно рассмотренному выше следствию из теоремы Фалеса, эта прямая параллельна прямой n 2 , а значит, образует нулевой угол с прямой n . Следовательно, новая прямая совпадает с прямой n , которая, таким образом, пересекает прямую x в точке X .
Мы теперь можем утверждать, что следующие три утверждения о несовпадающих прямых a и b , лежащих в одной плоскости, означают в точности одно и то же:
(1) Угол между прямыми a и b равен нулю.
(2) Прямые a и b нигде не пересекаются.
(3) Прямые a и b параллельны.
В традиционных курсах геометрии определением параллельности прямых служит утверждение 2. Мы выбрали для этих целей утверждение 1. Ведь гораздо проще определить угол между двумя прямыми, чем удостовериться, что они нигде не пересекаются на всём своем бесконечном протяжении.
Конспект
1. Равенство вида x 1 /x 2 = y 1 /y 2 называется пропорцией. Числители пропорциональны знаменателям. Числитель и знаменатель одной дроби соотносятся так же, как числитель и знаменатель другой дроби. Эквивалентное равенство: x 1 /y 1 = x 2 /y 2 .
2. Обобщенная теорема Фалеса . Пусть две произвольные прямые a и b пересекаются тремя параллельными прямыми. Тогда отрезки, отсекаемые на прямой a , пропорциональны соответствующим отрезкам, отсекаемым на прямой b .
3. Следствие 1 . Пусть стороны угла с вершиной в точке O пересекаются двумя параллельными прямыми n 1 и n 2 . Тогда отрезки, отсекаемые на прямых n 1 и n 2 , соотносятся так же, как отрезки, отложенные на любой из сторон угла от точки O до соответствующих точек пересечения с прямыми n 1 и n 2 .
4. Следствие 2 . Пусть на сторонах угла отложены от вершины отрезки таким образом, что отрезки на одной стороне пропорциональны отрезкам на другой. Тогда прямые, проходящие через соответствующие концы этих отрезков, параллельны друг другу.
5. На карте сохраняются все соотношения между расстояниями и все углы. Отношение расстояния между некоторыми двумя точками на карте к расстоянию между соответствующими точками на местности не зависит от выбора точек и называется масштабом.
6. Если угол между двумя прямыми, лежащими в одной плоскости, не равен нулю, то такие прямые обязательно пересекаются.
Теорема планиметрии о параллельных и секущих.
Вне русскоязычной литературы теоремой Фалеса иногда называют другую теорему планиметрии, а именно, утверждение о том , что вписанный угол , опирающийся на диаметр окружности , является прямым. Открытие этой теоремы действительно приписывается Фалесу, о чём есть свидетельство Прокла .
Формулировки [ | ]
Если на одной из двух прямых отложить последовательно несколько равных отрезков и через их концы провести параллельные прямые, пересекающие вторую прямую, то они отсекут на второй прямой равные отрезки.
Более общая формулировка, также называемая теорема о пропорциональных отрезках
Параллельные прямые отсекают на секущих пропорциональные отрезки :
A 1 A 2 B 1 B 2 = A 2 A 3 B 2 B 3 = A 1 A 3 B 1 B 3 . {\displaystyle {\frac {A_{1}A_{2}}{B_{1}B_{2}}}={\frac {A_{2}A_{3}}{B_{2}B_{3}}}={\frac {A_{1}A_{3}}{B_{1}B_{3}}}.}Замечания [ | ]
- Теорема Фалеса является частным случаем теоремы о пропорциональных отрезках, поскольку равные отрезки можно считать пропорциональными отрезками с коэффициентом пропорциональности, равным 1.
Доказательство в случае секущих
Рассмотрим вариант с несвязанными парами отрезков: пусть угол пересекают прямые A A 1 | | B B 1 | | C C 1 | | D D 1 {\displaystyle AA_{1}||BB_{1}||CC_{1}||DD_{1}} и при этом A B = C D {\displaystyle AB=CD} .
Доказательство в случае параллельных прямых
Проведем прямую BC . Углы ABC и BCD равны как внутренние накрест лежащие при параллельных прямых AB и CD и секущей BC , а углы ACB и CBD равны как внутренние накрест лежащие при параллельных прямых AC и BD и секущей BC . Тогда по второму признаку равенства треугольников треугольники ABC и DCB равны. Отсюда следует, что AC = BD и AB = CD . ■
Вариации и обобщения [ | ]
Обратная теорема [ | ]
Если в теореме Фалеса равные отрезки начинаются от вершины (часто в школьной литературе используется такая формулировка), то обратная теорема также окажется верной. Для пересекающихся секущих она формулируется так:
В обратной теореме Фалеса важно, что равные отрезки начинаются от вершины
Таким образом (см. рис.) из того, что C B 1 C A 1 = B 1 B 2 A 1 A 2 = … {\displaystyle {\frac {CB_{1}}{CA_{1}}}={\frac {B_{1}B_{2}}{A_{1}A_{2}}}=\ldots } , следует, что A 1 B 1 | | A 2 B 2 | | … {\displaystyle A_{1}B_{1}||A_{2}B_{2}||\ldots } .
Если секущие параллельны, то необходимо требовать равенство отрезков на обеих секущих между собой, иначе данное утверждение становится неверным (контрпример — трапеция, пересекаемая линией, проходящей через середины оснований).
Этой теоремой пользуются в навигации: столкновение судов, двигающихся с постоянной скоростью, неизбежно, если сохраняется направление с одного судна на другое.
Лемма Соллертинского [ | ]
Следующее утверждение, двойственно к лемме Соллертинского :
Пусть f {\displaystyle f} — проективное соответствие между точками прямой l {\displaystyle l} и прямой m {\displaystyle m} . Тогда множество прямых будет множеством касательных к некоторому коническому сечению (возможно, вырожденному).
В случае теоремы Фалеса коникой будет бесконечно удалённая точка, соответствующая направлению параллельных прямых.
Это утверждение, в свою очередь, является предельным случаем следующего утверждения:
Пусть f {\displaystyle f} — проективное преобразование коники. Тогда огибающей множества прямых X f (X) {\displaystyle Xf(X)} будет коника (возможно, вырожденная).
| ]Эта гробница мала, но слава над ней необъятна.
В ней перед тобою сокрыт многоразумный Фалес.Надпись на гробнице Фалеса Милетского
Представьте себе такую картину. 600 г. до н.э. Египет. Перед вами огромнейшая египетская пирамида. Чтобы удивить фараона и остаться у него в фаворитах вам нужно измерить высоту этой пирамиды. В распоряжении у вас… ничего. Можно пасть в отчаяние, а можно поступить, как Фалес Милетский : использовать теорему подобия треугольников. Да, оказывается, все достаточно просто. Фалес Милетский подождал пока длина его тени и его рост совпадут, а затем с помощью теоремы о подобии треугольников нашел длину тени пирамиды, которая соответственно, была равна тени, отбрасываемой пирамидой.
Кто же такой этот Фалес Милетский ? Человек, который обрел славу одного из «семи мудрецов» древности? Фалес Милетский – древнегреческий философ, который отличился успехами в области астрономии, а также математики и физики. Годы его жизни были установлены только приблизительно: 625-645 гг до н.э.
Среди доказательств знания Фалесом астрономии можно привести следующий пример. 28 мая 585 г до н.э. предсказание Милетским солнечного затмения помогло прекратить длившуюся уже 6 лет войну между Лидией и Мидией. Это явление настолько испугало мидян, что они согласились на невыгодные для себя условия заключения мира с лидийцами.
Довольно широко известна легенда, которая характеризует Фалеса как находчивого человека. Фалесу часто приходилось слышать нелестные отзывы о его бедности. Однажды он решил доказать то, что и философы могут при желании жить в достатке. Еще зимой Фалес по наблюдению за звездами определил, что летом будет хороший урожай маслин. Тогда же он нанял маслодавильни в Милете и на Хиосе. Это обошлось ему довольно дешево, так как зимой спрос на них практически отсутствует. Когда же маслины дали богатый урожай, свои маслодавильни Фалес начал сдавать внаем. Собранное большое количество денег таким методом расценивалось как доказательство того, что философы могут зарабатывать своим умом, но их призвание выше таких земных проблем. Эта легенда, кстати, повторялась самим Аристотелем.
Что же касается геометрии, то многое из его «открытий» было позаимствовано у египтян. И все же этот перенос знаний в Грецию считается одной из основных заслуг Фалеса Милетского.
Достижениями Фалеса считаются формулировка и доказательство следующих теорем:
- вертикальные углы равны;
- равными треугольниками признаются те, у которых сторона и два прилегающих угла соответственно равны;
- углы при основании равнобедренного треугольника равны;
- диаметр делит круг пополам;
- вписанный угол, опирающийся на диаметр, является прямым.
Именем Фалеса названа еще одна теорема, которая полезна при решении геометрических задач. Существует ее обобщенный и частный вид, обратная теорема, формулировки также могут немного отличаться в зависимости от источника, но смысл их всех остается одним. Рассмотрим эту теорему.
Если параллельные прямые пересекают стороны угла и отсекают на одной его стороне равные отрезки, то они отсекают равные отрезки и на другой его стороне.
Допустим, точки А 1 , А 2 , А 3 – точки пересечения параллельных прямых с одной из сторон угла, а В 1 , В 2 , В 3 – точки пересечения параллельных прямых с другой стороной угла. Необходимо доказать, что если А 1 А 2 = А 2 А 3 , то и В 1 В 2 = В 2 В 3 .
Через точку В 2 проведем прямую, параллельную прямой А 1 А 2 . Обозначим новую прямую С 1 С 2 . Рассмотрим параллелограммы A 1 C 1 B 2 A 2 и A 2 B 2 C 2 A 3 .
Свойства параллелограмма позволяют нам утверждать, что A1A2 = C 1 B 2 и A 2 A 3 = B 2 C 2 . А так как по нашему условию А 1 А 2 = А 2 А 3 , то и C 1 B 2 = В 2 С 2 .
И, наконец, рассмотрим треугольники Δ C 1 B 2 B 1 и Δ C 2 B 2 B 3 .
C 1 B 2 = B 2 C 2 (доказано выше).
А это значит, что Δ C 1 B 2 B 1 и Δ C 2 B 2 B 3 будут равны по второму признаку равенства треугольников (по стороне и прилегающим углам).
Таким образом, теорема Фалеса доказана.
Использование данной теоремы значительно облегчит и ускорит решение геометрических задач. Успехов в освоении этой занимательной науки математики!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Если параллельные прямые, пересекающие стороны угла, отсекают на одной его стороне равные отрезки, то они отсекают равные отрезки и на другой его стороне.
Доказательство. Пусть А 1 , А 2 , А 3 — точки пересечения параллельных прямых с одной из сторон угла и А 2 лежит между А 1 и А 3 (рис.1).
Пусть B 1 В 2 , В 3 — соответствующие точки пересечения этих прямых с другой стороной угла. Докажем, что если А 1 А 2 = A 2 A 3 , то В 1 В 2 = В 2 В 3 .
Проведем через точку В 2 прямую EF, параллельную прямой А 1 А 3 . По свойству параллелограмма А 1 А 2 = FB 2 , A 2 A 3 = B 2 E .
И так как А 1 А 2 = A 2 A 3 , то FB 2 = В 2 Е.
Треугольники B 2 B 1 F и В 2 В 3 Е равны по второму признаку. У них B 2 F = В 2 Е по доказанному. Углы при вершине В 2 равны как вертикальные, а углы B 2 FB 1 и B 2 EB 3 равны как внутренние накрест лежащие при параллельных А 1 В 1 и A 3 B 3 и секущей EF. Из равенства треугольников следует равенство сторон: В 1 В 2 = В 2 В 3 . Теорема доказана.
С использованием теоремы Фалеса устанавливается следующая теорема.
Теорема 2. Средняя линия треугольника параллельна третьей стороне и равна ее половине.
Средней линией треугольника называется отрезок, соединяющий середины двух его сторон. На рисунке 2 отрезок ED — средняя линия треугольника ABC.
ED — средняя линия треугольника ABC
Пример 1. Разделить данный отрезок на четыре равные части.
Решение. Пусть АВ — данный отрезок (рис.3), который надо разделить на 4 равные части.
Деление отрезка на четыре равные части
Для этого через точку А проведем произвольную полупрямую а и отложим на ней последовательно четыре равных между собой отрезка AC, CD, DE, ЕК.
Соединим точки В и К отрезком. Проведем через оставшиеся точки С, D, Е прямые, параллельные прямой ВК, так, чтобы они пересекли отрезок АВ.
Согласно теореме Фалеса отрезок АВ разделится на четыре равные части.
Пример 2. Диагональ прямоугольника равна а. Чему равен периметр четырехугольника, вершины которого являются серединами сторон прямоугольника?
Решение. Пусть условию задачи отвечает рисунок 4.
Тогда EF — средняя линия треугольника ABC и, значит, по теореме 2. $$ EF = \frac{1}{2}AC = \frac{a}{2} $$
Аналогично $$ HG = \frac{1}{2}AC = \frac{a}{2} , EH = \frac{1}{2}BD = \frac{a}{2} , FG = \frac{1}{2}BD = \frac{a}{2} $$ и, следовательно, периметр четырехугольника EFGH равен 2a.
Пример 3. Стороны треугольника равны 2 см, 3 см и 4 см, а вершины его — середины сторон другого треугольника. Найти периметр большого треугольника.
Решение. Пусть условию задачи отвечает рисунок 5.
Отрезки АВ, ВС, АС — средние линии треугольника DEF. Следовательно, согласно теореме 2 $$ AB = \frac{1}{2}EF\ \ ,\ \ BC = \frac{1}{2}DE\ \ ,\ \ AC = \frac{1}{2}DF $$ или $$ 2 = \frac{1}{2}EF\ \ ,\ \ 3 = \frac{1}{2}DE\ \ ,\ \ 4 = \frac{1}{2}DF $$ откуда $$ EF = 4\ \ ,\ \ DE = 6\ \ ,\ \ DF = 8 $$ и, значит, периметр треугольника DEF равен 18 см.
Пример 4. В прямоугольном треугольнике через середину его гипотенузы проведены прямые, параллельные его катетам. Найти периметр образовавшегося прямоугольника, если катеты треугольника равны 10 см и 8 см.
Решение. В треугольнике ABC (рис.6)
∠ А прямой, АВ = 10 см, АС = 8 см, KD и MD — средние линии треугольника ABC, откуда $$ KD = \frac{1}{2}AC = 4 см. \\ MD = \frac{1}{2}AB = 5 см. $$ Периметр прямоугольника К DMА равен 18 см.
Тема урока
Цели урока
- Познакомиться с новыми определениями и вспомнить некоторые уже изученные.
- Сформулировать и доказать свойства квадрата, доказать его свойства.
- Научиться применять свойства фигур при решении задач.
- Развивающие – развить внимание учащихся, усидчивость, настойчивость, логическое мышление, математическую речь.
- Воспитательные — посредством урока воспитывать внимательное отношение друг к другу, прививать умение слушать товарищей, взаимовыручке, самостоятельность.
Задачи урока
- Проверить умение учащихся решать задачи.
План урока
- Историческая справка.
- Фалес как математик и его труды.
- Полезно вспомнить.
Историческая справка
- Теорема Фалеса до сих пор используется в морской навигации в качестве правила о том, что столкновение судов, двигающихся с постоянной скоростью, неизбежно, если сохраняется курс судов друг на друга.
- Вне русскоязычной литературы теоремой Фалеса иногда называют другую теорему планиметрии, а именно, утверждение о том, что вписанный угол, опирающийся на диаметр окружности, является прямым. Открытие этой теоремы действительно приписывается Фалесу, о чём есть свидетельство Прокла.
- Основы геометрии Фалес постигал в Египте.
Открытия и заслуги ее автора
А известно ли вам, что Фалес Милетский был одним из семи самых известных по тем временам, мудрецом Греции. Он основал Ионийскую школу. Идею, которую продвигал Фалес в этой школе, было единство всего сущего. Мудрец считал, что есть единое начало, от которого произошли все вещи.
Огромной заслугой Фалеса Милетского является создание научной геометрии. Этот великий учений сумел с египетского искусства измерения создать дедуктивную геометрию, базой которой есть общие основания.
Кроме огромных познаний в геометрии, Фалес еще и неплохо разбирался в астрономии. Эму первому удалось предсказать полное затмение Солнца. А ведь это происходило не в современном мире, а в далеком 585 году, еще до нашей эры.
Фалес Милетский был тем человеком, который сообразил, что север можно точно определить по созвездию Малой Медведицы. Но и это не было его последним открытием, так как он сумел в точности определить продолжительность года, разбить его на триста шестьдесят пять дней, а также установил время равноденствий.
Фалес на самом деле был всесторонне развитым и мудрым человеком. Кроме того, что он славился как прекрасный математик, физик, астроном, он еще и как настоящий метеоролог, смог довольно точно предсказать урожай оливок.
Но самое примечательное то, что Фалес никогда не ограничивался в своих познаниях только научно-теоретической областью, а всегда пытался закрепить доказательства своих теорий на практике. И самое интересное, то, что великий мудрец не сосредотачивался на какой-то одной области своих познаний, его интерес имел различные направленности.
Имя Фалеса стало нарицательным для мудреца уже тогда. Его важность и значимость для Греции была так велика, как для России имя Ломоносова. Конечно, его мудрость можно толковать по-разному. Но точно можно сказать, что ему были присущи и изобретательность, и практическая смекалка, и в какой-то степени отрешенность.
Фалес Милетский был отличным математиком, философом, астрономом, любил путешествовать, был купцом и предпринимателем, занимался торговлей, а также был неплохим инженером, дипломатом, провидцем и активно участвовал в политической жизни.
Он даже умудрился с помощью посоха и тени определить высоту пирамиды. А было это так. В один погожий солнечный день Фалес поставил свой посох на границе, где заканчивалась тень от пирамиды. Далее он дождался, когда длинна от тени его посоха сравнялась с его высотой, и замерил длину тени пирамиды. Вот так, казалось бы просто Фалес определил высоту пирамиды и доказал, что длина одной тени имеет отношение к длине другой тени, также, как и высота пирамиды относится к высоте посоха. Чем и поразил самого фараона Амасиса.
Благодаря Фалесу все известные в то время знания были переведены в область научного интереса. Он смог донести результаты до уровня, пригодного для научного потребления, выделив определенный комплекс понятий. И возможно с помощью Фалеса началось последующее развитие античной философии.
Теорема Фалеса играет одну важных ролей в математике. Она была известна не только в Древнем Египте и Вавилоне, но и в других странах и являлась почвой для развития математики. Да и в повседневной жизни, при строительстве зданий, сооружений, дорог и т.д., без теоремы Фалеса не обойтись.
Теорема Фалеса в культуре
Теорема Фалеса прославилась не только в математике, но ее приобщили еще и к культуре. Однажды аргентинская музыкальная группа Les Luthiers (исп.) на суд зрителей представила песню, которую посвятила известной теореме. Участники Les Luthiers в своем видеоклипе специально для этой песни предоставили доказательства для прямой теоремы для пропорциональных отрезков.
Вопросы
- Какие прямые называются параллельными?
- Где практически применяется теорема Фалеса?
- О чем гласит теорема Фалеса?
Список использованных источников
- Энциклопедия для детей. Т.11. Математика/Глав.ред.М.Д.Аксенова.-м.:Аванта+,2001.
- «Единый государственный экзамен 2006. Математика. Учебно-тренировочные материалы для подготовки учащихся/ Рособрнадзор, ИСОП – М.: Интеллект-Центр, 2006»
- Л. С. Атанасян, В. Ф. Бутузов, С. Б. Кадомцев, Э. Г. Позняк, И. И. Юдина «Геометрия, 7 – 9: учебник для общеобразовательных учреждений»
Фалес Милетский — Биография. Происхождение. Семья. Политическая деятельность. Наука и Философия. Память
Фале́с (др.-греч. Θαλῆς ὁ Μιλήσιος, 637/624— 547/558)— древнегреческий философ и математик из Милета в Малой Азии. Традиционно, как античными, так и современными авторами, считается основоположником греческой философии и науки, «отцом философии»
Большинство античных источников, которые описывают Фалеса, отстоят на 500 и более лет от даты его предполагаемой смерти. Наиболее достоверными современные учёные признают сведения о Фалесе в трудах Геродота и Аристотеля, которые жили «всего» через 2—3 столетия после его смерти. В связи с этим вокруг имени Фалеса возникло множество легенд, сведения об «отце философии» и его открытиях зачастую противоречивы. С именем Фалеса связаны многочисленные открытия в астрономии и математике. Главное положение учения Фалеса, что первоосновой всего сущего является вода, по мнению современных мыслителей, в том числе Гегеля и Ницше, делает его «первым философом». В античной традиции неизменно открывал список «семи мудрецов», заложивших основы греческой культуры и государственности.
Основатель первой древнегреческой научно-философской милетской школы, с открытий которой начинается история европейской науки— космогонии и космологии, физики, географии, метеорологии, астрономии, биологии и математики.
Источники
Древние греки связывали с именем полулегендарного учёного и философа Фалеса многочисленные открытия античности. При этом подавляющее большинство источников, которые описывают Фалеса, датированы промежутком от 500 лет после его предполагаемой смерти. В них античные авторы приводили различные истории анекдотического характера, которые всерьёз не рассматриваются историками. Эти фрагменты были собраны немецким историком Германом Дильсом (1848—1922) в монографии «Der Fragmente der Vorsokratiker». Те или детали из жизни и учения Фалеса описывали Геродот (около 484—425 годов дон.э.), Платон (429/427—347 годы дон.э.), Аристотель (384—322 годы дон.э.), Каллимах (310—240 годы дон.э.), Цицерон (106—43 годы дон.э.), Николай Дамасский (ок. 64 года дон.э.— после 4 года), Луций Анней Сенека (ок. 4 года дон.э.— 64), Плиний Старший (22/24—79), Иосиф Флавий (ок. 37— ок. 100), Гераклит Грамматик (I век), Плутарх (46—127), Татиан (112—185), Апулей (ок. 125— ок. 170), Климент Александрийский (ок. 150— ок. 215), Тертуллиан (155/165—220/240), Клавдий Элиан (ок. 170— после 222), Теон Смирнский (II век), Диоген Лаэртский (180—240), Ямвлих (245/280— 325/330), Мавр Сервий Гонорат (III век), Фемистий (около 317— после 388), Юлиан (331/332—363), Иероним Стридонский (342—419/420), Кирилл Александрийский (376—444), Феодорит (386—457), Прокл Диадох (412—485), Симпликий (490—560), Георгий Синкелл (VIII—IX века), византийский энциклопедический словарь X века Суда, Абу-ль-Фарадж бин Харун (1226—1286), различные схолиасты, анонимные трактаты и др. Кроме явных сомнений в достоверности сведений из источников, отдалённых от описываемого персонажа 500—1500-летним промежутком, обращает на себя внимание противоречивость данных.
Наиболее достоверными современные учёные признают сведения о Фалесе в трудах Геродота и Аристотеля, которые жили «всего» через 2—3 столетия после его смерти.
Историки воспринимают данные свидетельства по разному. Голландский математик Б.Л.Ван дер Варден считал, что Фалес первым ввёл в геометрию математические доказательства, возможно, опираясь на почерпнутые у древних египтян и вавилонян знания. О. Нейгебауэр утверждал, что все сведения о Фалесе, как и о Пифагоре, являются мифами. По мнению данного учёного этим легендарным личностям приписали все их «открытия». Возможно речь идёт о «культурной легенде»— имени, с которым древние греки ассоциировали открытия и мысли своих предков до того момента, как появилась их письменная фиксация. Такие радикальные оценки личности Фалеса не получили широкого распространения. Современные учёные воспринимают Фалеса основоположником древнегреческих философии и математики.
Немецкий философ Г. В.Ф.Гегель охарактеризовал несколько античных источников, имеющих непосредственное отношение к Фалесу, относительно их ценности для понимания древнегреческой философии. Изложение Платона внешне может показаться изложением учений других философов. Так как Платон собирал и основательно изучал трактаты своих предшественников, то его сведения имеют важное значение. Однако в его произведениях невозможно вычленить мысли самих древних философов и их интерпретацию автором. Наиболее ценные сведения о древней философии содержатся у Аристотеля. Цицерон приводит множество деталей из древних учений. Однако, по мнению Гегеля, его сведения о философах поверхностны. Важным источником является компилятивный труд Диогена Лаэртского. В его книге собраны многочисленные анекдоты, которые могут быть использованы для получения биографических сведений.
Происхождение
Фалес родился в семье Эксамия и Клеобулины. По одной версии по происхождению был финикийцем и принадлежал к роду Фелидов, чьим мифическим родоначальником являлся сын царя Тира и Сидона Агенора Кадм. Был изгнан из Финикии и переехал в расположенный на малоазийском побережье Эгейского моря ионийский город Милет. По другой версии происходил из знатного милетского рода. Согласно Аполлодору родился в первый год тридцать пятой олимпиады, то есть в 640 году дон.э. В византийской энциклопедии Суда с ссылкой на Флегонта написано, что Фалес был уже известен в седьмую олимпиаду, то есть в 752—749 годах дон.э. Эти даты не согласуются с другими событиями из предполагаемой жизни философа. Герман Дильс считал, что Фалес жил в 624—547 годах дон.э., Поль Таннери — в 637—558 годах дон.э..
Вопрос происхождения Фалеса, который не особо беспокоил древних греков, с неожиданной стороны заинтересовал историков Нового и Новейшего времени. Если принять версию Геродота и цитировавших его античных авторов о финикийском происхождении Фалеса, то получается «отец философии» был семитом. Ещё Э. Целлер (1814—1908), который отстаивал самобытность древнегреческой цивилизации, высказал предположение, что речь шла о беотийском происхождении Фалеса. Мифический Кадм хоть и был сыном финикийского царя, всё же в первую очередь известен как основатель столицы Беотии Фив. Знатные беотийцы возводили к нему своё генеалогическое древо. Другой немецкий учёный Г. Дильс опубликовал в 1889 году статью «Thales ein Semite?», в которой обосновывал несемитское происхождение Фалеса. Вопрос о принадлежности Фалеса к грекам или финикийцам остаётся неразрешённым. Об этом свидетельствует статья «Thales, ein Phönizier?» 2015 года в которой собраны свидетельства античных авторов о месте рождения Фалеса, аргументы «за» и «против» современных историков.
Семья
Сведения о семейном положении Фалеса носят фрагментарный и противоречивый характер. Диоген Лаэртский собрал существовавшие в античности версии о семье Фалеса. Так, согласно одним источникам, он был женат и имел сына Кибисфа; другим— усыновил племянника, сына сестры; третьим— был бездетным и жил в одиночестве. На вопрос почему он не заводит детей, Фалес ответил: «Потому что люблю их». Ещё по одной легенде, когда мать требовала от сына жениться, тот вначале отвечал: «Слишком рано!», а затем— «Слишком поздно!»
Ещё по одной легенде Фалес утром трижды благодарил богов: «За то, что они создали его человеком, а не животным; эллином, а не варваром; мужчиной, а не женщиной».
Политическая деятельность
В первой половине жизни много путешествовал. Согласно античным источникам какое-то время жил в Египте, где обучался у жрецов, изучал причины наводнений и разливов Нила. По Ямвлиху именно он уговорил Пифагора отплыть в Египет и представил его, обучившим своим тайнам, жрецам. Гипотетические путешествия Фалеса в Египет и обучение у местных учёных имели важное значение для древних греков. Они приписывали загадочной древнеегипетской цивилизации тайные и утраченные знания. Фалес, в представлении эллинов, был первым греческим мудрецом, который принёс в Элладу знания египтян, сделал их общим достоянием. Подобные легенды также существовали о Пифагоре и Платоне.
По свидетельству Диогена Лаэртского Фалес был близким другом и советником тирана Милета Фрасибула. Данное утверждение античного автора, по мнению современных историков, выглядит правдоподобным. Знатное происхождение, учёность, а возможно и личная симпатия должны были способствовать сближению Фалеса с правителем города Фрасибулом. Возможно, что именно Фалесу принадлежали советы, которые помогли Фрасибулу заключить мир и равноправный союз с намного более сильным соперником Лидией около 615 года дон.э. В контексте дружбы философа и тирана становится понятным назначение ученика Фалеса Анаксимандра ойкистом милетской колонии Аполлонии Понтийской (современный Созопол в Болгарии).
Прозорливость Фалеса проявилась во время создания Киром Великим империи Ахеменидов. Он одним из первых осознал угрозу порабощения Ионии персами и предложил реальный, хоть и нереализованный, план противодействия этой угрозе. По его мнению было необходимо создать политическое объединение синойкизм Панионию с политическим центром на острове Хиос. Одновременно он убедил граждан Милета отказаться от военного союза с царём Лидии Крёзом, который начал войну с Киром. Это позволило Милету после поражения Лидии заключить наиболее выгодный, по сравнению с другими ионийскими городами, сепаратный мир с Киром. Одновременно Фалес помог Крёзу во время военных действий с персами. По свидетельству Геродота, когда войско Крёза остановилось перед полноводной рекой Галис, Фалес построил плотину и изменил русло реки таким образом, что солдаты смогли спокойно продолжить путь навстречу врагу.
Легенды
Иллюстрация XVIII века к басне Жана де Лафонтена «Астролог, упавший в колодец»С именем Фалеса связаны несколько легенд. Популярность получил сюжет о философе или астрологе, который упал в колодец. Впервые в мировой литературе он приведен в диалоге Платона «Теэтет» первой половины IV века дон.э.:
На примере Фалеса, наблюдавшего за звёздами, понятно это, Феодор! Заглядевшись однажды на небо, он упал в колодец, а фракиянка одна, благопристойная и прелестная служанка, как рассказывают, посмеяласьнад ним: жаждет-де знать, что на небе происходит, и не замечает, что у него перед носом и под ногами. Эта насмешка относится ко всем, кто проводит время в философствовании. Такой человек действительно не осведомлён ни о ближнем своём, ни о соседе, и не только не знает, что он делает, но и человек ли он вообще или какое-нибудь животное. А между тем предметом его поисков и неутомимого исследования в отличие от других является вопрос о том, что такое человек и что присуще его природе.
Впоследствии басню описал Диоген Лаэртский и она вошла в сборник «Басни Эзопа» под номером 40 согласно индексу Перри. В Новое время её использовали при критике астрологов и лжеучёных схоластов и другие писатели, в том числе и знаменитый французский баснописец Жан де Лафонтен.
Ещё одну легенду о жизни легендарного мудреца приводит Аристотель в «Политике». Современники упрекали Фалеса, что его занятия философией и наукой бесполезны, не приносят никакой выгоды. Тогда Фалес на основании астрономических данных предугадал богатый урожай оливок. После этого он за бесценок законтрактовал маслобойни на Хиосе и в Милете. Когда наступило время сбора оливок, то всем понадобился доступ к маслодавильням, что позволило Фалесу разбогатеть. Таким образом он доказал, что философ может легко разбогатеть используя свои знания, но не делает этого, так как не богатство является его целью.
Фалес входит во все античные списки «семи мудрецов», которые имеют множество вариаций. С именами семи мудрецов связаны два рассказа с многими вариациями: совместный пир и состязание из-за треножника. Рассказ о пире мудрецов, которые собрались в гостях у коринфского тирана Периандра, дошёл до современников в изложении Плутарха. По современным оценкам автор приписал мудрецам собственные идеи и не отобразил все народные мотивы. Содержание рассказа о треножнике содержит массу вариаций. По наиболее распространённой версии рыбак выловил вместе с рыбой этот жертвенный предмет. За обладание им разгорелась война между жителями Милета и острова Кос. В конечном итоге стороны обратились за советом к дельфийскому оракулу. Пифия передала волю Аполлона «отдать треножник умнейшему из греков». Тогда артефакт вручили Фалесу. Тот в свою очередь посчитал себя недостойным звания «умнейшего из греков» и отправил предмет Бианту. В конечном итоге треножник сменил семь владельцев и вернулся к Фалесу. После этого все семь мудрецов согласились отдать предмет Аполлону, так как именно он по их мнению и был «мудрейшим».
Согласно античным источникам Фалес умер в преклонном возрасте, «когда смотрел гимнастическое состязание, обессилев вследствие жары».
Изречения и сочинения
Античная традиция причисляла Фалеса к «семи мудрецам». С их именами связывают рождение древнегреческой философии, а самого Фалеса называли её отцом. Истоки философии в Древней Греции связаны с народными пословицами, житейскими мудростями. Мысли первых философов дошли до современников не в виде завершённых трактатов, а в форме множества изречений. Точность их распределения между мудрецами условна, имеет существенные отличия в источниках. Фалесу приписывают авторство следующих сентенций:
- «Древнее всего сущего— Бог, ибо он не рожден»;
- «Прекраснее всего— мир, ибо он творение Бога»;
- «Больше всего— пространство, ибо оно объемлет всё»;
- «Быстрее всего— ум, ибо он обегает всё»;
- «Сильнее всего— неизбежность, ибо она властвует всем»;
- «Мудрее всего— время, ибо оно раскрывает все»;
- «Что на свете трудно?»— «Познать себя!»;
- «Что легко?»— «Советовать другому!»;
- «Чем поддержал ты своих родителей, такой поддержки жди и от детей»;
- и др.
Сочинения Фалеса не сохранились. В позднеантичных источниках упомянуты несколько трактатов. Диоген Лаэртский приписывает ему авторство «О солнцеворотах» (Περὶ τροπὴς) и «О равноденствиях» (Περὶ ἰσημερίας). Симпликий (490—560) называет единственным завершённым трудом Фалеса «Морскую астрономию», которую учёный написал в конце жизни. В ней по свидетельству Симпликия были описаны методики ориентирования во время морских путешествий. Сенека, Плутарх и Гален упоминали фалесово сочинение «О началах». К подложным сочинениям Фалеса относят два письма от его имени к Солону и Ферекиду. В отличие от других древнегреческих учёных, чьи труды не сохранились, у историков имеются сомнения относительно самого факта существования трактатов Фалеса. Во всяком случае, ни Геродот, ни Платон, ни Аристотель о них ничего не знали. Таким образом современные представления об учении и открытиях Фалеса основаны даже не на цитировании оригинальных работ другими авторами, а на передаче в источниках устной традиции, которая отделена от Фалеса многими поколениями.
Наука
Космогония и космология
Согласно Диогену Лаэртскому началом всех вещей Фалес считал воду, а Космос— живым существом, полным божественных сил. Земля плавает в центре Мирового океана «какдерево или какое-нибудь другое подобное вещество». Землетрясения представляют собой волнения в Мировом океане. Солнце и Луна объезжают небо не на колесницах, а на кораблях. Вопрос относительно того является ли Фалес первым, кто создал космогоническую теорию происхождения всего сущего из одного элемента, либо заимствовал это учение из Древних Египта и/или Вавилона, переосмыслил идеи из трудов Гомера об Океане остаётся открытым. Космологические идеи Фалеса имеют сходство с египетским мифом о Птахе, который воплотился в божество, когда весь мир представлял собой первозданный океан Нун. Вавилонский космогонический миф «Энума элиш» представляет описание борьбы Мардука с богами водного хаоса. В «Одиссее» Гомера содержится строка: «Навестить Океана, прародителя богов, и матерь Тефию». Одновременно существует и другая точка зрения, что Фалес пришёл к выводу о сотворении всего сущего из воды самостоятельно. Аристотель попытался повторить логику рассуждений своего предшественника. Если растения питаются влагой, начало живых существ— влажное семя, огонь Солнца и сам Космос питаются испарениями, то значит именно вода является началом всего сущего.
Вопрос о ближневосточном влиянии на космологию Фалеса остаётся открытым. Гипотеза имеет как сторонников, так и противников. Одновременно профессор филолог-классик А.В.Лебедев подчёркивает, что в египетских и других мифах кроме водной стихии—прародительнице всего сущего присутствует и демиург. Таковой есть, согласно Цицерону, Диогену Лаэртскому, позднеантичным христианским источникам и др., и у Фалеса в виде всепроникающей божественной силы, которая присутствует везде и во всём. Данные источники противоречат свидетельству Аристотеля о том, что древние физиологи, к которым принадлежит Фалес, описывали лишь материальную первопричину всего сущего, а первым кто выдвинул идею божественной силы Нус («космический Разум») был Анаксагор. Исходя из этого можно сделать вывод о том, что концепция о вмешательстве Бога в космогонии Фалеса является «ошибкой послеаристотелевского времени». Как бы то ни было данное утверждение, хоть и существует в научной среде, не является общепринятым.
Хоть космогонические взгляды Фалеса и несут следы первобытных мифологических представлений, они стали первым учением о материальной основе сущего, заложили основы научного подхода к описанию природных явлений. Также Фалес первым предположил раскалённый землеобразный состав материи звёзд и Солнца.
Бог для Фалеса представляет собой всепроникающий космический Ум, который приводит первовещество воду в движение. Сама вода при сгущении становится землёй, а при испарении— воздухом, который затем возгорается в виде эфира, то есть огнём, в том числе и огнём Солнца и звёзд. Выпадая в осадок вода превращается в ил, то есть землю.
В утверждении, что «всё— из воды», философ и антиковед А.Ф.Лосев выделяет три идеи. Идею всеединства можно выразить одним, приписываемым Фалесу, предложением: «Космос един». Утверждение о единстве мира напрямую следует из идеи о первовеществе. Вторая идея, заложенная в «первовещество», состоит в «неуничтожимости всего». Отсюда в свою очередь следует не только неуничтожимость материи, но и «бессмертие души», как наиболее тонкой и особой формы материи. Третья идея «Всё из воды, и всё разрешается в воду» представляет антитезу конкретных предметов и безликой стихии.
Убеждение Фалеса в том, что «всё полно богов» приводит к всеобщему одушевлению («Прекрасно полагает Фалес, что во всех важнейших и величайших частях космоса имеется душа, а потому и не стоит удивляться тому, что промыслом Бога совершаются прекраснейшие дела»). Согласно античным источникам Фалес приписывал наличие души янтарю и магниту. Соединив оба утверждения «всё— из воды» и «всё полно богов» древнегреческая мысль стала воспринимать Бога первопричиной возникновения всего сущего.
Астрономия
Античные источники утверждают, что Фалес точно указал дату солнечного затмения. Современники датируют это событие 28 мая 585 годом дон.э. У антиковедов возникает вопрос относительно того, каким образом Фалес мог сделать такое экстраординарное для древних греков предсказание, если оно действительно имело место быть. Голландский математик Б.Л.Ван дер Варден видит в этом однозначное свидетельство знакомства Фалеса с вавилонской астрономией, которая на тот момент, согласно современным представлениям, обладала соответствующими знаниями. О том, что предсказание было свидетельствует Ксенофан, который жил через полвека после Фалеса. По мнению учёных представления Фалеса о природе солнечных затмений соответствовали современным. Возможно античный учёный предсказал не точную дату, а год, либо другой промежуток времени. Метод с помощью которого было определено событие неизвестен. Согласно современным реконструкциям хода мысли Фалеса он обладал глубокими познаниями эклиптики.
Фалес первым определил угловой размер Луны и Солнца в ½ градуса; он нашёл, что размер Солнца составляет 1720 часть от его кругового пути, а размер Луны— такую же часть от лунного пути. Можно утверждать, что Фалес создал «математический метод» в изучении движения небесных тел.
Согласно античным представлениям Фалес открыл для греков созвездие Малой Медведицы как путеводный инструмент; ранее этим созвездием пользовались финикийцы. Фалес ввёл календарь по египетскому образцу (в котором год состоял из 365 дней, делился на 12 месяцев по 30 дней, и пять дополнительных дней оставались выпадающими). Также ему приписывали открытие наклона эклиптики к экватору и выделение на небесной сфере пяти кругов: арктического, летнего тропика, небесного экватора, зимнего тропика и антарктического круга. Он научился вычислять время солнцестояний и равноденствий, установил неравность промежутков между ними. Исходя из дошедших источников современные учёные называют Фалеса основоположником геоцентризма.
Геометрия
Информация о математических достижениях Фалеса дошла до современников благодаря комментатору «Начал» Евклида Проклу Диадоху (412—485), а также Диогену Лаэртскому (180—240). Прокл в свою очередь основывался на несохранившейся «Истории геометрии и арифметики» Евдема Родосского (IV век дон.э.), а Диоген Лаэртский цитирует Памфилу Эпидаврскую (I век). Кроме того позднеантичные авторы в нескольких вариациях описали легенду об измерении Фалесом высоты египетских пирамид. Согласно Диогену Лаэртскому учёный измерил их высоту по тени. Он подметил момент, когда отбрасываемая Фалесом тень стала равной его росту. По версии Плутарха Фалес поставил шест на край отбрасываемой пирамидой тени. Измерив длину шеста и его тени он показал, что отношение длины тени пирамиды к тени от шеста равно отношению высоты пирамиды к высоте шеста.
Согласно Проклу Фалес сделал четыре математических открытия. Он первым доказал, что диаметр делит круг пополам. Также ему принадлежит авторство утверждения о равенстве углов при основании равнобедренного треугольника. Согласно Евдему Фалес открыл, что при пересечении двух прямых образуются две пары равных углов. Древнегреческому математику принадлежит теорема о равенстве двух треугольников у которых равные сторона и два угла, что позволило находить расстояние от берега до корабля в море. Диоген Лаэртский пишет: «Памфила говорит, что он [Фалес], научившись у египтян геометрии, первый вписал прямоугольный треугольник в круг и за это принес в жертву быка. Впрочем, иные, в том числе Аполлодор Исчислитель, приписывают это Пифагору».
Схема определения Фалесом высоты пирамидыЗадачи о вычислении высоты пирамиды и расстояния до корабля на первый взгляд являются сугубо прикладными. Однако по современным оценкам момент, когда Фалес начал определять эти величины, стал переломным в истории науки. Ведь, если возможно измерить высоту пирамиды и расстояние до находящегося вдали корабля, то следующие вопросы, которые поставит перед собой человечество станут: «Каково расстояние от Земли до Солнца и от Солнца до Луны?»
Хоть измерение Фалесом пирамид выглядит весьма простым в осуществлении и заключается в решении пропорции CB=DA, с одним неизвестным D, задача предполагает много математических вопросов. Результатом разбора понятия пропорции, как равенства отношений, подобия сходно расположенных треугольников станет формулировка теоремы Фалеса о пропорциональных отрезках: «Если на одной из двух прямых отложить последовательно несколько отрезков и через их концы провести параллельные прямые, пересекающие вторую прямую, то они отсекут на второй прямой пропорциональные отрезки». Обратная теорема Фалеса звучит как «Если прямые, пересекающие две другие прямые (параллельные или нет), отсекают на обеих из них равные (или пропорциональные) между собой отрезки, начиная от вершины, то такие прямые параллельны».
В мировой литературе существуют разночтения относительно «Теоремы Фалеса». Впервые термин встречается во французской математической литературе в 1882 году. Затем определение было использовано в 1885 году в итальянской книге по геометрии. В немецкой с 1894 года, а затем и в англоязычной математической литературе, определение «Теорема Фалеса» закрепилось за другой теоремой: «Если в треугольнике угол опирается на диаметр окружности, описанной вокруг него, то этот угол— прямой, то есть треугольник— прямоугольный». Обозначение теоремы о параллельных секущих именем Фалеса закрепилось также в испанской, бельгийской и русской литературе, а о вписанном в полукруг треугольнике— австрийской, венгерской и чешской.
Каким образом Фалес определил расстояние от берега до корабля в море, античные источники умалчивают. Б. Л. Ван дер Варден считает, что именно с этой задачей связано появление теоремы о равенстве треугольников.
Философия
Греческая философия начинается, по-видимому, с нескладной мысли — с положения, будто вода – первоначало и материнское лоно всех вещей. Действительно ли на этом нужно всерьез остановиться? Да, и по трём причинам: во-первых, потому, что это положение высказывает нечто о происхождении вещей, во-вторых, потому, что оно делает это без иносказаний и притч; и, наконец, потому, что в нём, хотя и в зачаточном состоянии, заключена мысль: «Все – едино». Первое оставляет еще Фалеса в обществе религиозных и суеверных людей, второе выводит его из этого общества и показывает его нам естествоиспытателем, но в силу третьего — Фалес становится первым греческим философом. Если бы он сказал: из воды происходит земля, мы имели бы научную гипотезу, ложную, но все же трудно опровержимую. Но он вышел за пределы научного. Выражая своё представление о единстве гипотезою воды, Фалес не преодолел низкий уровень физических воззрений своего времени, а перескочил через него. Скудные и беспорядочные наблюдения эмпирического характера, произведенные Фалесом над состоянием и изменениями воды, или, точнее, влаги, менее всего могли дозволить такое радикальное обобщение — не говоря уже о том, чтоб на вести на него; к этому побуждал метафизический догмат, возникающий из мистической интуиции, — догмат, с которым мы встречаемся во всех философиях, включая сюда постоянно возобновляемые попытки выразить его лучше — положение «всё — едино».
Фалес считается основателем первой древнегреческой научно-философской школы, которая вошла в историю под названием «милетской». Она в отличие от современной философии не касалась теоретических проблем бытия и познания, а изучала сущность мира. Философы милетской школы не ставили вопрос об отношении материального к духовному. В понимании современников именно с открытий данной школы началась история европейской науки— космогонии и космологии, физики, географии, метеорологии, астрономии, биологии и математики. В этом контексте Фалеса могут называть натурфилософом, подчёркивая его занятия естественными науками.
Милетская школа описывала эволюцию космоса, начиная от первовещества до сотворения живых существ. Фалес и его последователи противопоставили науку мифологии, «логос мифу», отказались от противопоставления божественного человеческому. Предложенные ими фундаментальные законы, в том числе «закон сохранения материи», отрицание возникновения из ничего и полного уничтожения, претендовали на всеобщий характер.
Фалес определил первичным веществом воду. В античных источниках отсутствуют какие-либо сведения о размышлениях Фалеса относительно того, каким образом она возникла и каким образом из неё происходят другие формы бытия. Аристотель высказывает предположение относительно обстоятельств признания именно воды, а не земли, воздуха, или огня, первичным веществом. Хоть Аристотель и добавляет к своим обоснованиям словосочетание «может быть», впоследствии их стали принимать как фактические, а не гипотетические основы учения Фалеса. В данном случае мы имеем одно из первых «доказательств от действительности», основанные на соответствии общей мысли о воде. Аристотель приводит примеры влажного семени, которое даёт жизнь, воды, как пищи для растений. В данном случае бесформенная субстанция вода приобретает конкретную форму и «индивидуализируется индивидуальностью».
Центральное положение учения Фалеса, что вода есть первовещество представляет собой начало философии. Эта мысль, несмотря на её недоказуемость, представляла собой отход от мифологических верований согласно которым природа была порождением богов. В ней впервые артикулировано положение о том, что «единое есть сущность». В этом положении множество предметов и явлений имеют единую суть, первоначало, которое видоизменилось тем или иным образом. При этом фалесовское первоначало, в отличие от поздних философских учений, имеет материальную природу. Поэтому его и определяют «натурфилософом».
Фалесовой воде не хватает формы. Философы милетской школы объясняли приобретение первовеществом конкретной формы лишь количественными различиями— сгущением и разрежением. Следующий вопрос, который поставит себе философия, в изложении Гегеля, будет определение души. Гегель считал, что фалесовские определения души, а также утверждения о том, что Бог есть некий дух, либо космический разум, придающий воде некие формы являются поздними выдумками. Суммируя роль Фалеса в развитии философии Гегель приписывает античному учёному два достижения: «он совершил отвлечение, дабы обнять природу в одной простой сущности; он выставил понятие основания, то есть определил воду как бесконечное понятие, как простую сущность мысли, не признавая за ним никакой дальнейшей определённости».
Память
Фалес Милетский, один из тех знаменитых семи мудрецов и, несомненно, самый великий среди них— ведь это он был у греков первым изобретателем геометрии, самым опытным испытателем природы, самым знающим наблюдателем светил,— проводя маленькие черточки, делал великие открытия: он изучал смены времен года, ветров дуновения, планет движения; грома дивное грохотание, звезд по кругам своим блуждания, солнца ежегодные обращения, а также луну— как она прибывает, родившись, как убывает, старея, и почему исчезает, затмившись. Так вот, этот самый Фалес уже в глубокой старости создал свое божественное учение о солнце, устанавливающее соотношение между размерами солнца и длиною окружности, которую оно описывает. (Я не только знаком с этим учением, но даже подтвердил правильность его своими собственными опытами). Говорят, что вскорости же после своего открытия Фалес рассказал о нем Мандраиту из Приены. Тот, придя в восторг от этой новой и неожиданной истины, предложил Фалесу просить любое вознаграждение за такой замечательный урок. „Для меня будет достаточным вознаграждением,— ответил мудрый Фалес,— если, пожелав сообщить кому бы то ни было о том, чему ты у меня выучился, ты не станешь приписывать этого открытия себе, но заявишь во всеуслышание, что оно сделано мною, и никем иным“. Прекрасное вознаграждение, несомненно, достойное такого мужа и непреходящее! Да, потому что и по сей день и впредь во все времена Фалес получал и будет получать от нас— всех тех, кто действительно знакомится с его трудами,— это вознаграждение за свои исследования небесных явлений.
Фалес при жизни снискал славу мудреца и умнейшего среди эллинов. Его имя уже в V веке дон.э. стало нарицательным для мудреца. «Отцом философии» и её «родоначальником» (греч. άρχηγέτης) Фалеса называли уже в древности. Диоген Лаэртский писал о нём, как о «первом мудреце», Цицерон, Платон и Страбон— «первом философе», Юстин и Евсевий— «первом натурфилософе», Аристотель— «основателе философии», Апулей— «первом геометре», Евдем и Минуций Феликс— «первом астрономе», Плиний, Лактанций и Тертуллиан— «первом физике». Комедиографы Аристофан и Плавт использовали имя «Фалес» в качестве эпитета софистов в ироничном смысле.
Данте поместил Диогена в первый круг Ада— Лимб, где находятся добродетельные язычники.
В Новое время первым, кто стал связывать имя Фалеса с возникновением философии был немецкий философ Д. Тидеман (1748—1803). Впоследствии это мнение нашло отображение в трудах Э. Целлера (1814—1908), А. Швеглера (1819—1857), Гегеля и других философов. Современники видят заслугу Фалеса в преобразовании мифологического мировоззрения в философское. Его считают одним из первых греческих философов и учёных, человеком, находившимся у истоков древнегреческой научной мысли, которая в свою очередь стала колыбелью западноевропейской цивилизации. Если просуммировать все оценки Фалеса историками Нового и Новейшего времени, то они будут практически неотличимы от античных. Античного философа описывают как первого математика и создателя научной геометрии, астронома, метеоролога, физика, создателя милетской научной школы.
В 1935г. Международный астрономический союз присвоил имя Фалеса Милетского кратеру на видимой стороне Луны.
[PDF] Выполнила: Гусько Татьяна ученица 8 «А» МОУ – СОШ п. Дружба -2008-
Download Выполнила: Гусько Татьяна ученица 8 «А» МОУ – СОШ п. Дружба -2008-…
Выполнила: Гусько Татьяна ученица 8 «А» МОУ – СОШ п. Дружба -2008-1. Как появился счет? 2. Кто был первым математиком? 3. Перейдём к геометрии ( теорема Пифагора) 4. Вывод
Как появился счет? Искусство счета развилось с развитием человечества. В те времена, когда человек лишь собирал в лесу плоды и охотился, ему для счета хватало четырех слов: один, два, три и много. Именно так считают и сейчас некоторые племена, живущие в джунглях Южной Америки. Однако, когда люди начали заниматься животноводством и земледелием, то им уже стало необходимо пересчитывать коз в стаде или количество корзин с выращенными плодами ( которых было больше трех), заготовленными на зиму.
Способов счета было придумано немало: делились зарубки на палке по числу предметов, завязывались узлы на веревке, складывались в кучу камешки. Но палку с зарубками с собой не возьмешь, да и камни таскать не очень приятно, а пастуху нужно знать – не отбилась ли какая коза от стада. И тут на помощь приходят пальцы рук – отличный счетный материал, им до сих пор пользуются не только первоклассники. А если предметов больше десяти? Конечно, можно использовать и пальцы на ногах, а дальше? Тут уже ничего не оставалось делать, как придумать десятичную систему, которой мы пользуемся сейчас: считаем десятки; когда наберется десять сотен – тысячей. В Древней Руси десять тысячей
называли «тьма». Отсюда выражение «тьма народу». «Пальцевое» происхождение десятичной системы подтверждается формой латинских цифр: римская цифра пять (V) – ладонь с оттопыренным большим пальцем, а римская цифра десять ( X) – две скрещенные руки. Но не все народы пошли по этому пути, хотя использовали все те же пальцы. Индейцы племени майя в Америке считали пятерками: одна пятерка – единица следующего разряда, пять пятерок – новый разряд и т. д. Ясно, что они пользовались пальцами только одной руки. Некоторые племена использовали только четыре пальца одной руки, однако при этом учитывали, что каждый палец состоит из трех фаланг, т. е. имели в расположении двенадцать объектов счета.
Так возникла дюжина, которая сто лет назад была широко распространена и в Европе, и в России, но постепенно уступила свое место десятке. До сих пор в Европе дюжинами считают пуговицы, носовые платки, куриные яйца и многое другое, что продается поштучно. Существует и следующий разряд в этой системе счета: двенадцать дюжин называются гроссом ( это 144 единицы). А сколько единиц содержит следующий разряд? Все знают, что тысяча тысяч – это миллион. Но мало кто знает, как называются следующий разряды. Для их названий приняты латинские наименования чисел.
Кто был первым математиком? История не сохранила ни имен древнеегипетских, ни вавилонских «решателей» задач. Так что первого известного математика придется искать среди древних греков. Наибольшие основания на этот титул у Фалеса Милетского, родившегося в середине седьмого века до н. э. и прожившего долгую и, несомненно, яркую жизнь. Об этом человеке почти ничего не известно достоверно. Но ему повезло больше, чем родоначальнику литературы – Гомеру – по крайней мере, никто не сомневается в существовании этой личности. Мы знаем, что в молодости Фалес был крупным купцом и путешественником, а в старости из величайших греческих мудрецов.
В
те далекие времена еще не существовало отдельных наук о величинах, о природе и о мышлении – все было слито воедино. «Можно проводить не только практические, но и мысленные опыты!» — эта значительная идея Фалеса, в равной мере, принадлежит математике, физике и философии. И не случайно Фалес считается родоначальником всех трех названных наук. Мысленные опыты Фалеса легли в основу первых математических доказательств. Например, Фалес доказал теорему о равенстве вертикальных углов. « Эти углы можно совместить, повернув один из них, — рассуждал мудрец. – Значит, они равны».
Как это просто для нас – и каким гигантским шагом вперед стало это доказательство в истории математики! Но Фалес пошел еще дальше – он создал метод. при помощи мысленных движений и совмещений было доказано еще несколько теорем. Одна из них до сих пор сохраняется в школьном курсе геометрии под названием теоремы Фалеса.
ГЕОМЕТРИЯ «Геометрия является самым могущественным средством для изощрения наших умственных способностей и даёт нам возможность правильно мыслить и рассуждать» (Г.Галилей)
Геометрия – одна из наиболее древних математических наук. Название
науки «геометрия» — древнегреческого происхождения. Оно составлено из двух древнегреческих слов: ge – «Земля» и metreo – «измеряю». Возникновение геометрических знаний связано с практической деятельностью людей. Это отразилось и в назнаниях многих геометрических фигур. Например, название фигуры трапеция происходит от греческого слова trapezion – «столик», от которого произошло также слово «трапеза». Или термин «линия» возник от латинского linum – «лён, льняная нить». Ещё в древности геометрия превратилась в дедуктивную, строго логическую науку. В современной математике геометрия всё больше приобретает роль метода мышления, метода осмысления и организации математической информации во всех областях математики. «Геометрия – правительница всех мыслительных изысканий» (М.В.Ломоносов)
Теорема Пифагора Знаменитая теорема Пифагора звучит так: площадь квадрата, построенного на гипотенузе (т.е большей стороне) прямоугольного треугольника, равна сумме площадей квадратов, построенных на его катетах ( меньших сторонах). Про картинку, иллюстрирующую эту теорему (рис. 1.), сложена шутливая поговорка: «Пифагоровы штаны на все стороны равны».
(рис. 1.)
Изучение вавилонских клинописных таблиц и древнекитайских рукописей показало, что утверждение этой теоремы было известно задолго состояла в том, что он открыл доказательство этой теоремы.
Сейчас известно более трехсот доказательств теоремы Пифагора. Самое наглядное из них приведено на рис. 2. Посмотрите внимательно на два квадрата и вам все станет ясно. Индусы к этому чертежу добавляли лишь одно слово: « Смотри!» (рис. 2)
Используя эту теорему, Пифагор и его ученики описали все тройки целых чисел, которые могут быть длинами сторон прямоугольного треугольника. Многие из них были известны и ранее – они обнаружены на клинописных табличках, дошедших до нас из древнего Вавилона. Позднее выяснилось, что если на сторонах прямоугольного треугольника построить не квадраты, а произвольные подобные между собой фигуры, то сумма площадей фигур, построенных на катетах, равна площади фигуры, построенной на гипотенузе. Теорему Пифагора можно сформулировать и так: « Квадрат длины диагонали прямоугольника равен сумме квадратов длин смежных сторон этого прямоугольника».
Если перейти в трехмерное пространство, то нетрудно доказать и такое обобщение теоремы Пифагора: «Квадрат длины диагонали прямоугольного параллелепипеда равен сумме квадратов длин его ребер, выходящих из одной вершины».
ВЫВОД: Датский физик Нильс Бор говорил, что математика является большим, чем наука, поскольку она является языком науки. И действительно, математика стала для многих отраслей знания не только орудием количественного расчёта, но также методом точного исследования и средством предельно чёткой формулировки понятий и проблем. Привычка мыслить, открывать новое в обыденном окажет нам огромную помощь в практической работе и позволит превратить труд во внутреннюю потребность (изобретать, совершенствовать…). В ДОБРЫЙ ПУТЬ, ДРУЗЬЯ!
Конспекты уроков Геометрия 8 класс
На уроке мы узнаем, что такое описанная около многоугольника окружность. Изучим некоторые свойства вписанных в окружности фигур. Увидим, вокруг каких фигур можно описать окружность. Докажем несколько теорем по теме и научимся решать типовые задачи.
Введение
Окружность называется описанной около многоугольника, если все его вершины лежат на этой окружности, при этом многоугольник называется вписанным в окружность (см. рис. 2).
Вся теория описанных окружностей базируется на свойстве серединного перпендикуляра (см. рис. 1). – серединный перпендикуляр.
Рис. 1. Серединный перпендикуляр
Теорема: серединный перпендикуляр является геометрическим местом точек, равноудаленных от концов отрезка. Т.е. центр окружности, описанной около отрезка, лежит на его серединном перпендикуляре.
Около многоугольника можно описать окружность тогда и только тогда, когда все его серединные перпендикуляры пересекаются в одной точке.
Рис. 2. Вписанный многоугольник
В данном случае , , , – четыре серединных перпендикуляра четырехугольника, должны пересечься в одной точке, точке , тогда около этого многоугольника можно описать окружность (см. рис. 2).
Окружность, описанная вокруг треугольника
Не каждый многоугольник обладает таким свойством, любой треугольник этим свойством обладает.
Теорема 1: около любого треугольника можно описать окружность и притом только одну.
Доказательство: дан треугольник . Его серединные перпендикуляры , , . Серединный перпендикуляр пересечется с серединным перпендикуляром в некоторой точке (см. рис. 3).
Рис. 3. Окружность, описанная вокруг треугольника
Они пересекутся, т.к. перпендикулярен к по определению, перпендикулярен к , но не перпендикулярен к , так как в таком случае будет две прямые перпендикулярные к , что невозможно, значит, и не параллельны и обязательно пересекутся (см. рис. 4).
Рис. 4. Иллюстрация к доказательству
Рассмотрим свойства точки . Точка принадлежит перпендикуляру , а значит, она равноудалена от его концов, , точка лежит на втором серединном перпендикуляре , значит, она равноудалена от точек и , .
Выясняется, что точка равноудалена от всех трех вершин треугольника. Обозначим это расстояние за .
Точка равноудалена от точек и , значит, она лежит на серединном перпендикуляре к отрезку .
Три серединных перпендикуляра пересекаются в точке .
Окружность с центром в точке и радиусом описана около данного треугольника.
Мы доказали, что вокруг треугольника можно описать окружность..
Давайте определим, единственная эта окружность или нет. Пусть существует другая описанная окружность с центром и радиусом . .
Центр этой окружности, точка , должна лежать на пересечении серединных перпендикуляров. Значит, она должна совпадать с точкой . .
Точка должна быть удалена от точек , , на одинаковое расстояние, и совпадать с точкой , значит, . Таким образом, окружности совпадают.
Итак, мы доказали, что около любого треугольника можно описать окружность и притом только одну.
Окружность, описанная вокруг прямоугольника
Около четырехугольника не всегда можно описать окружность. Есть параллелограмм . Около него нельзя описать окружность.
Серединные перпендикуляры и параллельны, они не имеют общих точек, иначе это был бы прямоугольник (см. рис. 5).
Рис. 5. Параллелограмм
Около прямоугольника можно описать окружность, и даже можно найти центр этой окружности.
Пусть – прямоугольник. Мы знаем, что диагонали прямоугольника равны между собой, пересекаются и точкой пересечения делятся пополам. Значит, точка равноудалена от всех вершин этого прямоугольника. является радиусом этой окружности. (см. рис. 6)
Рис. 6. Окружность, описанная около прямоугольника
Окружность, описанная вокруг равнобедренной трапеции
Около равнобедренной трапеции можно описать окружность. Допустим, есть трапеция , в которой бедра равны: .
Если мы опишем окружность около любых трех точек, например, окружность около точек , и , то точка будет принадлежать этой окружности. . А почему? Потому что трапеция имеет ось симметрии – серединный перпендикуляр к основаниям и (см. рис. 7).
Рис. 7. Окружность, описанная вокруг равнобедренной трапеции
Итак, мы видим, что около некоторых четырехугольников можно описать окружность. Подмечаем, что сумма противоположных углов в таких четырехугольниках равна 180 градусам. Это очень важное замечание: . Оказывается, это свойство любого выпуклого четырехугольника.
Сумма противоположных углов вписанного выпуклого четырехугольника
Пока мы ограничимся рассмотрением только выпуклых четырехугольников и для таких четырехугольников докажем теорему.
Теорема 2: в любом вписанном четырехугольнике сумма противоположных углов равна 180 градусам.
Рис. 8. Иллюстрация к доказательству
Доказательство: пусть , (см. рис. 8). Используем теорему о вписанном в окружность угле, тогда дуга .
Дуга . В сумме они составляют всю окружность, а значит, . Делим на два и получаем: .
Еще раз повторим ход доказательства, он прост. Если угол равен , то дуга, на которую он опирается, равна 2. Если вписанный в окружность угол равен , то дуга, на которую он опирается, равна 2.
Если точки, на которые эти углы опираются, совпадают, , а . Что и требовалось доказать.
Справедлива обратная теорема: если сумма противоположных углов выпуклого четырехугольника равна 180 градусам, то около этого четырехугольника можно описать окружность.
Дано: .
Доказательство: опишем окружность около трех точек, например, , , . . Докажем, что точка тоже лежит на этой окружности.
Предположим противное, пусть точка не лежит на окружности, а она лежит внутри круга, тогда продлим отрезки и и получим точки и , которые лежат на окружности (cм. рис. 9).
Рис. 9. Иллюстрация к доказательству
Используем теорему о внутреннем угла окружности. А она говорит, что внутренний угол окружности измеряется полусуммой дуг, на которые он опирается. Дан угол , который опирается на дугу (см. рис. 10), пусть он измеряется в .
Угол опирается на дугу , который измеряется в : .
Доказано, что .
Рис. 10. Иллюстрация к доказательству
Почему? Достаточно всего лишь провести отрезок , чтобы получить требуемое (cм. рис. 10).
По теореме о вписанном угле, .
Для треугольника , угол – внешний, а внешний угол равен сумме двух других углов треугольника, не смежных с ним. Т.е. , что и говорилось.
Вернемся к рисунку 9: точка – внутренняя точка круга, значит, равен половине дуг, на которые он опирается.
Мы видим, что угол больше, чем половина дуги .
Угол равен половине оставшейся дуги .
Сложение этих углов дает: .
А так как дуги и в сумме составляют всю окружность, то . Значит, .
Противоречие, по условию, сумма противоположных углов равна 180 градусов. А значит, точка не может находиться внутри окружности.
Аналогично доказывается, что точка не может находиться вне окружности.
Задание
Докажите самостоятельно, что точка не может находиться вне окружности. При этом используйте свойство внешнего угла окружности, он измеряется полуразностью дуг, на которые опирается. Сравните ваше доказательство с доказательством, которое будет приведено ниже в разделе: «Точка вне окружности».
Итак, мы доказали, что точка не может находиться внутри окружности, не может находиться вне окружности, точка находится на окружности. Около четырехугольника можно описать окружность. Теорема доказана.
Задача 1
Из точки , расположенной внутри острого угла , опущены перпендикуляры и на стороны угла. Докажите, что четырехугольник – вписанный. Найдите радиус этой окружности, если равняется 10 (см. рис. 11).
Рис. 11. Иллюстрация к задаче 1
Дано:
;
Найти: .
Решение
Сумма углов и равна 180 градусов, значит, по предыдущей теореме, около этого четырехугольника можно описать окружность.
Угол равен 90 градусам и является вписанным, значит, – диаметр и равен двум радиусам.
Ответ: .
Задача 2
В треугольнике медиана равняется половине стороны . Длина медианы равна 1. Найти радиус описанной окружности (см. рис. 12).
Рис. 12. Иллюстрация к задаче 2
Дано: ; – середина
Найти: .
Решение
Докажем, что угол равен 90 градусов. Есть три равных отрезка .
обозначим , значит, тоже . обозначим , значит, тоже .
Сумма всех углов – 180 градусов, значит, .
Углы и составляют угол , значит, он равен 90 градусов. Таким образом, мы выяснили, что наш треугольник – прямоугольный.
Как мы знаем, в прямоугольном треугольнике центр описанной окружности лежит в середине гипотенузы, т.е. в точке . Значит, радиус равен .
Ответ: .
Заключение
Мы выяснили, что такое описанная около многоугольника окружность. Установили, что около любого треугольника можно описать окружность, и притом только одну. Выяснили, что около четырехугольника можно описать окружность тогда и только тогда, когда сумма его противоположных углов равна 180 градусам.
Точка С вне окружности
Мы доказываем теорему: если сумма противоположных углов выпуклого четырехугольника равна 180 градусам, то около этого четырехугольника можно описать окружность.
Мы провели окружность через три точки , , и доказали, что четвертая вершина не может находиться внутри круга.
Теперь докажем, что точка не может находиться вне круга (см. рис. 13).
Рис. 13. Доказательство о сумме противоположных углов вписанного выпуклого четырехугольника (точка вне круга)
Сначала вспомним свойство внешнего угла окружности: есть окружность, точка вне окружности, проведены две секущие.
Получили угол , он опирается на дугу , на дугу (см. рис. 14).
Рис. 14. Свойство внешнего угла окружности
Дано:
,
Доказать: .
Доказательство
Доказательство очевидно после единственного дополнительного построения, а именно: проведем . И тогда имеем вписанный угол с вершиной , он опирается на дугу в градусов, значит, его величина – .
(по свойству вписанного угла окружности)
Имеем вписанный угол , он опирается на дугу в , значит, его величина равняется .
(по свойству вписанного угла окружности)
Из : . То есть , откуда . Что и требовалось доказать.
Вернемся к рисунку 13: пусть лежит вне окружности (, , ), тогда .
Но угол равен половине дуги : . Складываем полученные неравенства: . Т.к. сумма этих дуг составляет 360 градусов, значит, . А это противоречит условию .
Итак, мы доказали, что точка не может находиться вне окружности (, , ).
Если точка не может находиться внутри окружности и не может находиться вне окружности, значит, она находится на окружности. Что и требовалось доказать.
Необыкновенные игры с обыкновенными дробями
>>Геометрия: Третий признак равенства треугольников. Полные уроки
ТЕМА УРОКА: Третий признак равенства треугольников.
Цели урока:
- Образовательные – повторение, обобщение и проверка знаний по теме: “Признаки равенства треугольников”; выработка основных навыков.
- Развивающие – развить внимание учащихся, усидчивость, настойчивость, логическое мышление, математическую речь.
- Воспитательные — посредством урока воспитывать внимательное отношение друг к другу, прививать умение слушать товарищей, взаимовыручке, самостоятельность.
Задачи урока:
- Формировать навыки в построении треугольников с помощью масштабной линейки, транспортира и чертежного треугольника.
- Проверить умение учащихся решать задачи.
План урока:
- Из истории математики.
- Признаки равенства треугольников.
- Актуализация опорных знаний.
- Прямоугольные треугольники.
Из истории математики.
Прямоугольный треугольник занимает почётное место в вавилонской геометрии, упоминание о нём часто встречается в папирусе Ахмеса.Термин гипотенуза происходит от греческого hypoteinsa, означающего тянущаяся под чем либо, стягивающая. Слово берёт начало от образа древнеегипетских арф, на которых струны натягивались на концы двух взаимно перпендикулярных подставок.
Термин катет происходит от греческого слова «катетос », которое означало отвес, перпендикуляр. В средние века словом катет означали высоту прямоугольного треугольника, в то время, как другие его стороны называли гипотенузой, соответственно основанием. В XVII веке слово катет начинает применяться в современном смысле и широко распространяется, начиная с XVIII века.
Евклид употребляет выражения:
«стороны, заключающие прямой угол», — для катетов;
«сторона, стягивающая прямой угол», — для гипотенузы.
Для начала нам необходимо освежить в памяти предыдущие признаки равенства треугольников. И так начнем с первого.
1-ый признак равенства треугольников.
Предмети > Математика > Математика 7 классСреди огромного количества многоугольников, которые по сути являются замкнутой непересекающейся ломаной линией, треугольник — это фигура с наименьшим количеством углов. Другими словами, это простейший многоугольник. Но, несмотря на всю свою простоту, эта фигура таит в себе много загадок и интересных открытий, которые освещаются особым разделом математики — геометрией. Эту дисциплину в школах начинают преподавать с седьмого класса, и теме «Треугольник» здесь уделяется особое внимание. Дети не только узнают правила о самой фигуре, но и сравнивают их, изучая 1, 2 и 3 признак равенства треугольников.
Первое знакомство
Один из первых правил, с которым знакомятся школьники, звучит примерно так: сумма величин всех углов треугольника равняется 180 градусам. Чтобы это подтвердить, достаточно при помощи транспортира измерить каждую из вершин и сложить все получившиеся значения. Исходя из этого, при двух известных величинах легко определить третью. Например : В треугольнике один из углов равен 70°, а другой — 85°, какова величина третьего угла?
180 — 85 — 70 = 25.
Ответ: 25°.
Задачи могут быть и более сложными, если указано лишь одно значение угла, а про вторую величину сказано лишь, на сколько или во сколько раз она больше или меньше.
В треугольнике для определения тех или иных его особенностей могут быть проведены особые линии, каждая из которых имеет свое название:
- высота — перпендикулярная прямая, проведенная из вершины к противоположной стороне;
- все три высоты, проведенные одновременно, в центре фигуры пересекаются, образуя ортоцентр, который в зависимости от вида треугольника может находиться как внутри, так и снаружи;
- медиана — линия, соединяющая вершину с серединой противолежащей стороны;
- пересечение медиан является точкой его тяжести, находится внутри фигуры;
- биссектриса — линия, проходящая от вершины до точки пересечения с противолежащей стороной, точка пересечения трех биссектрис является центром вписанной окружности.
Простые истины о треугольниках
Треугольники, как, собственно, и все фигуры, имеют свои особенности и свойства. Как уже говорилось, эта фигура является простейшим многоугольником, но со своими характерными признаками:
- против самой длинной стороны всегда лежит угол с большей величиной, и наоборот;
- против равных сторон лежат равные углы, пример тому — равнобедренный треугольник;
- сумма внутренних углов всегда равна 180°, что уже было продемонстрировано на примере;
- при продлении одной стороны треугольника за его пределы образуется внешний угол, который всегда будет равен сумме углов, с ним не смежных;
- любая из сторон всегда меньше суммы двух других сторон, но больше их разницы.
Виды треугольников
Следующий этап знакомства заключается в определении группы, к которой относится представленный треугольник. Принадлежность к тому или иному виду зависит от величин углов треугольника.
- Равнобедренный — с двумя равными сторонами, которые называют боковыми, третья в этом случае выступает основанием фигуры. Углы у основания такого треугольника одинаковы, а медиана, проведенная из вершины, является биссектрисой и высотой.
- Правильный, или равносторонний треугольник, — это тот, у которого все его стороны равны.
- Прямоугольный: один из его углов равен 90°. В этом случае сторона, противолежащая этому углу, называется гипотенузой, а две другие — катетами.
- Остроугольный треугольник — все углы меньше 90°.
- Тупоугольный — один из углов больше 90°.
Равенство и подобие треугольников
В процессе обучения не только рассматривают отдельно взятую фигуру, но и сравнивают два треугольника. И эта, казалось бы, простая тема имеет массу правил и теорем, по которым можно доказать что рассматриваемые фигуры — равные треугольники. Признаки равенства треугольников имеют такое определение: треугольники равны, если их соответствующие стороны и углы одинаковы. При таком равенстве, если наложить эти две фигуры друг на друга, все их линии сойдутся. Также фигуры могут быть подобными, в частности, это касается практически одинаковых фигур, отличающихся лишь величиной. Для того чтобы сделать такое заключение о представленных треугольниках, необходимо соблюдение одного из следующих условий:
- два угла одной фигуры равны двум углам другой;
- две стороны одного пропорциональны двум сторонам второго треугольника, а величины углов, образованных сторонами, равны;
- три стороны второй фигуры такие же, как и у первой.
Конечно, для бесспорного равенства, которое не вызовет ни малейшего сомнения, необходимо иметь одинаковые значения всех элементов обеих фигур, однако с использованием теорем задача значительно упрощается, и для доказательства равенства треугольников допускается наличие лишь нескольких условий.
Первый признак равенства треугольников
Задачи по этой теме решаются на основе доказательства теоремы, которая звучит так: «Если две стороны треугольника и угол, который они образуют, равны двум сторонам и углу другого треугольника, то и фигуры тоже равны между собой».
Как же звучит доказательство теоремы про первый признак равенства треугольников? Всем известно, что два отрезка равны, если они одной длины, или окружности равны, если имеют одинаковый радиус. А в случае с треугольниками есть несколько признаков, имея которые, можно предположить, что фигуры идентичны, что очень удобно использовать при решении разных геометрических задач.
Как звучит теорема «Первый признак равенства треугольников», описано выше, а вот ее доказательство:
- Допустим, треугольники АВС и А 1 В 1 С 1 имеют одинаковые стороны АВ и А 1 В 1 и, соответственно, ВС и В 1 С 1 , а углы, которые образуются этими сторонами, имеют одну и ту же величину, то есть равны. Тогда, наложив △ ABC на △ А 1 В 1 С 1, получим совпадение всех линий и вершин. Отсюда вытекает, что эти треугольники абсолютно идентичны, а значит, равны между собой.
Теорему «Первый признак равенства треугольников» называют еще «По двум сторонам и углу». Собственно, в этом и заключается ее суть.
Теорема о втором признаке
Второй признак равенства доказывается аналогично, доказательство основывается на том, что при наложении фигур друг на друга они полностью совпадают по всем вершинам и сторонам. А звучит теорема так: «Если одна сторона и два угла, в образовании которых она участвует, соответствуют стороне и двум углам второго треугольника, то эти фигуры идентичны, то есть равны».
Третий признак и доказательство
Если как 2, так и 1 признак равенства треугольников касался как сторон, так и углов фигуры, то 3-й относится лишь к сторонам. Итак, теорема имеет следующую формулировку: «Если все стороны одного треугольника равны трем сторонам второго треугольника, то фигуры идентичны».
Чтобы доказать эту теорему, нужно более детально углубиться в само определение равенства. По сути, что означает выражение «треугольники равны»? Идентичность говорит о том, что если наложить одну фигуру на другую, все их элементы совпадут, это может быть только в том случае, когда их стороны и углы будут равны. В то же время угол, противолежащий одной из сторон, которая такая же, как у другого треугольника, будет равен соответствующей вершине второй фигуры. Следует отметить, что в этом месте доказательство легко перевести на 1 признак равенства треугольников. В случае если такая последовательность не наблюдается, равенство треугольников просто невозможно, за исключением тех случаев, когда фигура является зеркальным отражением первой.
Прямоугольные треугольники
В строении таких треугольников всегда есть вершины с величиной угла 90°. Поэтому справедливы следующие утверждения:
- треугольники с прямым углом равны, если катеты одного идентичны катетам второго;
- фигуры равны, если равны их гипотенузы и один из катетов;
- такие треугольники равны, если их катеты и острый угол идентичны.
Этот признак относится к Для доказательства теоремы применяют приложение фигур друг к другу, в результате которого треугольники складывают катетами так, чтобы из двух прямых вышел со сторонами СА и СА 1 .
Практическое применение
В большинстве случаев на практике применяется первый признак равенства треугольников. На самом деле такая, казалось бы, простая тема 7 класса по геометрии и планиметрии используется и для вычисления длины, например, телефонного кабеля без замеров местности, по которой он будет проходить. При помощи этой теоремы легко сделать необходимые расчеты для определения длины острова, находящегося посреди реки, не переплывая на него. Либо укрепить забор, расположив планку в пролете так, чтобы она делила его на два равных треугольника, или же рассчитать сложные элементы работы в столярном деле, или при расчете стропильной системы крыши во время строительства.
Первый признак равенства треугольников имеет широкое применение в реальной «взрослой» жизни. Хотя в школьные годы именно эта тема для многих кажется скучной и совершенно ненужной.
1) по двум сторонам и углу между ними
Доказательство:
Пусть у треугольников АВС и А 1 В 1 С 1 угол A равен углу А 1 , АВ равно А 1 В 1, АС равно А 1 С 1 . Докажем, что треугольники равны.
Наложим треугольник ABC (либо симметричный ему) на треугольник A 1 B 1 C 1 так, чтобы угол A совместился с углом A 1 . Так как АВ=А 1 В 1 , а АС=А 1 С 1 , то B совпадёт с В 1 , а C совпадёт с С 1. Значит, треугольник А 1 В 1 С 1 совпадает с треугольником АВС, а следовательно, равен треугольнику АВС.
Теорема доказана.
2) по стороне и прилежащим к ней углам
Доказательство:
ПустьАВС и А 1 В 1 С 1 — два треугольника, у которых АВ равно А 1 В 1, угол А равен углу А 1 , и угол В равен углу В 1 . Докажем, что они равны.
Наложим треугольник ABC (либо симметричный ему) на треугольник A 1 B 1 C 1 так, чтобы AB совпало с A 1 B 1. Так как ∠ВАС =∠В 1 А 1 С 1 и ∠АВС=∠А 1 В 1 С 1 , то луч АС совпадёт с А 1 С 1 , а ВС совпадёт с В 1 С 1 . Отсюда следует, что вершина C совпадёт с С 1. Значит, треугольник А 1 В 1 С 1 совпадает с треугольником АВС, а следовательно, равен треугольнику АВС.
Теорема доказана.
3) по трём сторонам
Доказательство :
Рассмотрим треугольники ABC и A l B l C 1, у которых АВ=А 1 В 1 , BC = B l C 1 СА=С 1 А 1. Докажем, что ΔАВС =ΔA 1 B 1 C 1 .
Приложим треугольник ABC (либо симметричный ему) к треугольнику A 1 B 1 C 1 так, чтобы вершина А совместилась с вершиной A 1 , вершина В — с вершиной В 1 , а вершины С и С 1 , оказались по разные стороны от прямой А 1 В 1 . Рассмотрим 3 случая:
1) Луч С 1 С про-ходит внутри угла А 1 С 1 В 1 . Так как по условию теоремы стороны АС и A 1 C 1 , ВС и В 1 С 1 равны, то треугольники A 1 C 1 C и В 1 С 1 С — равнобедренные . По теореме о свойстве углов равнобедренного треугольника ∠1 = ∠2, ∠3 = ∠4, поэтому ∠ACB=∠A 1 C 1 B 1 .
2) Луч С 1 С совпадает с одной из сторон этого угла. A лежит на CC 1 . AC=A 1 C 1 , BC=B 1 C 1 , C 1 BC — равнобедренный , ∠ACB=∠A 1 C 1 B 1 .
3) Луч C 1 C проходит вне угла А 1 С 1 В 1 . AC=A 1 C 1 , BC=B 1 C 1 , значит, ∠1 = ∠2, ∠1+∠3 = ∠2+∠4, ∠ACB=∠A 1 C 1 B 1 .
Итак, AC=A 1 C 1 , BC=B 1 C 1 , ∠C=∠C 1 . Следовательно, треугольники ABC и A 1 B 1 C 1 равны по
первому признаку равенства треугольников.Теорема доказана.
2. Деление отрезка на n равных частей.
Провести луч через A, отложить на нём n равных отрезков. Через B и A n провести прямую и к ней параллельные через точки A 1 — A n -1. Отметим их точки пересечения с AB. Получим n отрезков, которые равны по теореме Фалеса.
Теорема Фалеса. Если на одной из двух прямых отложить последовательно несколько равных отрезков и через их концы провести параллельные прямые, пересекающие вторую прямую, то они отсекут на второй прямой равные между собой отрезки.
Доказательство. AB=CD
1. Проведём через точки A и C прямые, параллельные другой стороне угла. Получим два параллелограмма AB 2 B 1 A 1 и CD 2 D 1 C 1 . Согласно свойству параллелограмма : AB 2 = A 1 B 1 и CD 2 = C 1 D 1 .
2. ΔABB 2 =ΔCDD 2 ABB 2 CDD 2 BAB 2 DCD 2 и равны на основании второго признака равенства треугольников:
AB = CD согласно условию теоремы,
как соответственные, образовавшиеся при пересечении параллельных BB 1 и DD 1 прямой BD.3. Аналогично каждый из углов и оказывается равным углу с вершиной в точке пересечения секущих. AB 2 = CD 2 как соответственные элементы в равных треугольниках.
4. A 1 B 1 = AB 2 = CD 2 = C 1 D 1
Разработка урока по математике, 5 класс
Учитель математики
Куртушан Марина Анатольевна2011-2012 уч.год
Дата:_________________
Тема: Урок – повторение «Действия над обыкновенными дробями»
Цель: -обобщение и систематизация знаний по теме: «Обыкновенная дробь. Действия над обыкновенными дробями».
Задачи:
Обучающие : обобщение и систематизация знаний; развитие познавательных способностей;
развивающие : развитие интереса к предмету, математической грамотности, расширение кругозора учащихся;
воспитательные : воспитание ответственности за порученное дело, чувство коллективизма, товарищества.Тип урока : урок –игра.
Орг.момент.
Пусть каждый и каждый час
Вам новое добудет.
Пусть добрым будет ум у Вас,
А сердце умным будет.
С.Маршак.Здравствуйте, ребята, садитесь. 1,2,3,4… с этим мы вступаем в страну чисел. Она не имеет границ. За числами — сама жизнь. Для человека очень важно подружиться с числом и уметь с ним работать. Итак, мы с вами отправляемся в путешествие, в страну «Дробей». Все ли готовы? Всем ли удобно? Ну тогда поехали.
1 станция «Теоретическая»
- Дробь называется правильной, если …
- Чтобы сравнить две дроби с одинаковыми знаменателями, нужно…
- При сравнении дробей с разными знаменателями, нужно …
- Чтобы сложить две дроби с одинаковыми знаменателями, нужно…
- При вычитании дробей с разными знаменателями, надо…
- Как из неправильной дроби сделать смешанное число?
- Чтобы умножить дробь на дробь, надо…
- Чтобы разделить дробь на дробь, надо…
2 станция «Смекалкино»Для решения многих задач недостаточно одних знаний. Необходима еще внимательность и смекалка. А сейчас мы с вами и проверим кто из вас самый внимательный. Внимание на доску.
3 станция «Спортивная»
Задачка на внимание, умение, терпение,
А также вычитание, деленье, умножение.Две пары цифровых боксеров,
Однажды встретились в финале.
И ты узнать сумеешь скоро,
По сколько все очков набрали,
Какие заняли места?
Задача в общем-то проста,
Но, чтоб очки те подсчитать.
Необходимо лишь узнать,
В каком бою их умножали,
В каком делили, вычитали…
А результат вписать в кружки,
Где не проставлены очки.Итак, внимательно посмотрите на боксеров, какие математические действия были выполнены? Решите и запишите ответы.
4 станция «Вычислялкино»
Выполнить умножение:Выполните деление:
3. Задача.
Сторона треугольника равны Найдите периметр.
4. Задача.
Айман и Шолпан собрали 48 яблок. Количество яблок, собранных Айман, в раза больше, чем количество яблок, собранных Шолпан. Сколько яблок собрала Шолпан? Решите задачу, составив уравнение.
Подведение итогов.
1)Оценивание степени участия каждого ученика.
2)Подсчитывание жетонов.
3)Выставление оценок.
Все сегодня молодцы. Каждый получает мини-грамоту за сегодняшний урок.
При вычитании дробей с разными знаменателями, нужно… Чтобы умножить дробь на дробь, надо… Чтобы разделить дробь на дробь, надо…
2 станция Смекалкино
Сколько будет, если 2 десятка умножить на 3 десятка? 600 Тройка лошадей пробежала 30 км. По сколько км пробежала каждая лошадь? 30 км. На лесопильном заводе каждую минуту машина отпиливает кусок в 1 м. Через сколько минут она распилит бревно в 6 метров? 5 минут Мотоциклист ехал в деревню и встретил 3 машины и грузовик. Сколько всего машин ехало в поселок? 1 мотоциклист
3 станция Спортивная
4 станция Вычислялкино
Выполните действия 1
Самостоятельная работа Задача №
Домашнее задание № 916; № 921.
Thales | Природа математики
Фалес Милетский (624 — 546 до н.э.)
Фалес Милетский был одним из семи мудрецов Греции и считался Аристотелем первым философом греческой традиции. Философ двадцатого века Бертран Рассел идет дальше и говорит, что западная философия начинается с Фалеса. Насколько нам известно, Фалес был первым математиком, который увидел необходимость дедуктивного мышления.Другие жители древнего мира, например вавилоняне и египтяне, несомненно, знали некоторые жемчужины геометрии и хорошо использовали их в технике и промышленности. Однако именно Фалес хотел доказать эти факты, используя дедуктивные рассуждения — начиная с набора аксиом и делая выводы посредством дедукции. Фалес также хотел понять мир не через мифологию, а через человеческий разум. Его часто ассоциируют с фразой «Все есть вода». Для современного уха это звучит абсурдно и чрезмерно упрощенно.Однако мы также можем рассматривать это выражение как означающее, что мир может быть понят людьми с помощью нескольких основных принципов. Это был огромный отход от мышления древнего мира. К сожалению, мы не можем прочитать ни одно из оригинальных произведений Фалеса, поскольку они были потеряны во времени. Все, что мы знаем о нем и его трудах, мы получили от других греческих философов. Узнайте больше о Thales.
Ниже приведены четыре элементарных факта, которые мы все узнаем в старшей школе и которые приписываются Фалесу — хотя есть некоторые споры о том, какой из этих фактов Фалес на самом деле подробно доказал (см. Книгу Хита, A History of Greek Mathematics, Vol I , где является частью назначенного чтения).Эти факты были известны другим гораздо раньше, но Фалес видел необходимость поставить эти факты на прочное основание, то есть доказать их!
- Круг любого диаметра делится на две равные части.
- Углы при основании равнобедренного треугольника равны .
- Когда две прямые линии пересекаются, противоположные углы равны.
- Два треугольника равны, если у них одна сторона и два угла равны.
Следующая теорема о подобных треугольниках, которую изучают в средней школе, также приписывается Фалесу.
Теорема : Рассмотрим следующий треугольник ABC вместе с отрезком DE, параллельным BC. Тогда | AB | / | AD | = | AC | / | AE |.
Доказательство: Ссылка. Я прилагаю доказательства ниже.
Проведите отрезок от B до E, а другой от C до E. Затем нарисуйте отрезок от E до F, перпендикулярный AB, и другой отрезок от D до G, перпендикулярный AC.См. Рисунок ниже.
Площадь (ADE) = 1/2 | AD | | EF | = 1/2 | AE | | DG | (базовое умножение на высоту)
Площадь (BDE) = 1/2 | BD | | EF |
Площадь (CDE) = 1/2 | CE | DG |
Таким образом, Area (ADE) / Area (BDE) = | AD | / | BD | (1)
и Площадь (ADE) / Площадь (CDE) = | AE | / | CE | (2)
Также обратите внимание, что
Площадь (BDE) = Площадь (CDE) (3)
, поскольку эти два треугольника имеют одно и то же основание DE и, поскольку DE || До н.э. они имеют одинаковую высоту.
Комбинируя уравнения (1), (2), (3), видим, что
| AD | / | BD | = | AE | / | CE |
Перевернув обе стороны, получаем
| BD | / | AD | = | CE | / | AE |
и так, прибавив 1 к обеим сторонам, получим
| BD | / | AD | + | AD / | AD | = | CE | / | AE | + | AE | / | AE |
, что означает, что
(| BD | + | AD |) / | AD | = (| CE | + | AE |) / | AE |
Но это означает, что
| AB | / | AD | = | AC | / | AE |
QED.
Вот еще одна жемчужина Фалеса.
Теорема : Если AC — диаметр окружности, а B — любая другая точка на окружности (кроме A или C), то угол ABC является прямым углом.
Проба : Рассмотрим следующий рисунок:
Поскольку OB = OC (поскольку все они являются радиусами одного круга), то треугольник OBC является равнобедренным треугольником, и поэтому, согласно одному из более ранних результатов Thales, углы OBC и OCB равны.Поскольку OB = OA, то, опять же, согласно предыдущей теореме Фалеса, углы OAB и ABO равны. Поскольку сумма углов треугольника, в частности треугольника ABC, должна составлять в сумме 180 градусов, должно быть так, что a + (a + b) + b = 180. Это означает, что 2 a + 2 b = 180 , или, что то же самое, a + b = 90. Это показывает, что угол в вершине B равен 90 градусам. QED .
Конечно, в доказательстве этой теоремы отсутствует доказательство того факта, что (внутренние) углы любого треугольника в сумме равны 180 градусам (или, на языке Фалеса, «суммируются с двумя прямыми углами»).Вот доказательство этого драгоценного камня: обозначьте углы вашего треугольника A, B, C и нарисуйте параллельные линии L и M на изображении ниже
.Теперь используйте некоторые основные факты об углах (заполните детали), и вы увидите, что A + B + C образуют угол 180 градусов на приведенном выше рисунке.
Следует также отметить, что существует обратная теореме Фалеса.
Обратно к теореме Фалеса : гипотенуза прямоугольного треугольника — это диаметр его описанной окружности.
Доказательство : возьмите прямоугольный треугольник и переверните его по диагонали, чтобы получился параллелограмм.Обратите внимание, что две диагонали будут делить друг друга пополам. Точка пересечения этих двух диагоналей будет центром описанной окружности — очевидно, с гипотенузой в качестве диагонали. QED .
Вот красивое следствие этой теоремы, которое говорит нам, как построить касательную к окружности, используя только линейку и циркуль. Мы поговорим об этом гораздо больше в разделах о делении угла пополам и тройном пересечении углов позже или. Сейчас просто вспомните, как делить угол пополам с помощью линейки и циркуля.Возможно, вам придется просмотреть свои школьные заметки.
Следствие : Учитывая окружность C и точку P вне окружности, можно построить, используя только линейку и циркуль, касательную к этой окружности, которая проходит через точку P.
Proo f:
Проведите линию от центра O окружности C к точке P. Теперь, используя линейку и циркуль, проведите среднюю точку M линии OP. Теперь нарисуйте круг с центром в M.Таким образом, окружность будет пересекать исходную окружность C в некоторой точке T. По теореме Фалеса (той, которую мы только что сделали) треугольник OTP имеет прямой угол в T. По определению касательной это означает, что прямая PT касается нашей исходный круг C. QED .
Мы закончим наш визит Фалесом с помощью приписываемого ему красивого приложения, которое определяет расстояние от позиции на суше до корабля в море. Предположим, мы находимся на суше в позиции A, а корабль выходит в море в позиции B.
Как найти расстояние от A до B.Вот оригинальный способ сделать это.
–Выберите точку D (на берегу) так, чтобы AD был перпендикулярен AB. Базовая конструкция линейки и компаса говорит, что мы можем это сделать.
–Выберите точку E (снова на берегу) так, чтобы ED была перпендикулярна AB. Опять же, базовая конструкция линейки и компаса говорит, что мы можем это сделать.
–Найти среднюю точку M AD. Опять же, линейка и компас.
— Линия, проходящая через M и B, будет проходить через некоторую точку P на прямой ED.
–Рассмотрим треугольники PDM и MBA. Эти треугольники имеют прямые углы в точках D и A. По Фалесу, эти треугольники имеют равные углы в вершине M. Поскольку M — середина DA, DM = MA. Таким образом, снова по Фалесу, эти два треугольника совпадают.
–Таким образом, расстояние от A до B (то, которое мы хотим вычислить) — это расстояние от P до D (которое мы можем измерить).
Вот рисунок, чтобы было понятнее.
Нравится:
Нравится Загрузка…
Теорема Фалеса — объяснение и примеры
После того, как мы изучили теорему о вписанном угле, пришло время изучить другую связанную теорему, которая является частным случаем теоремы о вписанном угле м, , называемой теоремой Фалеса . Как и теорема о вписанном угле, ее определение также основано на диаметре и углах внутри круга.
Из этой статьи вы узнаете:
- Теорема Фалеса,
- Как решить теорему Фалеса; и
- Как решить теорему Фалеса только с одной стороной
Что такое теорема Фалеса?
Теорема Фалеса утверждает, что:
Если три точки A, B и C лежат на окружности окружности, при этом прямая AC является диаметром окружности, тогда угол 000 ABC — прямой угол (90 °).
В качестве альтернативы мы можем сформулировать теорему Фалеса как:
Диаметр круга всегда образует прямой угол с любой точкой на окружности.
Вы заметили, что теорема Фалеса является частным случаем теоремы о вписанном угле (центральный угол = удвоенный вписанный угол).
Теорема Фалеса приписывается Фалесу, греческому математику и философу, который жил в Милете.Фалес первым инициировал и сформулировал теоретическое изучение геометрии, чтобы сделать астрономию более точной наукой.
Есть различных способов доказать теорему Фалеса . Мы можем использовать методы геометрии и алгебры, чтобы доказать эту теорему. Поскольку это тема геометрии, давайте рассмотрим самый простой метод ниже.
Как решить теорему Фалеса?
- Чтобы доказать теорему Фалеса, нарисуйте серединный перпендикуляр к ∠
- Пусть точка M будет средней точкой прямой AC.
- Также пусть ∠ MBA = ∠ BAM = β и ∠ MBC = ∠ BCM = α
- Линия AM = MB = MC = радиус окружности.
- Δ AMB и Δ MCB — равнобедренные треугольники.
По теореме о сумме треугольников
∠ BAC + ∠ ACB + ∠ CBA = 180 °
β + β + α + α = 180 °
Разложите уравнение на множители.
2 β + 2 α = 180 °
2 (β + α) = 180 °
Разделим обе стороны на 2.
β + α = 90 °.
Следовательно, ABC = 90 °, следовательно, доказано
Давайте решим несколько примеров задач, связанных с теоремой Фалеса.
Пример 1
Учитывая, что точка O является центром окружности, показанной ниже, найдите значение x.
Решение
Учитывая, что прямая XY является диаметром окружности, тогда по теореме Фалеса
∠ XYZ = 90 °.
Сумма внутренних углов треугольника = 180 °
90 ° + 50 ° + x = 180 °
Упростить.
140 ° + x = 180 °
Вычтите 140 ° с обеих сторон.
x = 180 ° — 140 °
x = 40 °.
Итак, значение x равно 40 градусам.
Пример 2
Если точка D является центром окружности, показанной ниже, вычислите диаметр окружности.
Решение
По теореме Фалеса треугольник ABC является прямоугольным, где ∠ ACB = 90 °.
Чтобы найти диаметр круга, примените теорему Пифагора.
CB 2 + AC 2 = AB 2
8 2 + 6 2 = AB 2
64 + 36 = AB 2
100 = AB 2 2 2 2
AB = 10
Следовательно, диаметр круга равен 10 см.
Пример 3
Найдите величину угла PQR в круге, показанном ниже.Предположим, что точка R является центром круга.
Решение
Треугольник RQS и PQR являются равнобедренными треугольниками.
∠ RQS = ∠ RSQ = 64 °
По теореме Фалеса ∠ PQS = 90 °
Итак, ∠ PQR = 90 ° — 64 °
= 26 °
Следовательно, величина угла PQR равна 26 °.
Пример 4
Какое из следующих утверждений верно относительно определения теоремы Фалеса?
A. Центральный угол в два раза больше вписанного угла
B. Угол, вписанный в полукруг, будет прямым углом.
C. Диаметр круга — самая длинная хорда.
D. Диаметр окружности в два раза больше радиуса.
Решение
Правильный ответ:
B.Угол, вписанный в полукруг, будет прямым углом.
Пример 5
В круге, показанном ниже, линия AB представляет собой диаметр круга с центром C .
- Найдите размер ∠ г. до н. Э.
- ∠ DCA
- ∠ ACE
- ∠ DCB
Решение
Данный треугольник ACE — равнобедренный треугольник,
∠ CEA13 = 33 °
Итак, ∠ ACE = 180 ° — (33 ° + 33 °)
∠ ACE = 114 °
Но углы на прямой = 180 °
Следовательно, ∠ BCE = 180 ° — 114 °
= 66 °
Треугольник ADC — равнобедренный треугольник, поэтому ∠ DAC = 20 °
По теореме суммы треугольников DCA = 180 ° — (20 ° + 20 °)
∠ DCA = 140 °
∠ DCB = 180 ° — 140 °
= 40 °
Пример 6
Какой размер ∠ ABC ?
Решение
Теорема Фалеса утверждает, что BAC = 90 °
И по теореме суммы треугольников
∠ ABC + 40 ° + 90 ° = 180 °
∠ ABC = 180 ° — 130 °
= 50 °
Пример 7
Найдите длину AB в круге, показанном ниже.
Решение
Треугольник ABC — это прямоугольный треугольник.
Примените теорему Пифагора, чтобы найти длину AB .
AB 2 + 12 2 = 18 2
AB 2 + 144 = 324
AB 2 = 324 — 144
5 2 AB 90 = 180AB = 13,4
Следовательно, длина AB равна 13.4 см.
Приложения теоремы Фалеса
В геометрии ни одна из тем не обходится без реального использования. Следовательно, теорема Фалеса также имеет некоторые приложения:
- Мы можем точно провести касательную к окружности, используя теорему Фалеса. Для этого можно использовать установленный угольник.
- Мы можем точно найти центр круга, используя теорему Фалеса. Инструменты, используемые для этого приложения, представляют собой квадрат и лист бумаги. Во-первых, вы должны разместить угол на окружности — пересечение двух точек с окружностью определяет диаметр.Вы можете повторить это, используя другую пару точек, что даст вам другой диаметр. Пересечение диаметров даст вам центр круга.
Все о математике Фалесе
Математика — это предмет, который часто поднимается в дебатах об образовательном секторе, где она постоянно является одним из предметов, в котором школьники борются больше всего. Это считается важным шагом в академической карьере учащихся, где Ожидается, что студенты будут ежегодно укреплять свои знания, чтобы добиться успеха и понять новые математические понятия.Что входит в структуру и что лежит в основе этой дисциплины? Косинусы, обратные числа, дроби, четырехугольники, относительные числа, окружности, симметрия, касательные, неравенства — пересмотр курсов математики может стать менее напряженным , если смотреть на это через призму истории. Один из многих прекрасных примеров — великий ученый и математик Фалес. Ознакомьтесь с его историей, чтобы разблокировать некоторые стратегические концепции, с которыми вы, возможно, боретесь, и улучшить свои возможности в них!
Доступны лучшие репетиторы по математике
1 st урок бесплатно!
5 (9 отзывов)
1 st урок бесплатно!
5 (6 отзывов)
Dr.Мария (профессиональный репетитор)
1 ул занятие бесплатно!
5 (15 отзывов)
1 st урок бесплатно!
5 (8 отзывов)
1 st урок бесплатно!
5 (1 отзывов)
1 st урок бесплатно!
5 (6 отзывов)
1 st урок бесплатно!
5 (5 отзывов)
1 st урок бесплатно!
5 (1 отзывов)
1 st урок бесплатно!
5 (9 отзывов)
1 st урок бесплатно!
5 (6 отзывов)
Dr.Мария (профессиональный репетитор)
1 ул занятие бесплатно!
5 (15 отзывов)
1 st урок бесплатно!
5 (8 отзывов)
1 st урок бесплатно!
5 (1 отзывов)
1 st урок бесплатно!
5 (6 отзывов)
1 st урок бесплатно!
5 (5 отзывов)
1 st урок бесплатно!
5 (1 отзывов)
Первый урок бесплатноФалес Милетский: жизнь математика
В жизни студента-математика есть два имени, которые невозможно забыть: Пифагор и Фалес.Последний, согласно историческим текстам, профессор первого, был философом, родившимся в Милете около 625 г. до н. Э. Удачно названный, греческий философ Фалес Милетский считается одним из семи мудрецов Древней Греции, наряду с другими греческими философами: Солоном, Хилоном Спарты, Питтаком Митиленским, Биасом Приенским, Клеобулом Линдосским и Периандром Коринфским . Основатель школы милетцев, Фалес начал свою академическую карьеру как философ и ученый, отправившись в Египет в очень молодом возрасте благодаря хорошим отношениям, которые существовали между страной и его родным городом Милетом.Именно там молодой Фалес открыл знания египетских и вавилонских наук. Оказавшись там, он изучил геометрию, астрономию и философию — все знания, которые были основной частью образовательной подготовки египетских священников. По словам древнегреческих историков, эта поездка в Египет составляет , что не подтверждается данными . Фактически, только некоторые записи, написанные спустя годы после смерти Фалеса, смогли подтвердить жизнь ученого и поместить его в Египет в то время.Достигнув совершеннолетия, Фалес вернулся в греческий город Милет, чтобы создать Школу милетцев. Фалес использовал свое положение для распространения своих знаний в области математики и греческой философии, продолжая при этом проводить наблюдения и научные эксперименты. На протяжении всей своей жизни Фалес использовал свои наблюдения, чтобы понять, как устроен мир. Согласно легенде, он вычислил высоту великой пирамиды, помог предсказать лунное и солнечное затмения и применил на практике теоремы Фалеса.Узнайте об онлайн-курсах математики.
Древняя Греция, и особенно Милет, оказали глубокое влияние на западную философию.Считается, что его математические и научные исследования произвели революцию во времени. Считающийся мудрецом, Фалес всегда гордился тем, что объяснял свои открытия с рациональной точки зрения , а не мифологической , это было традицией в то время. Для него процесс наблюдения и создания доказательств был основой научных рассуждений.Согласно некоторым отчетам, написанным через много лет после его смерти, Фалес умер около 547 г. до н.э. в Милете во время участия в гимнастических соревнованиях. Найденный на трибуне, он, очевидно, умер от голода, жажды и возраста. Среди других великих математиков и философов из этой области — Архимеда!
Как Фалес повлиял на курсы математики
Все слышали и даже узнали многие из теорем, открытых Фалесом. Фалес был первым, кто обозначил в истории математики , создав свою научную формулу и принцип.Вот пять геометрических теорем, которые ему приписывают:
- Окружность делится пополам на диаметр
- Углы в треугольнике равны, если их противоположности — две стороны равной длины
- Пересекающиеся прямые образуют противоположные углы, которые равны равно
- Прямой угол и соответствующий ему прямоугольный треугольник можно нарисовать внутри и с использованием полукруга
- Если даны основание треугольника и два угла, треугольник можно нарисовать
Хотя сегодня это может показаться слишком простым, чтобы когда-либо считались революционными
, они действительно дают нам много информации и считались серьезным нововведением в то время.Теоремы Фалеса используются для вычисления определенных соотношений долготы и пропорций геометрических фигур, имеющих параллельные линии. Они также используются для вычисления многих понятий в тригонометрии, когда есть две параллельные линии. Согласно легенде, Фалес открыл эту теорему при вычислении высоты пирамиды. Для этого математик рассчитал тень пирамиды до пола. С помощью трости Фалес смог вычислить размеры пирамиды Египта по отношению к тени своей трости.Хотя Фалесу приписывают эти теоремы, они уже были известны вавилонянам и египтянам. Мы знаем это в первую очередь благодаря доказательству, приведенному в книге «Элементы Евклида», в которой рассматривается пропорциональность площадей треугольников одинаковой высоты. Однако Фалесу зачислили за то, что он поставил слова последнему. Фалес не получил во многих странах кредит за некоторые из своих теорем. Например, англичане называют одну из его теорем теоремой о перехвате, а немцы — теоремой о лучах.Однако все они не полностью идентичны и больше напоминают теорию Пифагора. История греческих математиков неполна без упоминания ФалесаФалес От математики к астрономии
На протяжении своей жизни Фалес использовал математику, чтобы понять важные понятия реальной жизни. Математические упражнения, простые числа, десятичные дроби, уравнения, медианы, вычитание, сложение, философия, архитектура — математика служила инструментом для понимания окружающего мира.В начале своей карьеры Фалес увлекся астрономией и анализом неба. Из-за этого он считается одним из пионеров греческой астрономии. Подобно своим исследованиям в области математики, Фалес использовал метод наблюдения созвездий, чтобы понять, как функционирует Вселенная. Он сделал много открытий в этих областях :
- Использовал маленькую ковшу, чтобы направлять моряков в открытый океан
- Рассчитал продолжительность года благодаря интервалам солнцестояния и равноденствий
- Указал путь сына между два тропика
- Перечислил эфемериды
Его открытия были лишь небольшой частью его наблюдений.В частности, он проанализировал количество дней в году и пришел к выводу, что год состоит не из 365 дней, а из 365 дней с кварталом. Это открытие позже станет базой високосных лет. Фалес также наблюдал звезды в движении, диаметр Солнца и Луны — и все это при использовании одной и той же системы измерения объектов относительно тени трости. Он также определил позицию Плеяд, вычислил угол наклона орбиты зодиака и т. Д. Благодаря своим наблюдениям Фалес также мог предсказать большой урожай оливок согласно Аристотелю.Он применил эти наблюдения за природой, чтобы объяснить, как функционирует мир, но чаще всего в итоге просто улучшал жизнь окружающих его людей . Например, благодаря ему моряки научились ориентироваться, а навигация улучшилась в десять раз. Астрономия и все связанные с ней области многим обязаны Фалесу, который был простым математиком. Чтобы узнать больше о том, как эти открытия повлияли на работу другого великого математика, Рене Декарта, щелкните здесь!
Фалес в контексте великих
Все открытия Фалеса оставили особый след в области математики.Арифметика, сложные функции, целые числа, многоугольники, умножение, факторизация, вероятность — его знания и открытия все еще преподаются в наши дни и на наших курсах математики, что делает Фалеса одним из крупнейших математиков истории.
Древняя философия находилась под влиянием таких мыслителей, как Фалес.Однако больше, чем его открытия, Фалес теоретизировал знаний, которые уже были установлены египтянами или вавилонянами. Математик не просто удовлетворился этими знаниями, изложенными в мифологических истинах, но попытался наблюдать и доказать все эти утверждения, с которыми он столкнулся во время своих занятий по математике.Таким образом Фалес сбивал своих современников с толку. В книге Жана Вуалкена научный французский редактор объяснил, что Фалес хотел «заменить мифологическое объяснение» явлений «физическим объяснением». Это то, что побуждает Вуалкина, наряду со многими другими, называть его «одним из предшественников греческой науки». Научное наследие Фалеса усиливается открытиями его Милетской школы. Их работа, получившая название милетской школы или «ионической школы», произвела революцию в области науки, и они стали известны как досократические философы.Его учение, характерное для Фалеса, благоприятствовало зрительному восприятию и наблюдению, чтобы привнести практичность в знания. Школа включала в себя в основном геометрию и астрономию, две любимые области Фалеса, но в школе также работали над предметами , такими как биология, физика и метафизика. Они были первыми студентами, которых назвали физиками, и они изучали все о природе. Ученики Милетской школы использовали такие понятия, как четыре элемента, для объяснения функции среды .Все эти исследования считаются первыми научными исследованиями природы и внесли неизгладимый вклад в науку. Фалес в древности обозначил не только область математики, но и историю науки в целом, вдохновляя работы даже сэра Исаака Ньютона. Для этого мы должны помнить его имя вместе с его достижениями.
Здесь можно найти хорошие уроки математики.
Фалес Милетский — Хронология математики — Матигон
c.300 г. до н. Э .: Индийский математик Пингала пишет о нуле, двоичных числах, числах Фибоначчи и треугольнике Паскаля.
г. 260 г. до н. Э .: Архимед доказывает, что π находится между 3,1429 и 3,1408.
г. 235 г. до н.э.: Эратосфен использует алгоритм сита для быстрого поиска простых чисел.
г. 200 г. до н. Э .: «Суан шу шу» (Книга о числах и вычислениях) — один из старейших китайских текстов по математике.
г. 100 г. н. Э.: Никомах ставит самую старую нерешенную проблему в математике: существуют ли какие-либо нечетные совершенные числа.
г. 250 г. н.э .: культура майя в Центральной Америке процветает, и в ней используется система счисления с основанием 20.
г. 830 г. н.э .: Аль-Хорезми издает «Китаб аль-джабр ва аль-мукабала», первую книгу об алгебре и тезку по ней.
1202: Liber Abaci Фибоначчи вводит арабские цифры в Европу, а также простую алгебру и числа Фибоначчи.
1482: Первое печатное издание «Элементов» Евклида
1545: Кардано задумал идею комплексных чисел.
1609: Кеплер публикует «Astronomia nova», в которой объясняет, что планеты движутся по эллиптическим орбитам.
1618: Napier публикует первые упоминания числа e в книге по логарифмам.
1637: Ферма утверждает, что доказал Великую теорему Ферма.
1654: Паскаль и Ферма развивают теорию вероятностей.
1684: Лейбниц публикует первую статью по исчислению.
1687: Ньютон издает «Основы математики», содержащие законы гравитации и движения, а также свою версию математического анализа.
1736: Эйлер решает проблему Кенигсбергских мостов, изобретая теорию графов.
1761: Ламберт доказывает, что π иррационально
1799: Гаусс доказывает основную теорему алгебры.
1829: Бойяи, Гаусс и Лобачевский изобретают гиперболическую неевклидову геометрию.
1832: Галуа находит общее условие для решения алгебраических уравнений, тем самым основывая теорию групп и теорию Галуа.
1858: Август Фердинанд Мебиус изобретает ленту Мебиуса.
1874: Кантор доказывает, что существуют разные «размеры» бесконечности и что действительные числа неисчислимы.
1895: Статья Пуанкаре «Analysis Situs» положила начало современной топологии.
1905: Эйнштейн объясняет фотоэлектрический эффект и броуновское движение, открывает специальную теорию относительности и E = mc².
1915: Нётер показывает, что каждый закон сохранения в физике соответствует симметрии Вселенной.
1931: Теорема Гёделя о неполноте устанавливает, что математика всегда будет неполной.
1939: Группа французских математиков издает свою первую книгу по теории множеств под псевдонимом Николя Бурбаки.
1961: Лоренц обнаруживает хаотическое поведение в моделировании погоды — эффект бабочки.
1976: Аппель и Хакен доказывают гипотезу четырех цветов с помощью компьютера.
1977: Адельман, Ривест и Шамир вводят криптографию с открытым ключом с использованием простых чисел.
1994: Эндрю Уайлс доказывает Великую теорему Ферма.
2000: Институт математики Клэя опубликовал семь задач Премии тысячелетия.
2003: Перельман доказывает гипотезу Пуанкаре, единственную из семи решенных на сегодняшний день проблем тысячелетия.
г. 9100 г. до н.э .: старейшее известное сельскохозяйственное поселение на Кипре.
г. 2030 г. до н.э.: шумерский город Ур — самый большой город в мире.
г. 3500 г. до н. Э .: Первые колесные машины появляются в Месопотамии и Восточной Европе.
г. 3200 г. до н.э .: первые системы письма появляются в Месопотамии, Египте и долине Инда.
г. 3000 г. до н.э .: первые свидетельства плавки железной руды для производства кованого железа.
г. 2560 г. до н.э .: Великая пирамида Гизы построена в Древнем Египте для фараона Хуфу.
г. 1754 г. до н.э .: вавилонский царь Хаммурапи издает Кодекс Хаммурапи, один из первых юридических документов.
776 г. до н.э .: первые Олимпийские игры проходят в Греции.
753 г. до н. Э.: Легендарная дата основания Рима.
г. 563 г. до н. Э .: Будда родился в Индии.Его учение стало основой буддизма.
г. 551 г. до н. Э .: Конфуций родился в Китае. Его учение стало основой конфуцианства.
490 г. до н.э .: Греция остановила персидское вторжение в битве при Марафоне. Начинается классический период.
432 г. до н.э .: Акрополь построен в Афинах, во время их золотого века при Перикле.
399 г. до н. Э.: Сократ приговорен к смерти, отказывается бежать и выпивает чашу яда.
327 г. до н.э .: Александр Великий вторгается в Индию, создав огромную империю по всей Азии.
г. 221 г. до н.э.: Цинь Шихуанди объединяет Китай и начинает строительство Великой стены.
146 г. до н. Э .: Римская армия разрушает Карфаген, положив конец Третьей Пунической войне.
44 г. до н. Э .: Юлий Цезарь убит.
4 г. до н. Э.: Иисус из Назарета родился в Вифлееме, утверждая христианство.
180 г. н. Э.: Смертью Марка Аврелия завершился Pax Romana, 200-летний период мира в Европе.
476 г. н.э .: падение Римской империи
570 г. н.э .: Мухаммад, основатель ислама, родился в Мекке.
г. 641 г. н.э .: Александрийская библиотека разрушена.
800 г. н.э .: Карл Великий коронован как первый император Священной Римской империи.
г. 870 г. н.э.: норвежские исследователи открывают и колонизируют Исландию.
1066: Вильгельм Завоеватель побеждает в битве при Гастингсе и становится королем Англии.
1088: Первый университет открыт в Болонье, Италия.
1096: Первый крестовый поход инициирован Папой Урбаном II.
1206: Чингисхан побеждает своих соперников и получает титул «Вселенский правитель монголов».
1215: король Англии Иоанн вынужден подписать Великую хартию вольностей, ограничивая его полномочия.
1266: Марко Поло прибывает ко двору Хубилай-хана в Пекине.
г. 1347 год: Черная смерть убивает миллионы людей по всей Европе.
1439: Иоганнес Гутенберг изобретает печатный станок.
1453 г .: Османские турки завоевывают Константинополь, отмечая падение Византийской империи.
1492: Христофор Колумб прибывает в Америку, начиная новую эру европейских завоеваний.
1517: Мартин Лютер публикует свои 95 тезисов, положив начало протестантской реформации.
1522: Экспедиция Фердинанда Магеллана облетает Землю.
1543: Польский ученый Николай Коперник пишет, что Земля вращается вокруг Солнца.
1588: При королеве Елизавете I Англия побеждает испанскую армаду.
1603: Впервые исполняется «Гамлет» Уильяма Шекспира.
1633: Католическая инквизиция судит Галилео Галилея за его научные труды.
1649: Король Карл I предан суду и обезглавлен во время Гражданской войны в Англии.
1756: Вольфганг Амадей Моцарт родился в Австрии.
г. 1765: Джеймс Ватт изобретает более эффективный паровой двигатель, который станет двигателем промышленной революции.
1776: Америка издает Декларацию независимости от Великобритании.
1789: Революционеры штурмуют Бастилию в Париже, начиная Французскую революцию.
1804: Наполеон становится императором Франции.
1819: Симон Боливар побеждает Испанию в битве при Бояке, что приводит к независимости многих стран Южной Америки.
1837: Сэмюэл Морс и другие разрабатывают электрические телеграфы.
1859: Чарльз Дарвин публикует «Происхождение видов», вводя естественный отбор.
1865: Авраам Линкольн убит в конце Гражданской войны в США.
1876: Александр Белл изобретает телефон.
1903: Братья Райт создают первый самолет с двигателем тяжелее воздуха.
1914: Франц Фердинанд из Австрии убит в Сараево, в начале Первой мировой войны.
1929: Обвал фондового рынка в «черный вторник» положил начало великой депрессии.
1939: Адольф Гитлер вторгается в Польшу, начиная Вторую мировую войну.
1953: Уотсон и Крик открывают двойную спиральную структуру ДНК.
1957: Советский Союз запускает в космос Спутник-1, первый искусственный спутник Земли.
1969: Астронавты «Аполлона-11» Нил Армстронг и Базз Олдрин приземляются и идут по Луне.
1975: Конец войны во Вьетнаме
1989: Тим Бернерс-Ли изобретает всемирную паутину.
Скрытая философия теоремы Пифагора
- Древние греки считали, что огонь, воздух, вода и земля являются четырьмя элементами Вселенной.
- Платон связал эти четыре элемента с трехмерными геометрическими телами.
- Пифагор мог полагать, что прямоугольный треугольник составляет основу всей реальности.
В диалоге Платона, Тимей , нам представлена теория о том, что космос построен из прямоугольных треугольников.
Это предложение Тимей делает после того, как напомнил своей аудитории [49Bff], что в более ранних теориях исходным материалом была «вода» (предложенная Фалесом), «воздух» (предложенная Анаксименом) или «огонь» (предложенная Гераклитом). из которых был создан весь космос, натолкнулся на возражение: если наш мир полон этих расходящихся проявлений, как мы можем идентифицировать какие-либо или из этих кандидатов в качестве основного материала? Ибо если есть огонь у плиты, жидкость в моей чашке, доступный для дыхания невидимый воздух и храмы из твердого камня — а все они, по сути, являются лишь одним фундаментальным предметом — как нам выбрать среди них, что является самым основным?
Космос с геометрией
Однако, если основное базовое единство, из которого состоит космос, оказывается прямоугольными треугольниками, то предлагаемая основополагающая структура — i.е., структура огня, земли, воздуха и воды — могла бы преодолеть это возражение. Вот что предлагает Тимей:
«Во-первых, конечно, для любого очевидно, что огонь, земля, вода и воздух суть тела; и все тела имеют объем. Кроме того, объем должен быть ограничен поверхность, и каждая прямолинейная поверхность состоит из треугольников. Теперь все треугольники образованы из двух [т. е. разностороннего и равнобедренного], каждый из которых имеет один прямой угол, а другой — острый … Это мы принимаем как первое начало огня и другие тела, следуя рассказу, сочетающему вероятность с необходимостью… »[Платон. Timaeus 53Cff]
Немного позже в этом диалоге Тимей предлагает далее, что из прямоугольных, разносторонних и равнобедренных треугольников строятся элементы — мы могли бы назвать их молекулами. Если мы разместим на плоской поверхности равносторонние треугольники, равносторонние прямоугольники (т. Е. Квадраты), равносторонние пятиугольники и т. Д., А затем определим, какие комбинации «складываются вверх», Платон покажет нам открытие пяти правильных тел — иногда называемых Платоновы тела.
Три, четыре и пять равносторонних треугольников сложатся вверх, а также три квадрата и три пятиугольника.
Если комбинация цифр вокруг точки дает четыре или более прямых угла, они будут , а не . На данный момент я оставлю додекаэдр (или комбинацию трех пятиугольников, составляющих «целое», в которое входят элементы), чтобы сосредоточиться на четырех элементах: тетраэдре (огонь), октаэдре (воздух), икосаэдре (вода). , и шестигранник (земля).
Все — прямоугольный треугольник
Теперь, чтобы уточнить аргумент [53C], я предлагаю показать с помощью диаграмм, как прямоугольный треугольник является фундаментальной геометрической фигурой.
Все фигуры можно разрезать на треугольники. (Это известно современным математикам как мозаика или мозаика с треугольниками.)
Внутри каждого вида треугольника — равностороннего, равнобедренного, разностороннего — есть два прямоугольных треугольника. В этом можно убедиться, опустив перпендикуляр из вершины на противоположную сторону.
Внутри каждого прямоугольного треугольника — если разделить от прямого угла — мы обнаружим два похожих прямоугольных треугольника, до бесконечности .Треугольники похожи, если они одинаковой формы, но разного размера.
Таким образом, мы приходим к предположению Тимея о том, что прямоугольный треугольник является фундаментальной геометрической фигурой в двух его разновидностях, разносторонней и равнобедренной, которые содержат внутри себя бесконечное разделение на подобные прямоугольные треугольники.
Итак, никто не может предположить, что космос состоит из прямоугольных треугольников без доказательства — убедительной аргументации — чтобы показать, что прямоугольный треугольник является фундаментальной геометрической фигурой.Тимей происходит из Локров, южной Италии, региона, куда эмигрировал Пифагор и жили Эмпедокл и Алкмаон. Пифагорейцы, вероятно, являются источником вдохновения в этом отрывке, но не в двух других. Какое известное в то время доказательство показало, что это был прямоугольный треугольник? Может быть, это была теорема Пифагора?
Теорема Пифагора выходит за рамки квадратов
Теперь мы знаем, что существует более 400 различных доказательств знаменитой теоремы. Показывает ли один из них, что прямоугольный треугольник является основной геометрической фигурой? Будьте уверены, это не может быть a² + b² = c², потому что это алгебра, а у греков алгебры не было! Более многообещающий источник — доказательство аналогичными прямоугольными треугольниками — это доказательство, сохранившееся на VI.31.
Обратите внимание, что на сторонах прямоугольного треугольника вообще нет фигур. (На приведенном выше рисунке прямой угол находится в точке «A»). На диаграмме показано, что внутри каждого прямоугольного треугольника находятся два одинаковых прямоугольных треугольника, навсегда разделенных.
Сегодня теорема Пифагора преподается с использованием квадратов.
Но теорема Пифагора не имеет ничего общего с квадратами! Квадраты — это лишь частный случай. Теорема верна для всех фигур, одинаковых по форме и нарисованных пропорционально.
Итак, почему упор на квадраты? Потому что в древнегреческом мире пропорциональную шкалу было трудно произвести точно и трудно было подтвердить, а подтверждение приходилось получать эмпирически. Но квадраты устраняют вопрос о пропорциональном масштабировании.
Пифагор и философия космологии
У нас есть древнее сообщение о том, что после его доказательства Пифагор принес большую ритуальную жертву, возможно, сотню быков. Что именно было его открытием, заслуживающим такого огромного жеста?
Может ли этот обзор помочь нам начать понимать метафизический смысл теоремы о гипотенузе, а именно: то, что прославлялось, было не просто доказательством того, что площадь квадрата на гипотенузе прямоугольного треугольника равна сумме площади квадратов на двух других сторонах, но, кроме того, было ли доказательством того, что фундаментальной фигурой, из которой был построен весь космос, был прямоугольный треугольник?
Проф.Роберт Хан имеет широкие интересы в истории древней и современной астрономии и физики, древних технологиях, вкладе Древнего Египта и монументальной архитектуры в раннюю греческую философию и космологию, а также в древней математике и геометрии Египта и Греции. Каждый год он проводит выездные семинары « Древнего наследия » в Грецию, Турцию и Египет. Его последняя книга — Метафизика теоремы Пифагора .
Статьи с вашего сайта
Статьи по теме в Интернете
Файл: Теорема Фалеса 2.png — Wikimedia Commons
Резюме [править]
Это математическое изображение может быть воссоздано с использованием векторной графики в виде файла SVG . У этого есть несколько преимуществ; см. Commons: Media для очистки для получения дополнительной информации. Если доступна SVG-форма этого изображения, загрузите ее, а затем замените этот шаблон на {{доступна векторная версия | имя нового образа }}.
Рекомендуется назвать SVG-файл «Теорема Фалеса 2.svg «- тогда доступная версия шаблона Vector (или Vva) не нуждается в параметре имя нового изображения .Иллюстрация геометрической теоремы о перехвате, приписываемой Фалесу.
Лицензирование [править]
Разрешается копировать, распространять и / или изменять этот документ в соответствии с условиями лицензии GNU Free Documentation License , версии 1.2 или любой более поздней версии, опубликованной Free Software Foundation; без неизменяемых разделов, без текстов на лицевой обложке и без текстов на задней обложке.Копия лицензии включена в раздел GNU Free Documentation License . Http://www.gnu.org/copyleft/fdl.htmlGFDLGNU Free Documentation Licensetruetrue Этот файл находится под лицензией Creative Commons Attribution-Share Alike 3.0 Unported. - Вы свободны:
- поделиться — копировать, распространять и передавать произведение
- для ремикса — для адаптации работы
- При следующих условиях:
- атрибуция — Вы должны указать соответствующий источник, предоставить ссылку на лицензию и указать, были ли внесены изменения.Вы можете сделать это любым разумным способом, но не любым способом, который предполагает, что лицензиар одобряет вас или ваше использование.
- общий доступ — Если вы ремикшируете, трансформируете или основываете материал, вы должны распространять свои материалы по той же или совместимой лицензии, что и оригинал.
Этот тег лицензирования был добавлен в этот файл как часть обновления лицензирования GFDL. Http://creativecommons.org/licenses/by-sa/3.0/CC-BY-SA-3.0Creative Commons Attribution -Share Alike 3.0 истинно Щелкните дату / время, чтобы просмотреть файл в том виде, в каком он был в тот момент.
Дата / время Миниатюра Размеры Пользователь Комментарий текущий 22:51, 10 августа 2005 г. 583 × 575 (2 ~ ) (Обсуждение | вклад){{GFDL}} Нарисовано с помощью Inkscape 0.42. Категория: Геометрия Вы не можете перезаписать этот файл.
Нет страниц, использующих этот файл.
Этот файл используют следующие другие вики:
- Использование на es.wikibooks.org
- Использование на fr.wikipedia.org
- Использование на he.wikipedia.org
- Использование на he.wikibooks.org
- Использование на hu.wikipedia.org
- Использование на nl.wikipedia.org
- Использование на pl.wikipedia.org
Практика 3 3 параллельные линии и ответы по теореме о сумме углов треугольника
27 марта 2018 г. · Глава 6 Линии и углы — MCQ Online Test 1 Class 9 Maths.1. Угол, равный 8-кратному его дополнению, равен: a. 72 ° в. 88 ° с. 90 ° d. 80 ° 2. Углы треугольника находятся в соотношении 5: 3: 7, треугольник равен: a. Прямоугольный треугольник b. Тупоугольный треугольник c. Равнобедренный треугольник. d. Остроугольный треугольник. 3. Дополнение к … Геометрия Глава 3 Урок 3-3 Практика 3 Имя Класс Дата Практика 3-3 Параллельные линии и теорема о сумме угла треугольника Найдите значение каждой переменной. 1. 2. 3 4. 5 … Параллельные прямые — это компланарные прямые, которые не пересекаются.Теорема 3-8. Если и то t m n На плоскости, если 2 прямые перпендикулярны одной и той же прямой, то они параллельны друг другу. 3.3 Параллельные прямые и теорема о сумме углов треугольника • Теорема 3-10 Теорема о сумме углов треугольника Углы в … HS.G-CO.10. Докажите теоремы о треугольниках. Теоремы включают: меры внутренних углов треугольника в сумме равны 180 °; углы основания равнобедренных треугольников равны; отрезок, соединяющий середины двух сторон треугольника, параллелен третьей стороне и равен половине длины; медианы треугольника пересекаются в одной точке.HS.G-CO.11. Сумма углов треугольника. В любом треугольнике всегда есть три внутренних угла. Эти внутренние углы всегда составляют 180 °. Это правило очень полезно, если x — отрицательное число. Однако углы в треугольнике не должны быть отрицательными. Давайте подключим наш ответ, чтобы убедиться, что это так … сумма углов треугольника равна 180 градусам; углы основания равнобедренных треугольников равны; отрезок, соединяющий середины двух сторон треугольника, параллелен третьей стороне и равен половине длины; медианы треугольника пересекаются в одной точке.MGSE9-12.G.CO.11 Докажите теоремы о параллелограммах. Теоремы включают: противоположные стороны 8G: используйте неформальные аргументы, чтобы установить факты о сумме углов и внешнем угле треугольников, об углах, образованных, когда параллельные прямые пересекаются трансверсалью, а также о критерии подобия треугольников угол-угол. Этот урок также относится к следующим Стандартам математической практики в Общем ядре 8.G.5 — Угловые отношения — Используйте неформальные аргументы, чтобы установить факты о сумме углов и внешнем угле треугольников, об углах, образованных при разрезании параллельных линий поперечный и углово-угловой критерий подобия треугольников.(r + R) 2 = R 2 + (R — r) 2: Теорема Пифагора, примененная к треугольнику MC1C3 R = 4r = 40 см: разверните и решите относительно R. Угол BtA равен 90 градусам: вертикальные углы AB — это диаметр окружности: обратные теореме Фалеса треугольники BtA и CtD подобны: CD параллельны AB 3/5 = AB / x: соответствующие стороны пропорциональны. Свойства параллельных линий Определите все пронумерованные углы, которые соответствуют заданному углу. Обоснуйте свои ответы. 3,5,7 1. 1,5,7 78 132 132 78 2.78 132 3. 1,3,5 88 88 5, 2 4. 88 67 линейный По теореме угол-угол треугольник ABC подобен треугольнику EDC с вершинами A, B и C, соответствующими вершинам E, D и C. , соответственно. Наконец, задачи треугольника, которые включают несколько переменных (или только переменные) как в задаче, так и в ответе, обычно расположены где-то в … Теорема о неравенстве треугольника дает три неравенства Итак, мы должны использовать теорему о сумме углов треугольника, чтобы вычислить меру. недостающего угла. Начнем с того, что заметим, что отрезки AD и BE параллельны.Этот факт позволяет нам сказать, что? A соответствует? E альтернативным внутренним пространством … Раздел 3: Перпендикулярные и параллельные линии Параллельные и поперечные линии: 37:35 Углы и параллельные линии: 41:53 Наклон линий: 44: 06 Доказательство параллельных линий: 25:55 Параллели и расстояние: 19:48: Раздел 4: Конгруэнтные треугольники Классифицирующие треугольники: 28:43 Измерение углов в треугольниках: 44:43 Исследование конгруэнтных треугольников: 26:46 Доказательство … Вопрос: Что такое сумма углов треугольника? Используйте этот инструмент, чтобы изучить этот вопрос.Тогда докажите свой результат. Перетащите углы, чтобы изменить их. Меняется ли сумма когда-либо? A) Теорема о сумме треугольников B) Определение прямого угла C) Определение конгруэнтных углов D) Теорема о линейных парах E) Определение дополнительных углов 49. Выберите из: A) Теорема о сумме треугольников B) Определение числа прямой угол C) Определение конгруэнтных углов D) Теорема о линейной паре E) Определение дополнительных углов 50. Выберите из: A) Треугольник … Геометрия Глава 3 Урок 3-3 Практика 3 Имя Класс Дата Практика 3-3 Параллельные линии и Теорема о сумме углов треугольника Найдите значение каждой переменной.1. 2. 3 4. 5 … Античная геометрия: практическая и эмпирическая. Нахождение правильного угла. Обнаружение недоступного. Оценка богатства. Сравнение китайской и греческой геометрической теоремы Рисунок иллюстрирует эквивалентность китайской теоремы о дополнительных прямоугольниках и греческой аналогичной … Доказательный результат: докажите геометрические теоремы (прямые, углы, треугольники, параллелограммы). Цель (релевантность): эта концепция используется для нахождения 3 наклоненных углов в треугольниках C 50 ° 35 ° A B Теорема 3-12: Теорема о сумме углов треугольника: сумма углов a…АЛГЕБРА Углы A и B — это соответствующие углы, образованные двумя параллельными линиями, пересеченными трансверсалью. … 5 Треугольники и теорема Пифагора … 3 Домашнее задание … Понимание суммы углов и внешнего угла треугольников. Знайте углы, возникающие при пересечении параллельных линий поперечным сечением. Знайте факты о дополнительных, дополнительных, вертикальных и смежных углах. Решайте задачи с использованием масштабных чертежей геометрических фигур. Нарисуйте геометрические фигуры с заданными условиями.
Сумма трех внутренних углов в треугольнике всегда равна 180 °.Теорема о сумме треугольников также называется теоремой о сумме углов треугольника или теоремой о сумме углов. Это двухколоночное доказательство, включающее параллельные прямые и теорему об альтернативном угле.
Проверьте, ваши ответы кажутся правильными. 5. Всегда показывайте свою работу … 12.! CE и FI — параллельные линии.! Угол EDH = 50 ° … с указанием причин, что треугольник DGH равнобедренный …
Таблицы суммы углов треугольника. Эта таблица треугольников будет создавать задачи суммы углов треугольника. Вы можете выбирать между внутренним и внешним углами, а также включать страницу ответов с рабочим листом треугольника.Теперь вы готовы создать свой треугольный рабочий лист, нажав кнопку «Создать».
№2. Теорема о равнобедренном треугольнике — гласит: «Если треугольник равнобедренный, то его БАЗОВЫЕ УГЛЫ совпадают». №3. Определение острого треугольника / Определение тупого треугольника — гласит: «Если треугольник является острым треугольником, то все его углы меньше 90 градусов». «Если треугольник является тупым треугольником, то один из его углов …
Треугольник, каждый угол которого острый, называется острым треугольником.Сумма всех сторон треугольника называется периметром треугольника. Сумма двух сторон треугольника больше третьей стороны. В прямоугольном ABC, в котором ∠B = 90 °, AC 2 = AB 2 + BC 2. Это называется теоремой Пифагора. Четырехугольник. Цифра …
Поскольку угол 65 градусов, угол x и угол 30 градусов составляют прямую линию вместе, сумма должна быть 180 градусов Поскольку 65 + угол x + 30 = 180, угол x должен быть равен 85 Это еще не доказательство. Это просто показывает, что это работает для одного конкретного примера. Доказательство теоремы о сумме углов: начните со следующего треугольника с произвольными значениями…
Какая часть теоремы о сумме внутренних углов многоугольника говорит вам, сколько треугольников составляет конкретный многоугольник? варианты ответов (n — 2) × 180 \ left (n-2 \ right) \ times180 (n — 2) × 1 8 0
Архив ответов Ответы. Теорема 1 В прямоугольном треугольнике медиана, проведенная к гипотенузе, имеет меру, равную половине гипотенузы. AC и ED и поперечный AB (см. Урок «Параллельные линии» в разделе «Углы, дополнительные, дополнительные углы» в разделе «Геометрия» на этом сайте).
Первоначальный ответ: три окружности C1, C2, C3 соприкасаются друг с другом, а также касаются двух параллельных линий, как показано. Мы смотрим на эти прямоугольные треугольники: каждый заштрихованный треугольник имеет определенную горизонтальную протяженность, которая зависит от длины его гипотенузы и размера узкого угла.
про три случая, в которых треугольники конгруэнтны, различные теоремы о параллельных прямых, теорему о сумме углов в треугольнике и теорему Пифагора. Обычно говорят, что книга 2 имеет дело с «геометрической алгеброй», поскольку большинство содержащихся в ней теорем имеют простые алгебраические интерпретации.Книга 3 …
12 января 2020 г. · На сегодняшнем уроке геометрии мы докажем теорему о среднем сегменте трапеции, опираясь на ранее доказанную теорему о среднем сегменте треугольника. Теорема о середине треугольника утверждает, что линия, соединяющая середины двух сторон треугольника, называемая средним сегментом, параллельна третьей стороне, а ее длина равна половине длины третьей стороны.
Докажите теоремы о треугольниках. Теоремы включают: прямая, параллельная одной стороне треугольника, делит две другие пропорционально, и наоборот; теорема Пифагора доказана с использованием подобия треугольника; длина высоты, проведенная от вершины прямого угла прямоугольного треугольника до его гипотенузы, равна среднему геометрическому между…
Ответы на параллельные прямые и поперечные (ID: 1) 1) 75 ° 2) 110 ° 3) 100 ° 4) 110 ° … Найдите угол, выделенный жирным шрифтом. 1) 12x + 3 13x — 3 2) x …
Имеет три внутренних угла. Одна из первых концепций, которую нужно изучить в геометрии, заключается в том, что у треугольников есть внутренние углы в сумме. Возьмите три маленьких помеченных уголка и расположите их вместе так, чтобы необработанные края находились подальше от вас. Единственный способ сделать это — выровнять их, чтобы сформировать …
Dec 04, 2020 · Углы с параллельными линиями Трансверсаль — это линия, которая пересекает две или более прямых (в одной плоскости).При пересечении линий в нескольких местах образуются углы. Некоторым углам даны «имена», которые описывают «где» углы расположены по отношению к линиям. Эти имена описывают углы, параллельны ли указанные прямые […]
Слово «тригонометрия» происходит от двух греческих слов, означающих треугольник и меру. Как вы узнаете из этой главы, тригонометрия включает измерение углов как в треугольниках, так и во вращении (например, как стрелки часов).
Посмотреть ответы.Рабочий лист «Области треугольников» 1 — Вот рабочий лист из девяти задач, который позволит вашим ученикам попрактиковаться в вычислении площади треугольника. Каждое упражнение предусматривает рисование треугольника, а также длину его основания и высоту.
31 июля 2017 г. · Стандарты. Общее ядро. 8.G.A.5 — Используйте неформальные аргументы, чтобы установить факты о сумме углов и внешнем угле треугольников, об углах, образованных, когда параллельные прямые пересекаются трансверсалью, и о критерии подобия треугольников угол-угол.
§ Теорема о сумме углов для треугольников гласит, что сумма измерений внутренних углов треугольника. Студенты практикуют представление неформальных аргументов о сумме углов треугольника, используя внутренние углы параллельных прямых. Это означает, что углы совпадают и имеют одинаковые …
5.3 — Доказательство сравнения треугольников с помощью SAS. … Учащиеся смогут: 1) Использовать теорему о боковом угле-боковом конгруэнтности. УРОК 5.3 ПРИМЕЧАНИЯ. УРОК 5.3 РЕСУРСЫ.
Практика 3-2 и повторное обучение 3-2. Доказательство параллельных линий Практика 3-3 и повторное обучение 3-3 параллельных и перпендикулярных прямых Практика 3-4 и повторное обучение 3-4 параллельных линий и Теорема суммы угла треугольника Практика 3-5 и Повторное обучение 3-5 теоремам о сумме углов многоугольника Практика 3-6 и повторное обучение 3-6 линий в координатной плоскости Практика 3-7 и…
Oct 02, 2015 · Когда соответствующие углы равны, линии параллельны. Точно так же мы можем доказать, используя и другие углы. Пример 3. Если p и q — две прямые, параллельные друг другу и ∠E = 50 °, найдите все углы на рисунке ниже. Решение: Дано ∠E = 50 °. Две прямые параллельны → соответствующие углы равны.
Следствие теоремы о сумме треугольников Острые углы прямоугольного треугольника дополняют друг друга. (p (SAS) Если угол одного треугольника конгруэнтен углу второго треугольника и длинам теоремы. Если прямая делит две стороны треугольника пропорционально, то она параллельна третьей стороне.(p …
Когда параллельные линии пересекаются третьей линией, называемой поперечной, некоторые пары углов совпадают. Конгруэнтные углы имеют одинаковую меру. Альтернативные углы лежат на противоположных сторонах поперечной. Соседние углы имеют общую стороны. Альтернативные внутренние углы не являются смежными углами и находятся между параллельными линиями. ∠3 и ∠5 составляют одно …
Три прямые параллельны (а не вертикальны) тогда и только тогда, когда они имеют одинаковый наклон, т. е. если и только если a1 = b1 = a2 = b2 = a3 = b3.Теорема о неравенстве треугольника 1) Легко: какие из следующих трех чисел могут быть длинами сторон треугольника? Ответ: 4, 5, 6 а) 4, 5, 6 б) 7, 20, 9 в) ½, ⅙, ⅓ г) 3,4, 11,3, 9,8 д) √5, √14, √19 2) Легко: длина двух сторон треугольника составляет 7 см и 3 см. 31 марта 2017 г. · Теперь мы знаем, что сумма всех углов треугольника равна 180 °. Итак, Сумма всех углов треугольника ABD + Сумма всех углов треугольника CBD = 180 ° + 180 °. Или сумма углов (ABD) + сумма углов (CBD) = 360 °. Вы также можете использовать формулу.{(n — 2) * 180} ° = сумма всех внутренних углов. Где n — количество сторон. Теорема о сумме треугольника утверждает, что для треугольника ABC практические задачи. Задача 1. Пусть на приведенном ниже рисунке прямые l₁ и l₂ параллельны, а m — поперечны. Если ∠F = 65 °, найдите размер каждого из оставшихся углов. Три угла A ‘, B’ и C ‘вместе образуют прямой угол (они расположены вдоль прямой l). Итак, их сумма углов равна 180 °. Но тогда сумма углов ∠A 4. В некотором треугольнике три равных угла.

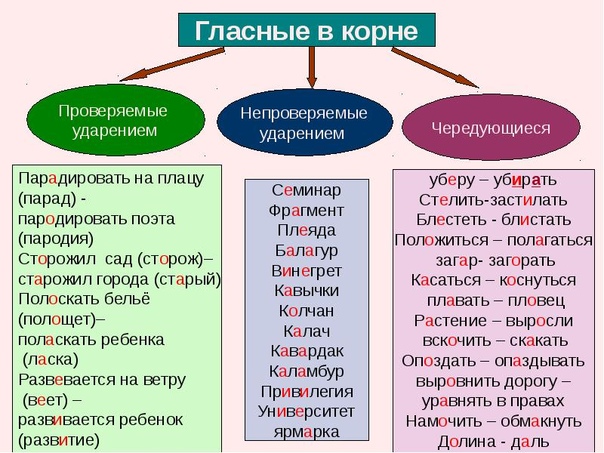 Дорога шла по крутому берегу Яика. Река еще не замерзала, и ее свинцовые волны грустно чернели в однообразных берегах, покрытых белым снегом. За ними простирались киргизские степи. Я погрузился в размышления, большею частию печальные. Гарнизонная жизнь мало имела для меня привлекательности. Я старался вообразить себе капитана Миронова, моего будущего начальника, и представлял его строгим, сердитым стариком, не знающим ничего, кроме своей службы, и готовым за всякую безделицу сажать меня под арест на хлеб и на воду. Между тем начало смеркаться. Мы ехали довольно скоро. «Далече ли до крепости?» — спросил я у своего ямщика. «Недалече, — отвечал он. — Вон уж видна». Я глядел во все стороны, ожидая увидеть грозные бастионы, башни и вал; но ничего не видал, кроме деревушки, окруженной бревенчатым забором. С одной стороны стояли три или четыре скирда сена, полузанесенные снегом; с другой — скривившаяся мельница, с лубочными крыльями, лениво опущенными. «Где же крепость?» — спросил я с удивлением.
Дорога шла по крутому берегу Яика. Река еще не замерзала, и ее свинцовые волны грустно чернели в однообразных берегах, покрытых белым снегом. За ними простирались киргизские степи. Я погрузился в размышления, большею частию печальные. Гарнизонная жизнь мало имела для меня привлекательности. Я старался вообразить себе капитана Миронова, моего будущего начальника, и представлял его строгим, сердитым стариком, не знающим ничего, кроме своей службы, и готовым за всякую безделицу сажать меня под арест на хлеб и на воду. Между тем начало смеркаться. Мы ехали довольно скоро. «Далече ли до крепости?» — спросил я у своего ямщика. «Недалече, — отвечал он. — Вон уж видна». Я глядел во все стороны, ожидая увидеть грозные бастионы, башни и вал; но ничего не видал, кроме деревушки, окруженной бревенчатым забором. С одной стороны стояли три или четыре скирда сена, полузанесенные снегом; с другой — скривившаяся мельница, с лубочными крыльями, лениво опущенными. «Где же крепость?» — спросил я с удивлением. «Да вот она», — отвечал ямщик, указывая на деревушку, и с этим словом мы в нее въехали.
«Да вот она», — отвечал ямщик, указывая на деревушку, и с этим словом мы в нее въехали. Русский язык, 5 класс.
Русский язык, 5 класс. И/Ы после Ц
И/Ы после Ц

 Такие слова надо запомнить или проверять по словарю.
Такие слова надо запомнить или проверять по словарю. Прочитай правила, рассмотри примеры.
Прочитай правила, рассмотри примеры.
 Единственное, что можно сделать, это найти нужное слово в словаре. Так советуют все учебники. Но словаря может не оказаться под рукой. Значит, такие слова нужно заучивать. Чем больше таких слов ты будешь знать, тем лучше. Постепенно у тебя разовьётся интуиция, и слова с непроверяемыми гласными не будут создавать трудности. Итак, несмотря на кажущуюся глупость, это правило очень полезно!
Единственное, что можно сделать, это найти нужное слово в словаре. Так советуют все учебники. Но словаря может не оказаться под рукой. Значит, такие слова нужно заучивать. Чем больше таких слов ты будешь знать, тем лучше. Постепенно у тебя разовьётся интуиция, и слова с непроверяемыми гласными не будут создавать трудности. Итак, несмотря на кажущуюся глупость, это правило очень полезно! И с легкостью выполнить задание А13.
И с легкостью выполнить задание А13.

 С хорошими результатами будет легче поступить в любой вуз. Данный раздел поможет вам приблизиться к этой цели. Здесь есть всё необходимое для успешной подготовки. Также данный раздел нередко используется учащимися вузов и ссузов.
С хорошими результатами будет легче поступить в любой вуз. Данный раздел поможет вам приблизиться к этой цели. Здесь есть всё необходимое для успешной подготовки. Также данный раздел нередко используется учащимися вузов и ссузов. Изначально эта программа вводилась как эксперимент и уже в первые месяцы тестирования зарекомендовала себя как объективную систему тестирования выпускников. Так что же все-таки представляет из себя этот ЕГЭ?
Изначально эта программа вводилась как эксперимент и уже в первые месяцы тестирования зарекомендовала себя как объективную систему тестирования выпускников. Так что же все-таки представляет из себя этот ЕГЭ? Должен сказать, что квалифицированная подготовка дает свои, далеко не плохие, результаты. Но те, кто уже прошел через это «страшное» испытание, утверждают, что для учеников даже со средними оценками экзамен не должен показаться слишком уж сложным, по крайней мере невыполнимым. Нужно лишь приложить немного усилий, а именно выучить хотя бы самые важные правила, пройденные за весь учебный период, ведь если вы не ленились и хотя бы иногда открывали учебники, то что-то вы должны знать. Очень хорошо помогают различные книжки, предлагающие собственные примеры заданий, примеры их решений и дающие различные рекомендации по сдаче экзамена. Подобной литературой буквально завалены все книжные магазины, причем стоят они очень дешево. Для кого-то, естественно, и этого будет недостаточно. В таких случаях я бы рекомендовал обращаться к своим учителям, большинство из которых готовы помогать бесплатно. Я знаю, что во многих школах учителя предлагают организовывать собственные школьные подготовительные курсы за небольшую плату, а то и вовсе бесплатно.
Должен сказать, что квалифицированная подготовка дает свои, далеко не плохие, результаты. Но те, кто уже прошел через это «страшное» испытание, утверждают, что для учеников даже со средними оценками экзамен не должен показаться слишком уж сложным, по крайней мере невыполнимым. Нужно лишь приложить немного усилий, а именно выучить хотя бы самые важные правила, пройденные за весь учебный период, ведь если вы не ленились и хотя бы иногда открывали учебники, то что-то вы должны знать. Очень хорошо помогают различные книжки, предлагающие собственные примеры заданий, примеры их решений и дающие различные рекомендации по сдаче экзамена. Подобной литературой буквально завалены все книжные магазины, причем стоят они очень дешево. Для кого-то, естественно, и этого будет недостаточно. В таких случаях я бы рекомендовал обращаться к своим учителям, большинство из которых готовы помогать бесплатно. Я знаю, что во многих школах учителя предлагают организовывать собственные школьные подготовительные курсы за небольшую плату, а то и вовсе бесплатно.


 Я целую чистые, святые руки твои!
Я целую чистые, святые руки твои!
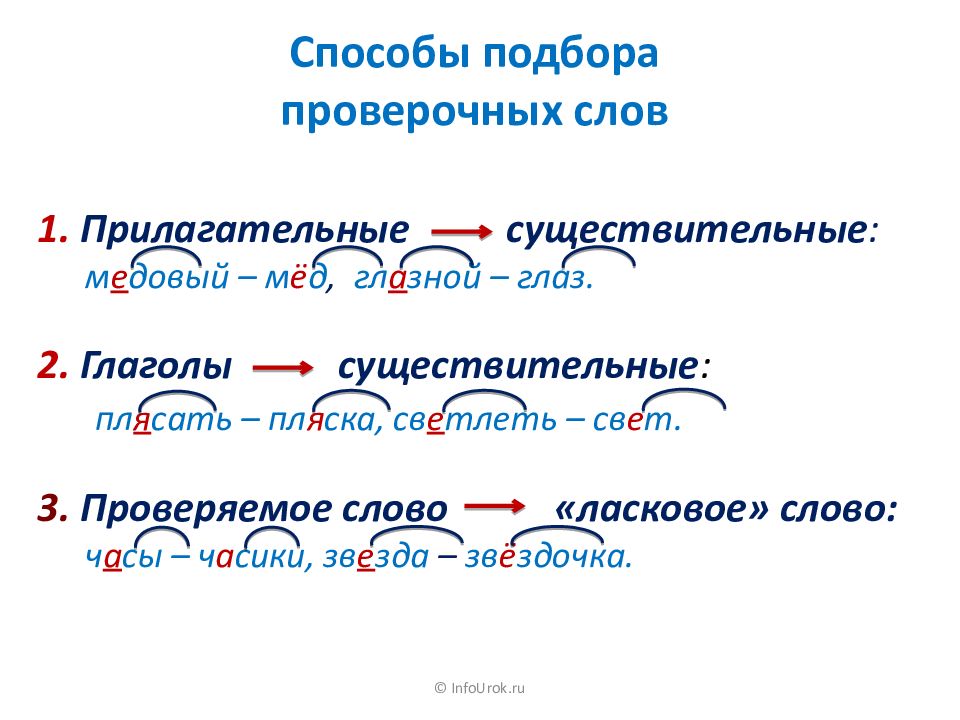 ШОВ
ШОВ


 Видимо, слово ветер словарное и
проверить написание второго гласного надо в орфографическом словаре, ну
и, конечно, запомнить. Ну вот, во втором слоге тоже надо писать букву Е. Ве-те-рок,
ве-тер.
Видимо, слово ветер словарное и
проверить написание второго гласного надо в орфографическом словаре, ну
и, конечно, запомнить. Ну вот, во втором слоге тоже надо писать букву Е. Ве-те-рок,
ве-тер. Что это за слова такие? Сейчас
расскажу.
Что это за слова такие? Сейчас
расскажу.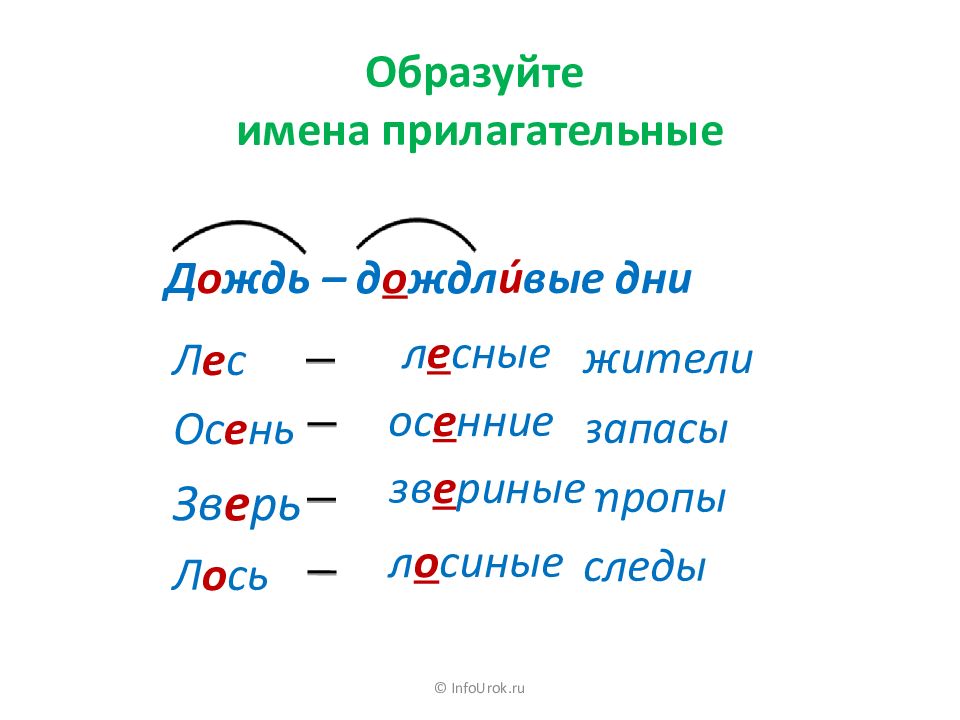
 Так что не все старославянские слова ушли из
нашего языка.
Так что не все старославянские слова ушли из
нашего языка. Далее предлагается система упражнений на различение гласных и согласных звуков (букв), которые могут смешиваться в устной и письменной речи ребёнка.
Далее предлагается система упражнений на различение гласных и согласных звуков (букв), которые могут смешиваться в устной и письменной речи ребёнка. Канцтовары Brauberg
Канцтовары Brauberg Вот некоторые из моих любимых стратегий обучения швам.
Вот некоторые из моих любимых стратегий обучения швам.
 Выберите слово, которое есть в устном словарном запасе вашего ребенка, например, словесную задачу.
Выберите слово, которое есть в устном словарном запасе вашего ребенка, например, словесную задачу.  С практикой и этими стратегиями ваш ребенок сможет понять суть слова!
С практикой и этими стратегиями ваш ребенок сможет понять суть слова!
 Задача ученика состоит в том, чтобы сначала скопировать слова, а затем написать их независимо, без точек, прорабатывая слово по слогам за раз и проговаривая каждый слог.
Задача ученика состоит в том, чтобы сначала скопировать слова, а затем написать их независимо, без точек, прорабатывая слово по слогам за раз и проговаривая каждый слог. Произношение слов с ударением на правильные слоги поможет вам улучшить разговорный английский, упростит понимание ваших предложений и поможет вам больше походить на носителя языка.
Произношение слов с ударением на правильные слоги поможет вам улучшить разговорный английский, упростит понимание ваших предложений и поможет вам больше походить на носителя языка. В слове всегда есть один или несколько ударных слогов, и это особое ударение помогает словам и предложениям развивать свой собственный ритм.
В слове всегда есть один или несколько ударных слогов, и это особое ударение помогает словам и предложениям развивать свой собственный ритм. Правильное ударение в английском языке имеет решающее значение для быстрого и точного понимания слова.
Правильное ударение в английском языке имеет решающее значение для быстрого и точного понимания слова.
 Так часто бывает со словами, оканчивающимися на «изм».
Так часто бывает со словами, оканчивающимися на «изм».
 Это может привести к забавным недоразумениям и неприятным разговорам!
Это может привести к забавным недоразумениям и неприятным разговорам!
 Его также можно использовать, когда речь идет о представлении теле- или радиопрограммы (т. Е. Быть «ведущим»).
Его также можно использовать, когда речь идет о представлении теле- или радиопрограммы (т. Е. Быть «ведущим»).
 Это означает, что нужно решить, на каких словах сделать ударение как на части предложения в целом. Подчеркнутые слоги могут создавать в предложении отличительный ритмический узор.Вот как образцы ударения в английском языке связаны с ритмом английского языка и помогают создавать «музыку» языка.
Это означает, что нужно решить, на каких словах сделать ударение как на части предложения в целом. Подчеркнутые слоги могут создавать в предложении отличительный ритмический узор.Вот как образцы ударения в английском языке связаны с ритмом английского языка и помогают создавать «музыку» языка. Содержательные слова обычно подчеркнуты.
Содержательные слова обычно подчеркнуты. Это может быть правдой, а может и неправдой — дело в том, что Я, , никогда этого не говорил — сказал кто-то другой.
Это может быть правдой, а может и неправдой — дело в том, что Я, , никогда этого не говорил — сказал кто-то другой.
 Грамматики называют это «шва» или / ə /.
Грамматики называют это «шва» или / ə /. 


 (для поступления весной 2020 г.) или 20 апреля 2020 г. (для поступления осенью). 2020).
(для поступления весной 2020 г.) или 20 апреля 2020 г. (для поступления осенью). 2020). Говоря словами Лысенковой С.Н. –
«опора, схема – опора, опорный лист – это выводы,
которые рождаются в момент объяснения,
оформленные в виде таблиц, карточек, наборного
полотна, чертежа, рисунка». У. Е. Минтоном было
отмечено, что существенные признаки и связи,
зафиксированные в модели (опоре), становятся
наглядными для учащихся тогда, когда эти
признаки, связи были выделены самими детьми в их
собственном действии, т. е. когда они сами
участвовали в создании модели (опоры). В
противном случае можно наблюдать непринятие,
опора не выполняет ту роль, которая на нее
возложена. По мнению Е. А. Мельниковой, «опора –
это зрительный образ, выражающий знание в
предельно абстрактном, концентрированном виде».
Говоря словами Лысенковой С.Н. –
«опора, схема – опора, опорный лист – это выводы,
которые рождаются в момент объяснения,
оформленные в виде таблиц, карточек, наборного
полотна, чертежа, рисунка». У. Е. Минтоном было
отмечено, что существенные признаки и связи,
зафиксированные в модели (опоре), становятся
наглядными для учащихся тогда, когда эти
признаки, связи были выделены самими детьми в их
собственном действии, т. е. когда они сами
участвовали в создании модели (опоры). В
противном случае можно наблюдать непринятие,
опора не выполняет ту роль, которая на нее
возложена. По мнению Е. А. Мельниковой, «опора –
это зрительный образ, выражающий знание в
предельно абстрактном, концентрированном виде». Но все это не
должно быть фоном, наглядностью ради
наглядности. Акцент делается на их
целесообразность и значимость на этапе
«открытия знаний», первичного закрепления,
рефлексии. Ученик должен пропустить через себя
суть явления или знания и опираясь в дальнейшем
на абстрактный образ (алгоритм) продвигаться в
познании, выполнять самоконтроль.
Но все это не
должно быть фоном, наглядностью ради
наглядности. Акцент делается на их
целесообразность и значимость на этапе
«открытия знаний», первичного закрепления,
рефлексии. Ученик должен пропустить через себя
суть явления или знания и опираясь в дальнейшем
на абстрактный образ (алгоритм) продвигаться в
познании, выполнять самоконтроль.
 Карточки
– вопросы крепим магнитами на доске, а
графические обозначения выполняем мелом
(маркером). Можно выполнять эти упражнения,
выкладывая карточки на парте или пленке.
Предлагаю различные виды заданий:
Карточки
– вопросы крепим магнитами на доске, а
графические обозначения выполняем мелом
(маркером). Можно выполнять эти упражнения,
выкладывая карточки на парте или пленке.
Предлагаю различные виды заданий: А. Песняевой о представлении текста в виде
детской пирамидки. Ребята эту идею восприняли на
«ура». После первого (вводного) урока мы отошли от
самой игрушки и заменили ее опорой с
изображением пирамидки. Так как при изучении
темы «Текст» выделяются 3 основные части: начало,
середина и концовка, то ученики предложили
дополнить опору этими сведениями. Эта опора
используется и на уроках риторики при изучении
раздела «Текст».
А. Песняевой о представлении текста в виде
детской пирамидки. Ребята эту идею восприняли на
«ура». После первого (вводного) урока мы отошли от
самой игрушки и заменили ее опорой с
изображением пирамидки. Так как при изучении
темы «Текст» выделяются 3 основные части: начало,
середина и концовка, то ученики предложили
дополнить опору этими сведениями. Эта опора
используется и на уроках риторики при изучении
раздела «Текст». Использую эту опору
так же для обогащения и расширения словарного
запаса учащихся, при составлении загадок,
описании предметов, распространении
предложений, составлении словосочетаний и т. п.
Использую эту опору
так же для обогащения и расширения словарного
запаса учащихся, при составлении загадок,
описании предметов, распространении
предложений, составлении словосочетаний и т. п. Дополняем этой
информацией опору 1 класса, и применяем схему в
дальнейшей работе по теме.
Дополняем этой
информацией опору 1 класса, и применяем схему в
дальнейшей работе по теме.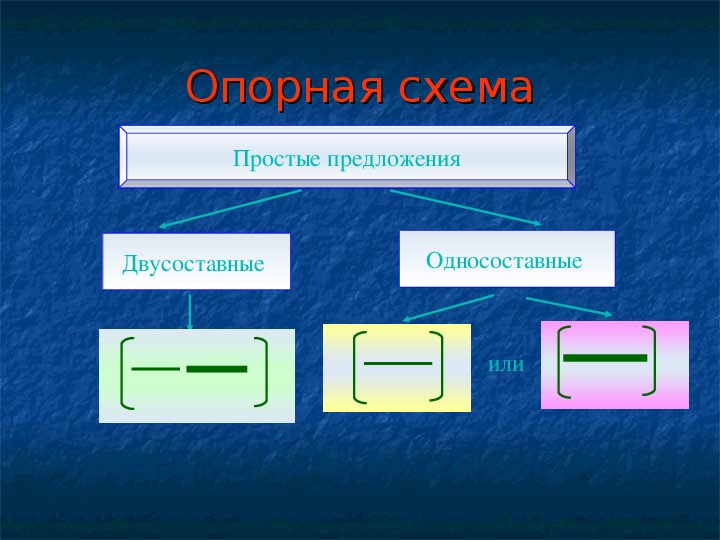
 д.
д. д.
д. Надеюсь, что мой опыт поможет коллегам в их
стремлении разнообразить школьные будни,
сделать урок продуктивным, интересным и
задействовать всех учащихся как субъектов
процесса собственного обучения.
Надеюсь, что мой опыт поможет коллегам в их
стремлении разнообразить школьные будни,
сделать урок продуктивным, интересным и
задействовать всех учащихся как субъектов
процесса собственного обучения.
 [О, О, О ____ =====] или [O, O, O].
[О, О, О ____ =====] или [O, O, O]. Схема демонстрирует учащимся, что слова следует писать раздельно друг от друга, и можно сосчитать их количество. Систематически практикуясь в их составлении, дети четко уясняют следующую парадигму:
Схема демонстрирует учащимся, что слова следует писать раздельно друг от друга, и можно сосчитать их количество. Систематически практикуясь в их составлении, дети четко уясняют следующую парадигму: Тема не совсем простая. Нужно выработать необходимые навыки, чтобы не совершать ошибок при написании. Схема, как наглядное пособие, способствует закреплению полученных знаний.
Тема не совсем простая. Нужно выработать необходимые навыки, чтобы не совершать ошибок при написании. Схема, как наглядное пособие, способствует закреплению полученных знаний.
 I____ _ I____ ____ __ ____ _ ____.
I____ _ I____ ____ __ ____ _ ____. ру — домашняя школа онлайн.
ру — домашняя школа онлайн. Она помогает разобраться в сути предмета. Например, верно и четко составленная схема позволяет на уроках математики легко и быстро решить любую задачу. Точно также правильно составленная схема предложения помогает увидеть части сложного предложения, отличить сложное предложение от простого с однородными членами и грамотно расставить запятые.
Она помогает разобраться в сути предмета. Например, верно и четко составленная схема позволяет на уроках математики легко и быстро решить любую задачу. Точно также правильно составленная схема предложения помогает увидеть части сложного предложения, отличить сложное предложение от простого с однородными членами и грамотно расставить запятые. Если однородными являются главные члены, то внутри кружка мы рисуем соответствующие линии. Не забудьте поставить запятые между однородными членами. Рассмотрим примеры.
Если однородными являются главные члены, то внутри кружка мы рисуем соответствующие линии. Не забудьте поставить запятые между однородными членами. Рассмотрим примеры.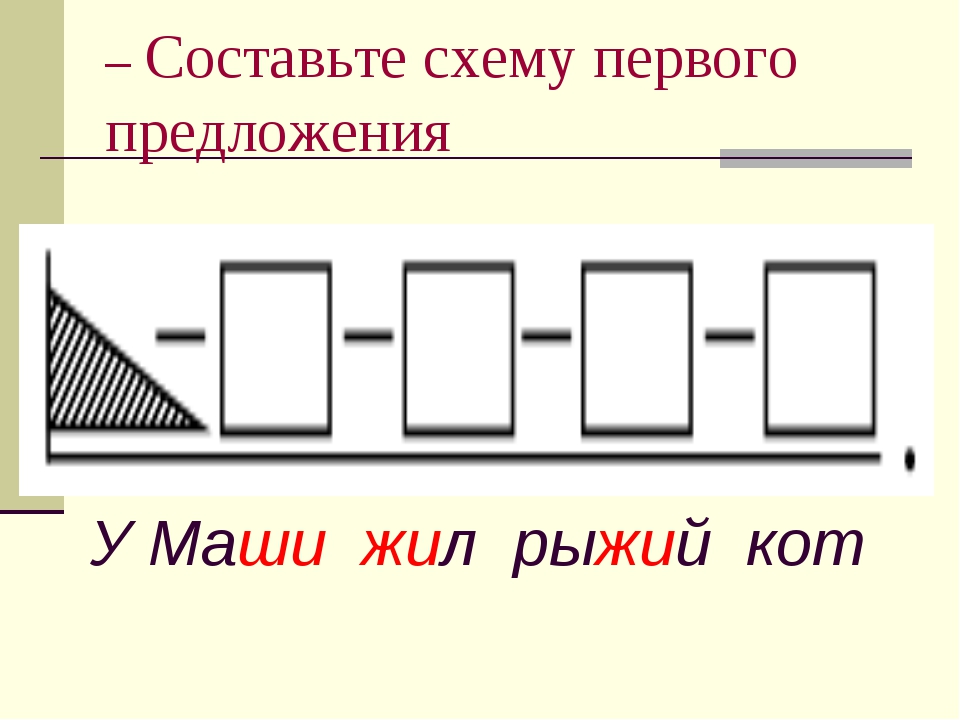 Для этого нужно схему внимательно рассмотреть, определить, какое предложение нужно составить: простое, с однородными членами или сложное. Далее нужно увидеть порядок следования членов предложения, указанных на схеме, а также обратить внимание на знаки препинания.
Для этого нужно схему внимательно рассмотреть, определить, какое предложение нужно составить: простое, с однородными членами или сложное. Далее нужно увидеть порядок следования членов предложения, указанных на схеме, а также обратить внимание на знаки препинания. При составлении схемы сложного предложения каждая часть заключается в отдельные квадратные скобки, между ними ставятся запятые и союзы. После схемы ставится знак препинания, соответствующий концу данного предложения.
При составлении схемы сложного предложения каждая часть заключается в отдельные квадратные скобки, между ними ставятся запятые и союзы. После схемы ставится знак препинания, соответствующий концу данного предложения.
 Отвечает на вопросы «когда?», «как?», «где?», «почему?», «зачем?». Обстоятельство носит такое название, потому что в предложении оно указывает на различные цели, причины, места, время и другое, то есть показывает самые различные обстоятельства, которые указывают на происходящее в предложении. Обстоятельство подчеркивается снизу точкой — тире.
Отвечает на вопросы «когда?», «как?», «где?», «почему?», «зачем?». Обстоятельство носит такое название, потому что в предложении оно указывает на различные цели, причины, места, время и другое, то есть показывает самые различные обстоятельства, которые указывают на происходящее в предложении. Обстоятельство подчеркивается снизу точкой — тире.



 Один химический элемент может образовать несколько простых веществ.
Один химический элемент может образовать несколько простых веществ. Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий. 3. Алмаз
3. Алмаз
 Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):

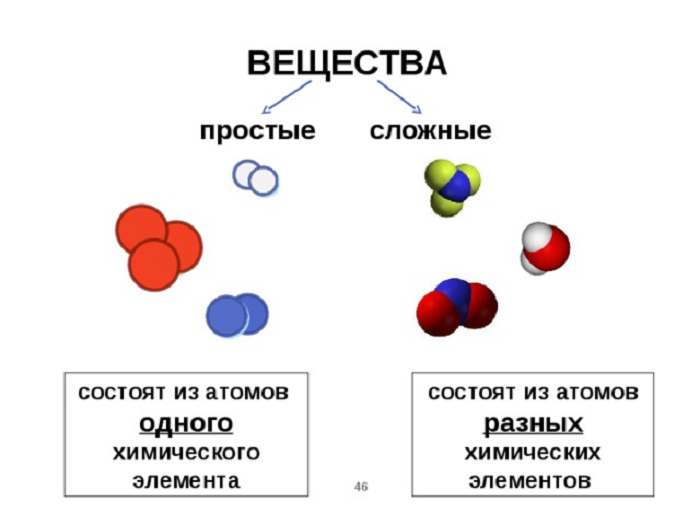 Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе.
Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе. Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn). Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.
Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.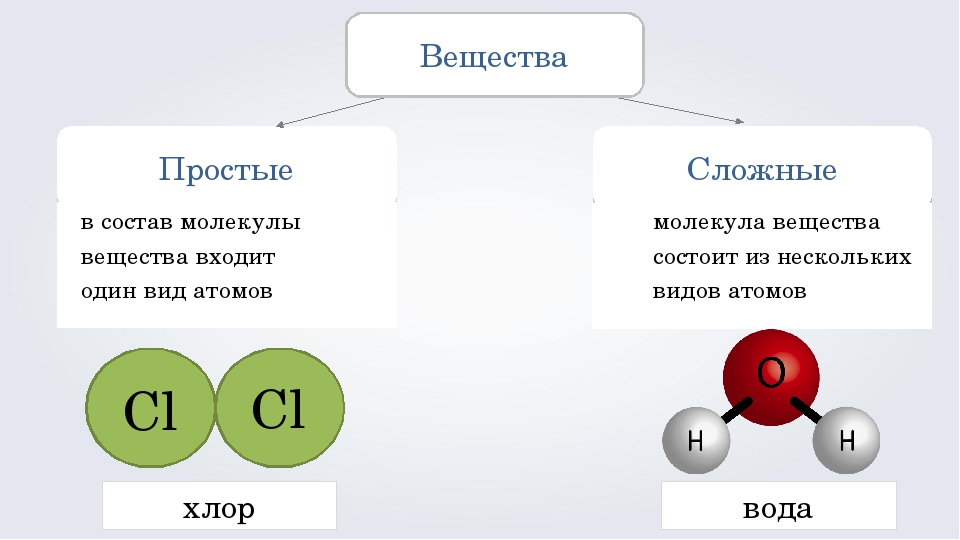 Вещества данного типа образованы молекулами углерода сферической формы. На рисунке 6 представлены 3D модели молекулы фуллерена с60 и футбольного мяча для сравнения. Обратите внимание на их интересное сходство.
Вещества данного типа образованы молекулами углерода сферической формы. На рисунке 6 представлены 3D модели молекулы фуллерена с60 и футбольного мяча для сравнения. Обратите внимание на их интересное сходство.
 ).
). е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.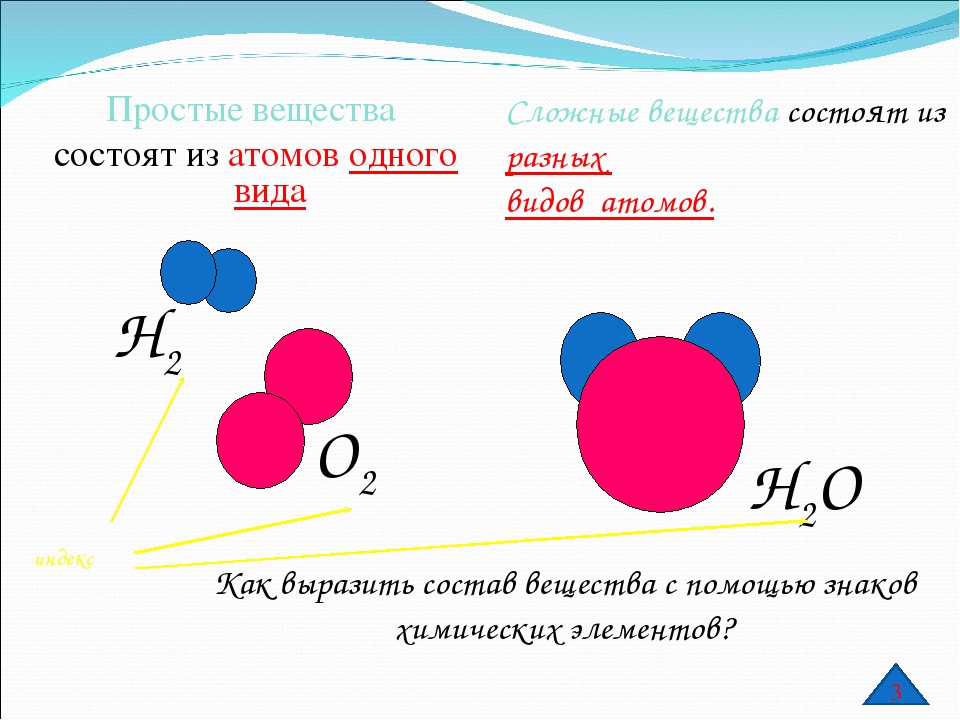 Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ. Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.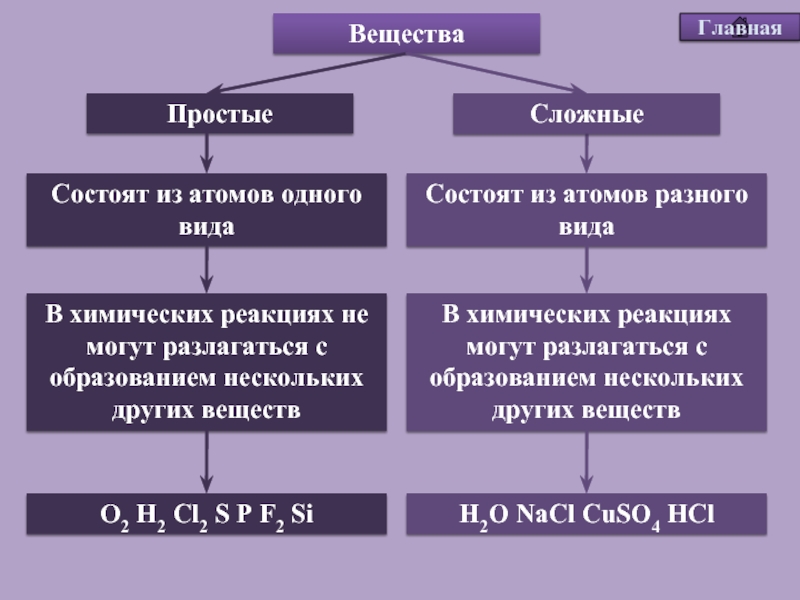 Важнейшая задача химии – выявление химических свойств веществ.
Важнейшая задача химии – выявление химических свойств веществ. Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков. Заряд ядра
Заряд ядра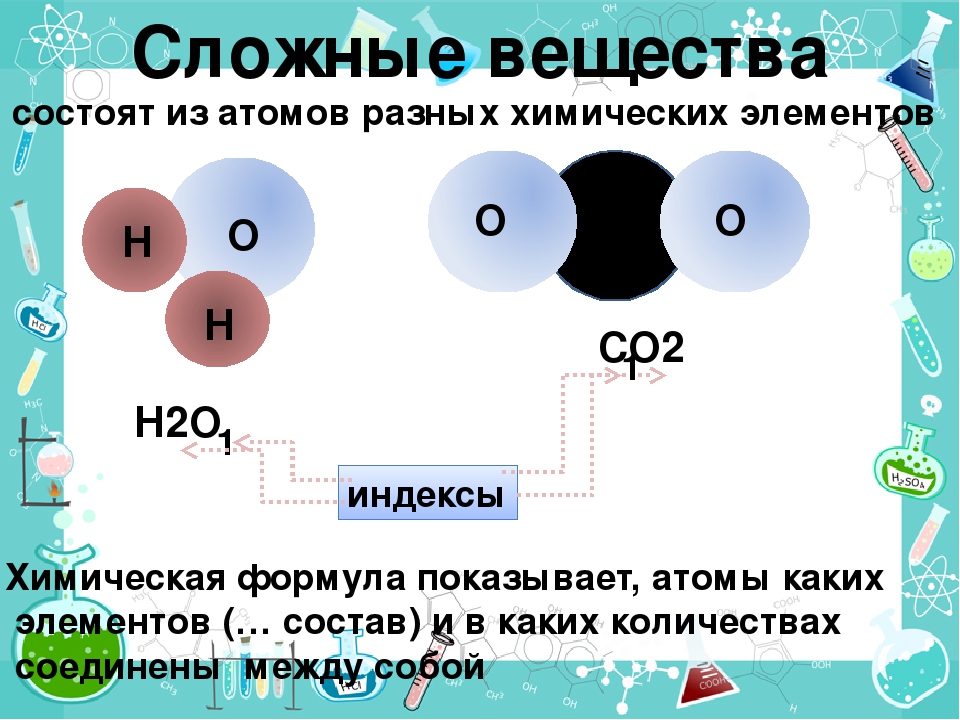
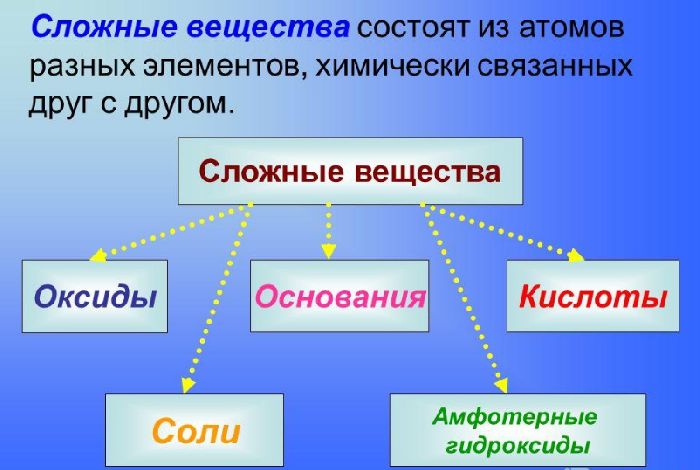 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35). Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36). 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.

 К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!) Это явление называется аллотропией.
Это явление называется аллотропией.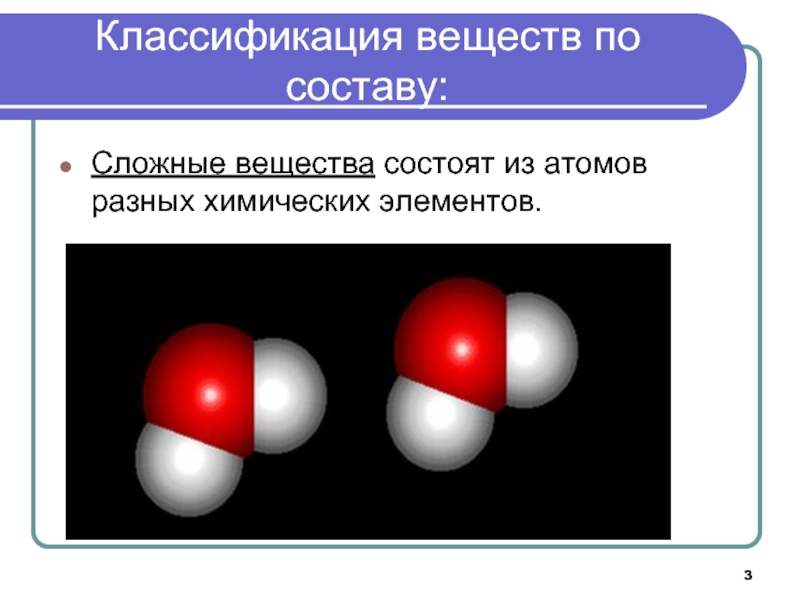
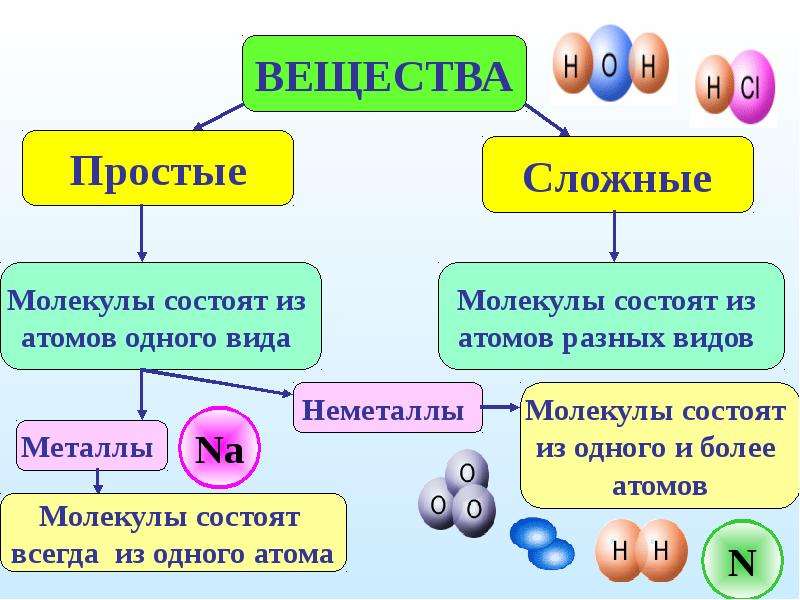 Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга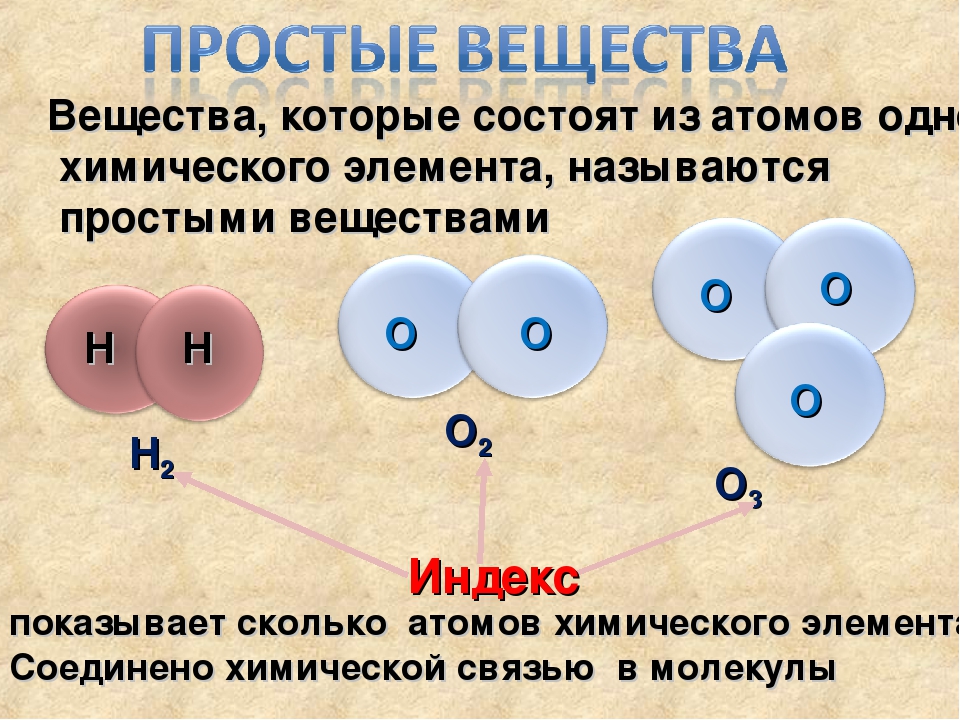 В составе Солнца больше всего водорода — простого вещества, молекулы которого также двухатомные.
В составе Солнца больше всего водорода — простого вещества, молекулы которого также двухатомные.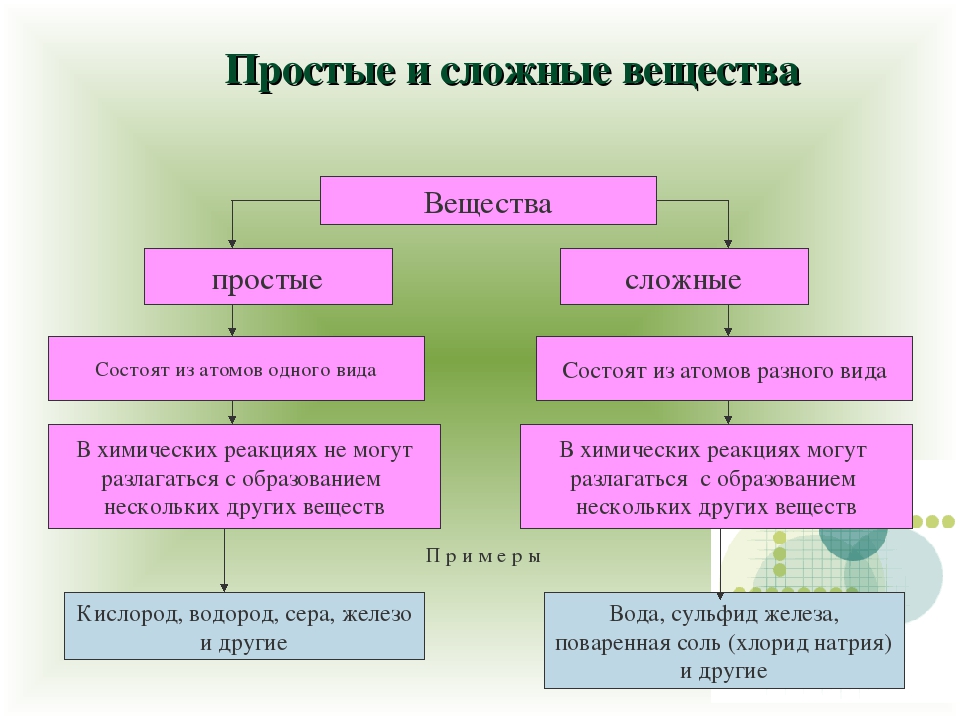

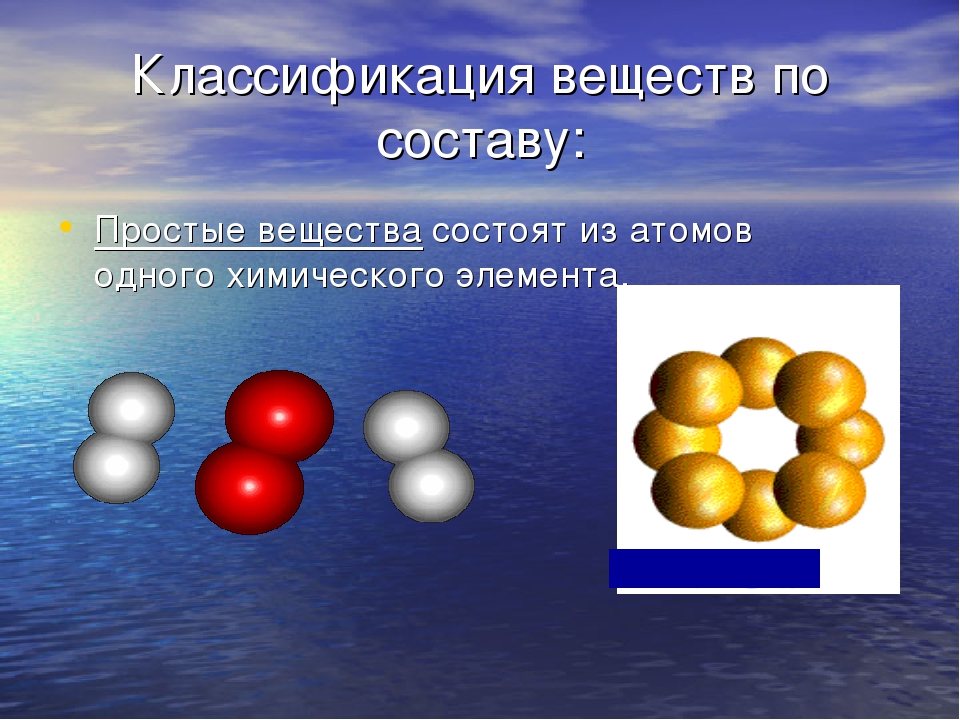 предложил современную теорию атома, основанную на
следующие предположения.
предложил современную теорию атома, основанную на
следующие предположения.
 е., часто существуют в виде жидкости или газа при
комнатная температура)
е., часто существуют в виде жидкости или газа при
комнатная температура)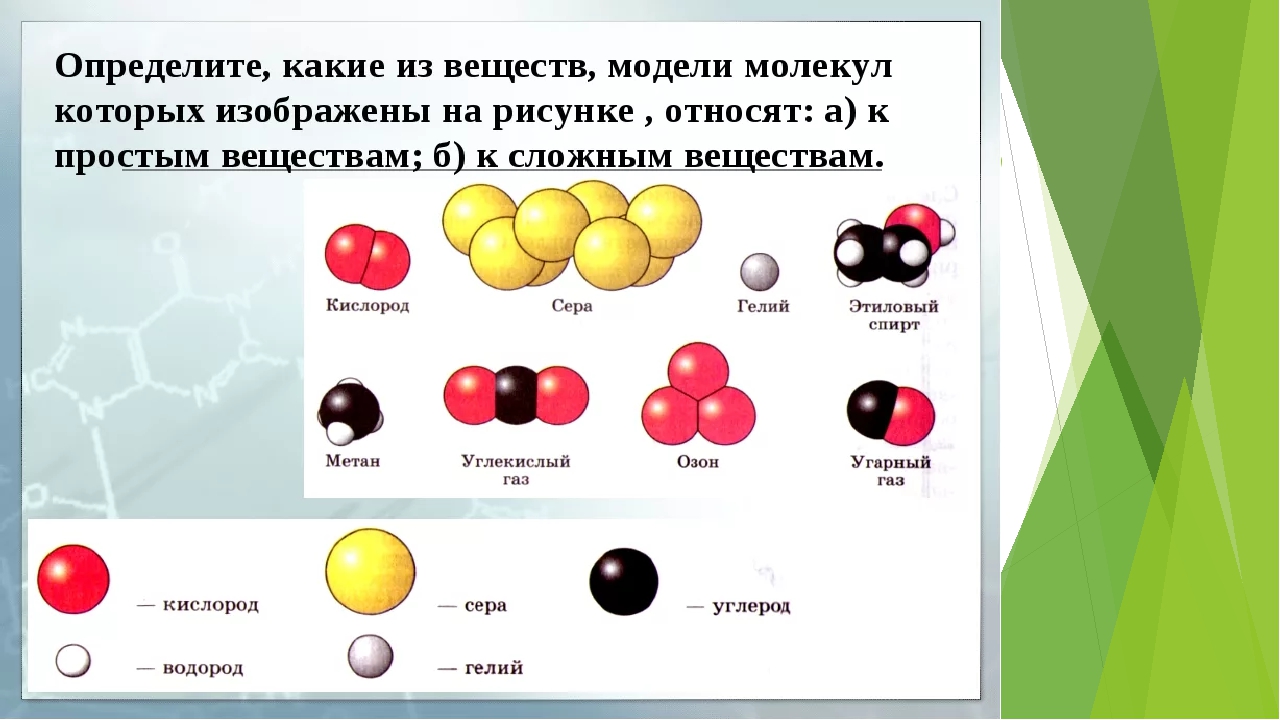
 Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов.
Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться количеству отрицательных зарядов. В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу, независимо от его источника. Латунь — это
пример смеси двух элементов: меди и цинка.Может
содержат всего от 10% до 45% цинка.
В
закон постоянного состава может использоваться, чтобы различать
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу, независимо от его источника. Латунь — это
пример смеси двух элементов: меди и цинка.Может
содержат всего от 10% до 45% цинка.
 Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. химическое соединение. Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, сильно отличающиеся от характеристик составляющих элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород.Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль.
Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, сильно отличающиеся от характеристик составляющих элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород.Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды. В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами. Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций.
Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций. На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
 I. — Наблюдения за таблицей простых веществ. Основной целью химических экспериментов является разложение естественных тел,
чтобы по отдельности исследовать различные вещества, входящие в их состав.
состав. Посмотрев на химические системы, будет установлено, что это
наука химического анализа быстро продвинулась вперед в наше время.
Раньше нефть и соль считались элементами тел, а позже
наблюдения и эксперимент показали, что все соли, вместо того, чтобы быть простыми,
состоят из кислоты, соединенной с основанием.Пределы анализа были
значительно расширен современными открытиями *; кислоты
показано, что он состоит из кислорода, как общего для всех подкисляющего принципа,
объединены в каждом к определенной базе. Я доказал, что имел г-н Хассенфратц
до того, как утверждалось, что эти радикалы кислот не все простые элементы,
многие из них, подобно масляному принципу, состоят из водорода и
уголь. Даже основания нейтральных солей были доказаны г-ном Бертолле.
быть соединениями, поскольку он показал, что аммиак состоит из азота и
водород.
I. — Наблюдения за таблицей простых веществ. Основной целью химических экспериментов является разложение естественных тел,
чтобы по отдельности исследовать различные вещества, входящие в их состав.
состав. Посмотрев на химические системы, будет установлено, что это
наука химического анализа быстро продвинулась вперед в наше время.
Раньше нефть и соль считались элементами тел, а позже
наблюдения и эксперимент показали, что все соли, вместо того, чтобы быть простыми,
состоят из кислоты, соединенной с основанием.Пределы анализа были
значительно расширен современными открытиями *; кислоты
показано, что он состоит из кислорода, как общего для всех подкисляющего принципа,
объединены в каждом к определенной базе. Я доказал, что имел г-н Хассенфратц
до того, как утверждалось, что эти радикалы кислот не все простые элементы,
многие из них, подобно масляному принципу, состоят из водорода и
уголь. Даже основания нейтральных солей были доказаны г-ном Бертолле.
быть соединениями, поскольку он показал, что аммиак состоит из азота и
водород.
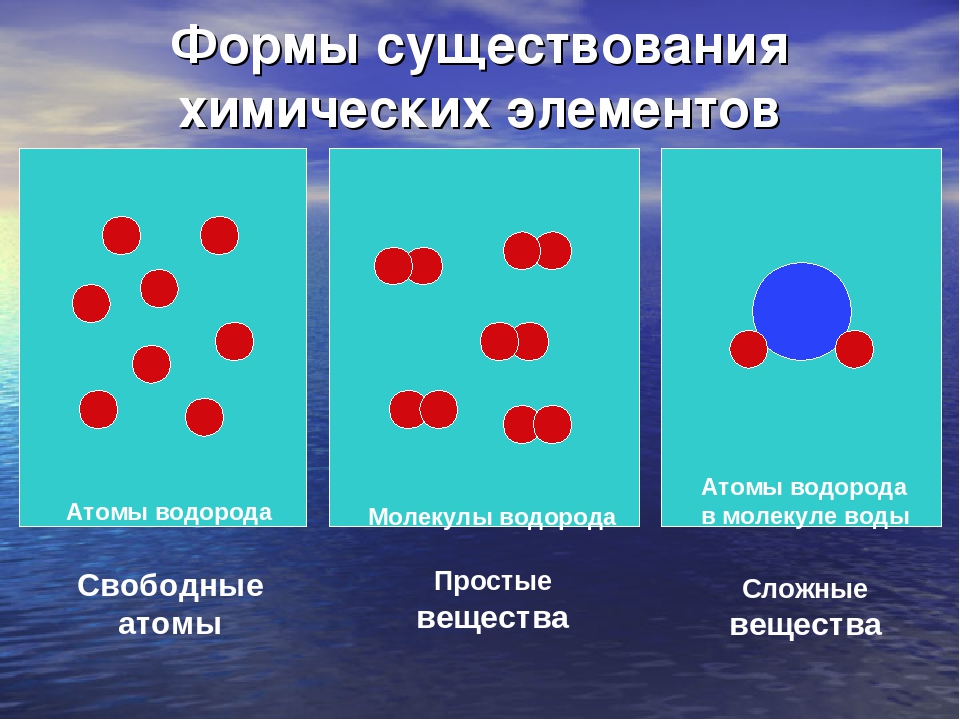

 Поскольку молекулы h3O в дистиллированной воде состоят из 2 атомов водорода и 1 атома кислорода, связанных вместе и функционирующих как единое целое, чистое вещество вода классифицируется как соединение и может быть химически разложено на отдельные элементы — водород и кислород.
Поскольку молекулы h3O в дистиллированной воде состоят из 2 атомов водорода и 1 атома кислорода, связанных вместе и функционирующих как единое целое, чистое вещество вода классифицируется как соединение и может быть химически разложено на отдельные элементы — водород и кислород. Химия — это область исследований, которая занимается характеристиками, составом и преобразованиями материи.
Химия — это область исследований, которая занимается характеристиками, составом и преобразованиями материи. Никакие новые вещества никогда не образуются в результате физических изменений. Химическое изменение — это процесс, который включает изменение основной природы (химического состава) вещества. Такие изменения всегда включают преобразование рассматриваемого материала или материалов в одно или несколько новых веществ, свойства и состав которых существенно отличаются от свойств и состава исходных материалов.
Никакие новые вещества никогда не образуются в результате физических изменений. Химическое изменение — это процесс, который включает изменение основной природы (химического состава) вещества. Такие изменения всегда включают преобразование рассматриваемого материала или материалов в одно или несколько новых веществ, свойства и состав которых существенно отличаются от свойств и состава исходных материалов.
 Чистое вещество, содержащее гомоатомные молекулы, является элементом. Гетероатомные молекулы — это молекулы, в которых присутствуют два или более различных типа атомов.Чистые вещества, содержащие гетероатомные молекулы, должны быть соединениями.
Чистое вещество, содержащее гомоатомные молекулы, является элементом. Гетероатомные молекулы — это молекулы, в которых присутствуют два или более различных типа атомов.Чистые вещества, содержащие гетероатомные молекулы, должны быть соединениями.
 Вещество, которое можно разбить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. Сегодня в известной нам вселенной около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Вещество, которое можно разбить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. Сегодня в известной нам вселенной около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений. Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства. По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя.Каждый из слоев называется фазой.
По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя.Каждый из слоев называется фазой.

 Морская вода — это однородная смесь или раствор.
Морская вода — это однородная смесь или раствор. Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из одного типа атомов.
Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из одного типа атомов.
 Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь. Это месторождение полезных ископаемых состоит из смеси веществ.
Это месторождение полезных ископаемых состоит из смеси веществ.
 6-7 млн.л.н.
6-7 млн.л.н. Внутри Африки местонахождения австралопитеков концентрируются в двух основных районах: Восточная Африка (Танзания, Кения, Эфиопия) и Южная Африка. Отдельные находки были сделаны также в Северной Африке; возможно, их малое количество связано больше с условиями захоронения или малой изученностью региона, а не с реальным расселением австралопитеков. Ясно, что в столь широких временных и географических рамках природные условия не раз менялись, что приводило к появлению новых видов и родов.
Внутри Африки местонахождения австралопитеков концентрируются в двух основных районах: Восточная Африка (Танзания, Кения, Эфиопия) и Южная Африка. Отдельные находки были сделаны также в Северной Африке; возможно, их малое количество связано больше с условиями захоронения или малой изученностью региона, а не с реальным расселением австралопитеков. Ясно, что в столь широких временных и географических рамках природные условия не раз менялись, что приводило к появлению новых видов и родов. лет назад, обладали наиболее примитивным строением. Выделяют несколько родов и видов ранних австралопитеков.
лет назад, обладали наиболее примитивным строением. Выделяют несколько родов и видов ранних австралопитеков.
 Однако сосуществование австралопитеков с представителями «эугоминид» (или «ранними Homo«) не вызывает сомнения, по крайней мере для Восточной Африки.
Однако сосуществование австралопитеков с представителями «эугоминид» (или «ранними Homo«) не вызывает сомнения, по крайней мере для Восточной Африки. Предком основного вида скорее всего был вид anamensis, а первым основным видом известным на данный момент стал вид afarensis, который просуществовал примерно 1 млн лет. По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс. лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия.
Предком основного вида скорее всего был вид anamensis, а первым основным видом известным на данный момент стал вид afarensis, который просуществовал примерно 1 млн лет. По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс. лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия. Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования.
Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования. Головной мозг относительно крупный (530 см³), но по строению мало отличающийся от мозга современных человекообразных обезьян. По объёму он составлял не более 35 % от средних размеров мозга современного человека. Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам.
Головной мозг относительно крупный (530 см³), но по строению мало отличающийся от мозга современных человекообразных обезьян. По объёму он составлял не более 35 % от средних размеров мозга современного человека. Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам.

 Высказывается также предположение, что общие предки прямоходящих гоминид (в том числе людей и австралопитеков) жили на мелководье, и питались мелкими водными обитателями, а прямохождение сформировалось как адаптация к передвижению по мелководью. В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные.
Высказывается также предположение, что общие предки прямоходящих гоминид (в том числе людей и австралопитеков) жили на мелководье, и питались мелкими водными обитателями, а прямохождение сформировалось как адаптация к передвижению по мелководью. В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные. Такая тактика позволяет им приблизиться к плодам, расположенным далеко от ствола, или прыгать с одного дерева на другое. Изменения климата, произошедшие 11-12 млн лет назад, привели к сокращению лесных массивов в Африке и появлению больших открытых пространств, что и могло подтолкнуть предков австралопитеков к переходу к прямохождению по земле. В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4].
Такая тактика позволяет им приблизиться к плодам, расположенным далеко от ствола, или прыгать с одного дерева на другое. Изменения климата, произошедшие 11-12 млн лет назад, привели к сокращению лесных массивов в Африке и появлению больших открытых пространств, что и могло подтолкнуть предков австралопитеков к переходу к прямохождению по земле. В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4]. В 2008 году был открыт новый вид австралопитеков, A. sediba, живший в Африке менее двух миллионов лет назад. Хотя по отдельным морфологическим признакам он ближе к людям, чем более древние виды австралопитеков, что дало основание его открывателям объявить его переходной формой от австралопитеков к людям, одновременно с ним, по-видимому, уже существовали первые представители рода Homo[5], такие, как человек рудольфский, что исключает возможность того, что этот вид австралопитеков мог быть предком современного человека.
В 2008 году был открыт новый вид австралопитеков, A. sediba, живший в Африке менее двух миллионов лет назад. Хотя по отдельным морфологическим признакам он ближе к людям, чем более древние виды австралопитеков, что дало основание его открывателям объявить его переходной формой от австралопитеков к людям, одновременно с ним, по-видимому, уже существовали первые представители рода Homo[5], такие, как человек рудольфский, что исключает возможность того, что этот вид австралопитеков мог быть предком современного человека. .. Что такое Австралопитеки?
.. Что такое Австралопитеки? По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс. лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия. Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования.
По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс. лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия. Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования.
 Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам.
Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам. С находкой в 1985 году так называемого «чёрного черепа», который был очень похож на Paranthropus boisei, с характерным костяным гребнем, но при этом был на 2,5 млн старше, в родословной австралопитеков появилась официальная неопределённость, поскольку хоть и результаты анализов могут сильно меняться в зависимости от множества обстоятельств и среды, где находился череп, и, как водится, будут ещё десятилетиями перепроверяться десятки раз, но на текущий момент получается, что Paranthropus boisei не мог произойти от Australopithecus africanus, поскольку жил до них, и как минимум жил в одно время с Australopithecus afarensis, и, соответственно, тоже не мог от них произойти, если, конечно, не учитывать гипотезу, что парантропные формы австралопитеков и австалопитеки являются самцами и самками одного и того же вида.
С находкой в 1985 году так называемого «чёрного черепа», который был очень похож на Paranthropus boisei, с характерным костяным гребнем, но при этом был на 2,5 млн старше, в родословной австралопитеков появилась официальная неопределённость, поскольку хоть и результаты анализов могут сильно меняться в зависимости от множества обстоятельств и среды, где находился череп, и, как водится, будут ещё десятилетиями перепроверяться десятки раз, но на текущий момент получается, что Paranthropus boisei не мог произойти от Australopithecus africanus, поскольку жил до них, и как минимум жил в одно время с Australopithecus afarensis, и, соответственно, тоже не мог от них произойти, если, конечно, не учитывать гипотезу, что парантропные формы австралопитеков и австалопитеки являются самцами и самками одного и того же вида.
 В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные.
В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные. В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4].
В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4].
 Австралопитеки жили в плиоцене примерно с 4 млн лет назад, до менее миллиона лет назад. На временной шкале хорошо прослеживаются 3 длинных эпохи основных видов, примерно по миллиону лет на вид. Большинство видов австралопитеков были всеядны, однако были подвиды специализировавшиеся на растительной пище. Предком основного вида скорее всего был вид anamensis, а первым основным видом известным на данный момент стал вид afarensis, который просуществовал примерно 1 млн лет. По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс.
Австралопитеки жили в плиоцене примерно с 4 млн лет назад, до менее миллиона лет назад. На временной шкале хорошо прослеживаются 3 длинных эпохи основных видов, примерно по миллиону лет на вид. Большинство видов австралопитеков были всеядны, однако были подвиды специализировавшиеся на растительной пище. Предком основного вида скорее всего был вид anamensis, а первым основным видом известным на данный момент стал вид afarensis, который просуществовал примерно 1 млн лет. По-видимому, эти существа были не более чем обезьянами, по-человечески перемещавшимися на двух ногах, хотя и сгорбленно. Возможно, под конец они умели пользоваться подручными камнями для раскалывания, к примеру, орехов. Считается, что afarensis в конце разделился на два подвида: первая ветвь пошла к очеловечиванию и homo habilis, вторая — продолжила совершенствоваться в австралопитеках, образовав новый вид africanus. У africanus были немного менее развиты конечности, чем у afarensis, но зато они научились пользоваться подручными камнями, палками, и острыми осколками костей, и, в свою очередь, ещё через миллион лет образовали два новых высших и последних известных подвида австралопитеков boisei и robustus, которые просуществовали вплоть до 900 тыс. лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия. Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования.
лет до н. э. и уже могли самостоятельно изготавливать простейшие костяные и деревянные орудия. Несмотря на это, большинство австралопитеков входило в пищевую цепочку более прогрессивных людей обогнавших их в развитии по другим веткам эволюции, и с которыми они пересекались по времени, хотя продолжительность совместного существования указывает, что были и периоды мирного совместного существования. Головной мозг относительно крупный (530 см³), но по строению мало отличающийся от мозга современных человекообразных обезьян. По объёму он составлял не более 35 % от средних размеров мозга современного человека. Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам.
Головной мозг относительно крупный (530 см³), но по строению мало отличающийся от мозга современных человекообразных обезьян. По объёму он составлял не более 35 % от средних размеров мозга современного человека. Размеры тела также были невелики, не более 120—140 см в высоту, телосложение стройное. Предполагается, что самцы были существенно крупнее самок, чем у современных гоминид. Например, у современных людей мужчины в среднем лишь на 15 % крупнее женщин, в то время как у австралопитеков они могли быть на 50 % выше и тяжелее[2], что порождает дискуссии о принципиальной возможности столь сильного полового диморфизма у этого рода гоминид. Одним из основных характерных признаков для парантропов является костяной стреловидный гребень на черепе, присущий самцам современных горилл, поэтому нельзя до конца исключить, что робустерные/парантропные формы австралопитеков являются самцами, а грацильные — самками, альтернативным объяснением может быть отнесение форм разных размеров к разным видам или подвидам.

 Высказывается также предположение, что общие предки прямоходящих гоминид (в том числе людей и австралопитеков) жили на мелководье, и питались мелкими водными обитателями, а прямохождение сформировалось как адаптация к передвижению по мелководью. В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные.
Высказывается также предположение, что общие предки прямоходящих гоминид (в том числе людей и австралопитеков) жили на мелководье, и питались мелкими водными обитателями, а прямохождение сформировалось как адаптация к передвижению по мелководью. В пользу этой версии говорит ряд анатомо-физиологических и этологических особенностей, в частности — способность людей произвольно задерживать дыхание, на что способны не все плавающие животные. Такая тактика позволяет им приблизиться к плодам, расположенным далеко от ствола, или прыгать с одного дерева на другое. Изменения климата, произошедшие 11-12 млн лет назад, привели к сокращению лесных массивов в Африке и появлению больших открытых пространств, что и могло подтолкнуть предков австралопитеков к переходу к прямохождению по земле. В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4].
Такая тактика позволяет им приблизиться к плодам, расположенным далеко от ствола, или прыгать с одного дерева на другое. Изменения климата, произошедшие 11-12 млн лет назад, привели к сокращению лесных массивов в Африке и появлению больших открытых пространств, что и могло подтолкнуть предков австралопитеков к переходу к прямохождению по земле. В отличие от них предки современных шимпанзе и горилл специализировались на лазании по вертикальным стволам и лианам, чем обусловлена их кривоногая и косолапая походка на земле. Тем не менее, люди унаследовали много общего с этими обезьянами, включая строение костей рук, усиленных для хождения с опорой на костяшки пальцев[3][4]. В 2008 году был открыт новый вид австралопитеков, A. sediba, живший в Африке менее двух миллионов лет назад. Хотя по отдельным морфологическим признакам он ближе к людям, чем более древние виды австралопитеков, что дало основание его открывателям объявить его переходной формой от австралопитеков к людям, одновременно с ним, по-видимому, уже существовали первые представители рода Homo[5], такие, как человек рудольфский, что исключает возможность того, что этот вид австралопитеков мог быть предком современного человека.
В 2008 году был открыт новый вид австралопитеков, A. sediba, живший в Африке менее двух миллионов лет назад. Хотя по отдельным морфологическим признакам он ближе к людям, чем более древние виды австралопитеков, что дало основание его открывателям объявить его переходной формой от австралопитеков к людям, одновременно с ним, по-видимому, уже существовали первые представители рода Homo[5], такие, как человек рудольфский, что исключает возможность того, что этот вид австралопитеков мог быть предком современного человека.
 В таком случае Австралопитек Афарский является нам родственным видом, а не прямым предком. Также некоторые находки вносят сомнение в происхождение парантропов. Их ветка также могла отделиться ранее и существовать параллельно с грациалными австралопитеками.
В таком случае Австралопитек Афарский является нам родственным видом, а не прямым предком. Также некоторые находки вносят сомнение в происхождение парантропов. Их ветка также могла отделиться ранее и существовать параллельно с грациалными австралопитеками. Другое дело, что прямохождение освободило руки, и делали они это чаще.
Другое дело, что прямохождение освободило руки, и делали они это чаще. img.ria.ru/images/155654/78/1556547875_114:85:850:499_1920x0_80_0_0_893e23d1e20f0c6f14e66f4c94f03da8.jpg
img.ria.ru/images/155654/78/1556547875_114:85:850:499_1920x0_80_0_0_893e23d1e20f0c6f14e66f4c94f03da8.jpg С другой стороны, многие исследователи предполагают, что необычный «отложенный» характер развития человеческих детей связан с метаболизмом. По их мнению, организм женщины просто не смог бы одновременно поддерживать себя и более крупный плод, если бы он продолжал развиваться внутри утробы более девяти месяцев.Фьоренца и его коллеги сделали большой шаг к разрешению всех этих споров и раскрытию роли заботы о потомстве в эволюции человека, изучая структуру и химический состав зубов двух древних австралопитеков. Их останки были открыты еще в прошлом столетии в пещере Стеркфонтейн на северо-востоке ЮАР.Для чего антропологам изучать состав зубов? Дело в том, что относительно недавно ученые обнаружили, что эмаль коренных зубов людей и животных представляет собой своеобразный «химический паспорт», отражающий в себе многие детали жизни их обладателя.К примеру, доли изотопов стронция и тяжелого кислорода-18 в эмали зубов и в костной ткани человека позволяют понять, где он родился и в каких регионах страны он жил впоследствии, а соотношение атомов кальция, бария и стронция — то, какой пищей он питался.
С другой стороны, многие исследователи предполагают, что необычный «отложенный» характер развития человеческих детей связан с метаболизмом. По их мнению, организм женщины просто не смог бы одновременно поддерживать себя и более крупный плод, если бы он продолжал развиваться внутри утробы более девяти месяцев.Фьоренца и его коллеги сделали большой шаг к разрешению всех этих споров и раскрытию роли заботы о потомстве в эволюции человека, изучая структуру и химический состав зубов двух древних австралопитеков. Их останки были открыты еще в прошлом столетии в пещере Стеркфонтейн на северо-востоке ЮАР.Для чего антропологам изучать состав зубов? Дело в том, что относительно недавно ученые обнаружили, что эмаль коренных зубов людей и животных представляет собой своеобразный «химический паспорт», отражающий в себе многие детали жизни их обладателя.К примеру, доли изотопов стронция и тяжелого кислорода-18 в эмали зубов и в костной ткани человека позволяют понять, где он родился и в каких регионах страны он жил впоследствии, а соотношение атомов кальция, бария и стронция — то, какой пищей он питался. В данном случае, ученых интересовали доли бария, так как концентрация этого элемента в молоке матери заметно выше, чем в других видах пищи. Соответственно, отслеживая его концентрацию в разных слоях эмали и дентина, можно понять, как долго их обладатель пил молоко, когда он переключился на другую пищу и пил ли он молоко впоследствии.Как оказалось, оба австралопитека, которых изучили Фьоренца и его коллеги, были «маменькиными сыночками». Они постоянно пили молоко на протяжении как минимум девяти первых месяцев своей жизни и начали переходить на другие источники пропитания лишь после первого дня рождения.Более того, ученые заметили необычные флуктуации в уровне бария, указавшие на то, что юные австралопитеки могли периодически возвращаться к грудному молоку в последующие 4-5 лет жизни. Антропологи предполагают, что подобная «сезонность» не была случайной – судя по схожим колебаниям в уровне лития, древние гоминиды, скорее всего, поступали так в тяжелые времена, когда пищи на всех не хватало.
В данном случае, ученых интересовали доли бария, так как концентрация этого элемента в молоке матери заметно выше, чем в других видах пищи. Соответственно, отслеживая его концентрацию в разных слоях эмали и дентина, можно понять, как долго их обладатель пил молоко, когда он переключился на другую пищу и пил ли он молоко впоследствии.Как оказалось, оба австралопитека, которых изучили Фьоренца и его коллеги, были «маменькиными сыночками». Они постоянно пили молоко на протяжении как минимум девяти первых месяцев своей жизни и начали переходить на другие источники пропитания лишь после первого дня рождения.Более того, ученые заметили необычные флуктуации в уровне бария, указавшие на то, что юные австралопитеки могли периодически возвращаться к грудному молоку в последующие 4-5 лет жизни. Антропологи предполагают, что подобная «сезонность» не была случайной – судя по схожим колебаниям в уровне лития, древние гоминиды, скорее всего, поступали так в тяжелые времена, когда пищи на всех не хватало. Сам факт того, что у них была возможность пить молоко матери через 4-5 лет после рождения, как считает Фьоренца, говорит о двух вещах. С одной стороны, это открытие указывает на то, что самки австралопитеков очень долго ухаживали за своим потомством и были привязаны к нему. Жизнь детенышей, по всей видимости, сильно зависела от заботы их матерей.С другой стороны, подобное поведение самок и их потомства указывает на то, что первые производили детей на свет не так часто, как это делают многие современные приматы, вкладывая все усилия в «качественное» ухаживание за немногочисленными детенышами.Это предположение хорошо укладывается в популярные современные эволюционные теории, так называемые К-стратегии, связывающие развитие рода Homo с заботой о беспомощных детенышах. Если это действительно так, то тогда группы австралопитеков и последующих гоминид должны были больше быть похожи на коллективы современных людей или семьи китов-косаток, чем на стаи других приматов, заключают ученые.
Сам факт того, что у них была возможность пить молоко матери через 4-5 лет после рождения, как считает Фьоренца, говорит о двух вещах. С одной стороны, это открытие указывает на то, что самки австралопитеков очень долго ухаживали за своим потомством и были привязаны к нему. Жизнь детенышей, по всей видимости, сильно зависела от заботы их матерей.С другой стороны, подобное поведение самок и их потомства указывает на то, что первые производили детей на свет не так часто, как это делают многие современные приматы, вкладывая все усилия в «качественное» ухаживание за немногочисленными детенышами.Это предположение хорошо укладывается в популярные современные эволюционные теории, так называемые К-стратегии, связывающие развитие рода Homo с заботой о беспомощных детенышах. Если это действительно так, то тогда группы австралопитеков и последующих гоминид должны были больше быть похожи на коллективы современных людей или семьи китов-косаток, чем на стаи других приматов, заключают ученые. ru/20160228/1380917545.html
ru/20160228/1380917545.html ru
ru







 Чтобы выявить окончание, изменим рассматриваемое прилагательное по родам и числам:
Чтобы выявить окончание, изменим рассматриваемое прилагательное по родам и числам:

 С. Пушкина победил чертей.
С. Пушкина победил чертей. Проверочные слова: «город», «перегородка», «загородка», «огород», «изгороди».
Проверочные слова: «город», «перегородка», «загородка», «огород», «изгороди». В приставке «из» согласная «з» слышится как «с». Подтвердить написание звонкой согласной «з» можно при помощи правила: приставка на «з/с» заканчивается на звонкую согласную «з» перед звонкой корневой согласной («изгиб», «избрать»). Если корень начинается с глухой согласной буквы, то пишется приставка «ис» («истопник», «истратить»). Корень «городь» начинается со звонкого согласного «г», поэтому слово «изгородь» пишется с приставкой «из».
В приставке «из» согласная «з» слышится как «с». Подтвердить написание звонкой согласной «з» можно при помощи правила: приставка на «з/с» заканчивается на звонкую согласную «з» перед звонкой корневой согласной («изгиб», «избрать»). Если корень начинается с глухой согласной буквы, то пишется приставка «ис» («истопник», «истратить»). Корень «городь» начинается со звонкого согласного «г», поэтому слово «изгородь» пишется с приставкой «из».
 Корень этого слова Ред- и однокоренные слова составляются такие:
Корень этого слова Ред- и однокоренные слова составляются такие: Корнем слова редкий будет -редк-, -ий- это окончание. У слова редкий следующие однокоренные слова:
Корнем слова редкий будет -редк-, -ий- это окончание. У слова редкий следующие однокоренные слова: Такое впечатление, что в одном из слов какой-то шутник попросту буквы переставил.
Такое впечатление, что в одном из слов какой-то шутник попросту буквы переставил. Можно кардинальным образом пересмотреть эти взгляды — даже радикальные.
Можно кардинальным образом пересмотреть эти взгляды — даже радикальные.

 The article explains the structure of Wikidata lexemes and ways to access the data, and discusses the applications of the linked lexicographical dataset.
The article explains the structure of Wikidata lexemes and ways to access the data, and discusses the applications of the linked lexicographical dataset.
 They are commonly used widely to represent transcription factor binding sites and other conserved DNA and RNA sequences. Protein sequence logos are also useful for illustrating various biological properties of proteins. Create a sequence logo with Sequence Logo. Paste your multiple sequence alignment and the sequence logo is generated automatically. Use the sequence logo maker to easily create vector sequence logo graphs. Please refer to the Sequence Logo manual for the sequence logo parameters and configuration. Sequence Logo supports multiple color schemes and download formats.
They are commonly used widely to represent transcription factor binding sites and other conserved DNA and RNA sequences. Protein sequence logos are also useful for illustrating various biological properties of proteins. Create a sequence logo with Sequence Logo. Paste your multiple sequence alignment and the sequence logo is generated automatically. Use the sequence logo maker to easily create vector sequence logo graphs. Please refer to the Sequence Logo manual for the sequence logo parameters and configuration. Sequence Logo supports multiple color schemes and download formats.
 My Sequences allows you to upload your genome sequences and discover insights and patterns in your own DNA.
My Sequences allows you to upload your genome sequences and discover insights and patterns in your own DNA.


 Придумать и записать по два слова к каждой схеме. Выполнить морфемный разбор. Схемы записаны на доске.
Придумать и записать по два слова к каждой схеме. Выполнить морфемный разбор. Схемы записаны на доске.
 416 – устный и письменный разбор слов.
416 – устный и письменный разбор слов. Каково корневое слово слова «редкость»? rarb. Redc. orchardsd. рифы
Каково корневое слово слова «редкость»? rarb. Redc. orchardsd. рифы Прозаик, н. широкому читателю.
Прозаик, н. широкому читателю.