Вода это смесь: Чистые вещества и смеси — базовый урок по химии
Дистиллированная вода это смесь
При подготовке урока использованы материалы автора: Н.К.Черемисиной,
учителя химии средней школы № 43
Мы живем среди химических веществ. Мы вдыхает воздух, а это смесь газов (азота, кислорода и других), выдыхаем углекислый газ. Умываемся водой — это еще одно вещество, самое распространенное на Земле. Пьём молоко — смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный — лактоза. Едим яблоки, которые состоят из целого набора химических веществ — здесь и сахар, и яблочная кислота, и витамины. Когда прожеванные кусочки яблока попадают в желудок, на них начинают действовать пищеварительные соки человека, которые помогают усваивать все вкусные и полезные вещества не только яблока, но и любой другой пищи. Мы не только живем среди химических веществ, но и сами из них состоим. Каждый человек — его кожа, мышцы, кровь, зубы, кости, волосы построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар, витамины – вещества природного, естественного происхождения. Стекло, резина, сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина — искусственного происхождения, в природе их не было. Совершенно чистые вещества в природе не встречаются или встречаются очень редко.
Чем же отличаются чистые вещества от смесей веществ?
Индивидуальное чистое вещество обладает определённым набором характеристических свойств (постоянными физическими свойствами). Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем : «Смесь – целостная система, состоящая из разнородных компонентов».
Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем : «Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Изменение энергии при образовании
С помощью химических реакций
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:
Приведём примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями.
Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Суспензия – смесь речного песка с водой
Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке.
Смесь песка и поваренной соли в воде
На чем основано разделение гетерогенных смесей с помощью фильтрования?На различной растворимости веществ в воде и на различных размерах частиц. Через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Смесь порошка железа и серы
Действие магнитом или водой
Порошок железа притягивался магнитом, а порошок серы – нет.
Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно.
Раствор соли в воде – гомогенная смесь
Выпаривание или кристаллизация
Вода испаряется, а в фарфоровой чашке остаются кристаллы соли. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества.Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара.Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой. В специальных приборах – дистилляторах получают дистиллированную воду , которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей . В домашних условиях можно сконструировать такой дистиллятор:
Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти.
Перегонка используется для получения бензина, керосина, газойля из нефти.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография .
Дома вы можете проделать следующий опыт. Подвесьте полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
Прочитайте стихотворение Л. Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
II. Задания для закрепления
Задания для закрепления
1) Поработайте с тренажёрами №1-4 (необходимо загрузить тренажёр, он откроется в браузере Internet Explorer)
2) Решите задачу:
Дана смесь сахара, речного песка и железных опилок. Предложите способ разделения этой смеси.
3) Творческое задание:
Подготовьте электронную презентацию на тему «Чистые вещества и смеси, которые нас окружают»
Начнем с определений
Чистое вещество состоит из молекул одного вида.
Чистые вещества могут быть элементного состава (т.е. состоять из элементов одного вида) — простые вещества:
Чистые вещества — соединения — сложные вещества — состоят из молекул одного вида.
В природе не существует абсолютно чистых веществ. Например, особо чистый алюминий содержит 0,001% примесей.
Даже когда мы считаем воду чистой, то должны понимать, что там есть примеси. Даже дистиллированная вода не может считаться абсолютно чистым веществом — это тоже смесь, только примесей в ней намного меньше, чем в обычной воде.
Фильтрованная вода — тоже не чистое вещество, а смесь растворимых компонентов и воды, водопроводная — тем более!
Смеси — содержит молекулы нескольких видов.
Вещества, составляющие смесь, могут быть простыми и сложными .
Запомните: если вам дана задачи и в условии этой задачи дана смесь веществ, то вещества из этой смеси не реагируют друг с другом !
Однородные смеси (гомогенные)
«Гомо» — означает «одинаковый». Т.е. вещества в гомогенной смеси находятся в одинаковых агрегатных состояниях ( в одинаковых фазах):
Воздух — пример однородной газовой смеси (если учитывать именно газовый состав, частички пыли и т.п. мы здесь не учитываем), молярная масса воздуха принята равной 29 гмоль.
Все растворы — однородные смеси растворимого вещества и растворителя.
Неоднородные смеси (гетерогенные)
Неоднородная смесь — это смесь, где вещества находятся в разных фазах.
- Суспензия: тв. фаза+ жидка фаза; существует только в «смешанном» виде. Если такую смесь оставить на время. то под действием силы тяжести твердые частички осядут. Примеры: зубная паста, гуашь, эмалевые краски и т.д.
- Эмульсия — смесь двух жидкостей разной плотности. Со временем четко разделяются на две фазы. Примеры: жидкость для снятия макияжа, масло в воде, молоко и т.д.
- Аэрозоль — смесь газа и жидкости. Самый известный пример — туман или лак для волос.
С определениями чистых веществ и смесей мы определились, теперь давайте разберем способы разделения смесей.
- Химический способ разделения смеси: в реакцию вводится вещество, реагирующее с одним компонентом и не взаимодействующее с другим. В идеале образующееся новое вещество может образовывать другую фазу, чтобы его можно было легко удалить (осадок или газ).
Еще одно важное отличие чистых веществ от смесей — температуры плавления и кипения:
Чистые вещества
Смеси
имеют четкие температуры плавления и кипения
Дистиллированная вода представляет собой химическое соединение, состоящее из двух атомов водорода и одного атома кислорода. Молекула этого вещества химически обозначается формулой H2O. В результате процесса дистилляции из воды удаляются все примеси и ионы. Особые свойства дистиллированной воды рассматриваются в статье.
Важность воды для человека
В организме человека находится около 65 % воды. Это вещество является более важным для жизни человека, чем пища, поскольку без еды человек может поддерживать свои жизненно важные функции в течение нескольких недель, а без воды жизнь человека заканчивается через несколько дней.
Вода выполняет следующие функции в организме:
- подвод питательных веществ к клеткам и вывод продуктов распада из них;
- помощь в процессе пищеварения, которая заключается в образовании желудочного сока;
- постоянное увлажнение кожи, глаз, рта, носоглотки и суставов;
- регулирование температуры тела и метаболических процессов в организме.
Употребление достаточного количества воды в сутки способствует профилактике следующих состояний:
- диабет;
- гипогликемия;
- артрит;
- сухость кожи;
- ожирение и некоторые другие.
Если человек потеряет 20 % воды своего организма, то наступает немедленная смерть.
Что такое дистиллированная вода, какими физическими свойствами она обладает
Дистиллированная вода представляет собой жидкое вещество, состоящее только из молекул H2O. Получается оно в результате процесса дистилляции, который состоит в разделении жидких компонент в смеси.
Физико-химические свойства дистиллированной воды отличаются от таковых для обычной воды, которую человек пьет ежедневно. Это отличие связано с высокой чистотой дистиллированной воды. Например, если говорить о таком физическом свойстве, как электропроводность, то она является практически нулевой. В дистиллированной воде нет носителей тока, которые в воде обычной представляют собой ионы хлора, кальция, магния и фтора.
Отметим, что сама молекула H2O является электрически нейтральной, поэтому не может участвовать в процессе образования электрического тока. Справедливости ради отметим, что ионное произведение воды, то есть произведение молярных концентраций ионов H + и OH — составляет 10 -14 , то есть в одном литре воды существует 10 -7 моль атомов каждого из этих ионов. Однако эта концентрация является слишком малой, чтобы создавать практически ощутимый электрический ток.
Следует отметить еще один феномен, который касается такого физического свойства дистиллированной воды, как кипение. Процесс связан с наличием в веществе примесей и различных макроскопических частиц. В случае дистиллированной воды таких частиц нет, поэтому жидкость можно нагреть гораздо выше 100 °C, и она не будет кипеть. Если в такую «перегретую» воду добавить соль или сахар, или же просто начать мешать воду, то она начнет кипеть взрывным образом.
Процесс связан с наличием в веществе примесей и различных макроскопических частиц. В случае дистиллированной воды таких частиц нет, поэтому жидкость можно нагреть гораздо выше 100 °C, и она не будет кипеть. Если в такую «перегретую» воду добавить соль или сахар, или же просто начать мешать воду, то она начнет кипеть взрывным образом.
Процесс дистилляции
Этот процесс для очистки воды используется с давних времен. Суть процесса дистилляции методом выпаривания заключается в том, что в герметично закрытом сосуде (дистилляторе) кипит вода, ее пары поднимаются и попадают в специальную емкость, которая называется конденсатором. Здесь вещество снова переходит из газообразной в жидкую фазу в результате охлаждения. Конечным результатом дистилляционного процесса оказывается очищенная от примесей вода в конденсаторе и оставшийся осадок в дистилляторе.
Полученная данным способом жидкость не обладает 100 % чистотой, поскольку в процессе испарения вместе с паром увлекается небольшое количество частиц примеси.
Отметим, что такой метод дистилляции воды будет бесполезен, если в исходной воде присутствуют примеси, которые также при кипении будут переходить в газообразное состояние, например, спирты.
Дистиллированная вода и ее pH
Если говорить о химических свойствах дистиллированной воды, то в первую очередь следует сказать о ее pH. Показатель кислотности pH, или водородный показатель, математически определяется, как отрицательный десятичный логарифм от молярной концентрации катионов водорода. Если значение pH>7, то говорят о щелочной среде, если pH H2O + H2CO3.
В растворе в действительности существуют катион аммония H3O + и анион гидрокарбоната HCO3 — . Процесс насыщения углекислым газом вновь полученной дистиллированной воды, которая имеет pH = 7, происходит за 1-2 часа.
Следует также отметить, что pH ультрачистой воды тяжело измерить, поскольку такое физико-химические свойство дистиллированной воды, как электропроводность, практически равно нулю, что сильно искажает результаты специальных приборов для измерения кислотности — pH-метров.
Бидистиллированная вода
Такая вода получается в результате двойного процесса дистилляции. Такую жидкость часто называют химически чистой. Если результаты измерений чистоты бидистиллированной воды являются неудовлетворительными, то к ней применяют еще раз процесс дистилляции.
Она используется главным образом в качестве растворителя медикаментов для их парентерального введения. Также она применяется для приготовления гипоосмолярных растворов для их внутривенного или внутримышечного введения.
Применение дистиллированной воды
Вода является жизненно важным веществом для человека и для жизни на планете в целом. Ведь она считается универсальным растворителем и используется широко во всех сферах человеческой деятельности. Однако для своего использования вода должна обладать определенным уровнем качества. Процесс дистилляции является одним из способов улучшения качества воды.
Чаще всего дистиллированная вода используется в следующих процессах:
- Непосредственное потребление человеком. Полезные свойства дистиллированной воды заключаются в том, что она не содержит различных вредных примесей в своем составе. В жаркое время года люди пьют эту воду с кубиками льда. Поскольку она не содержит примесей, то температура ее замерзания точно соответствует 0 °C. Отметим, что физико-химические свойства дистиллированной воды после заморозки и последующей ее разморозки сохраняются.
- Химия. Дистиллированную воду используют для работы с различными реактивами в лабораторных условиях.
- Индустрия. Чистая вода используется при производстве охлаждающих напитков, а также в котлах, избегая тем самым образования в них накипи.
- Практически во всех медицинских процессах.
Возможные проблемы при употреблении дистиллированной воды
Дистиллированная вода не содержит примесей, которые присутствуют в обычной воде. Некоторые из этих примесей могут быть полезными, например, анионы фтора, которые специально добавляют в жидкость с целью профилактики кариеса. Поэтому постоянное употребление дистиллированной воды может значительно увеличить риск его образования.
Поэтому постоянное употребление дистиллированной воды может значительно увеличить риск его образования.
Ионы кальция и магния являются полезными для здоровья человека, поэтому рекомендуется компенсировать их отсутствие в дистиллированной воде употреблением других продуктов питания.
Чистые вещества и смеси. Растворы
ГБПОУ «Починковский сельскохозяйственный техникум»
Тема урока:
Чистые вещества и смеси. Растворы.
Цель урока:
- Выяснить, какое вещество считают чистым.
- Что такое смесь? Какие бывают смеси?
- Какими способами можно разделить смеси?
Смеси – это комбинация из нескольких веществ.
- Воздух
- Молоко
- Сплавы металлов
- Растворы
- Дым
- Стекло
- Кирпич
- Пластмасса
однородные
неоднородные
Неоднородные смеси- это смеси, в которых невооруженным глазом видны частицы веществ.
Однородные смеси- это смеси, в которых нельзя заметить частицы веществ.
Например: раствор марганцовки, сахара, воздух
Например: раствор извести, простокваша, грязный песок
твердые
газообразные
жидкие
гетерогенные
гомогенные
Вещества в смеси в одинаковом агрегатном состоянии, частицы равномерно распределены друг в друге. Это растворы (г, ж, тв)
Вещества в смеси в разных агрегатных состояниях. Взвеси, суспензии (тв+ж)
Вещества, находящиеся в одном агрегатном состоянии, образуют фазу смеси.
Сравнительная характеристика температур кипения дистиллированной и морской воды.
Чистые вещества
Чистыми называют вещества, которые состоят из одного вида частиц и обладают постоянными физическими свойствами.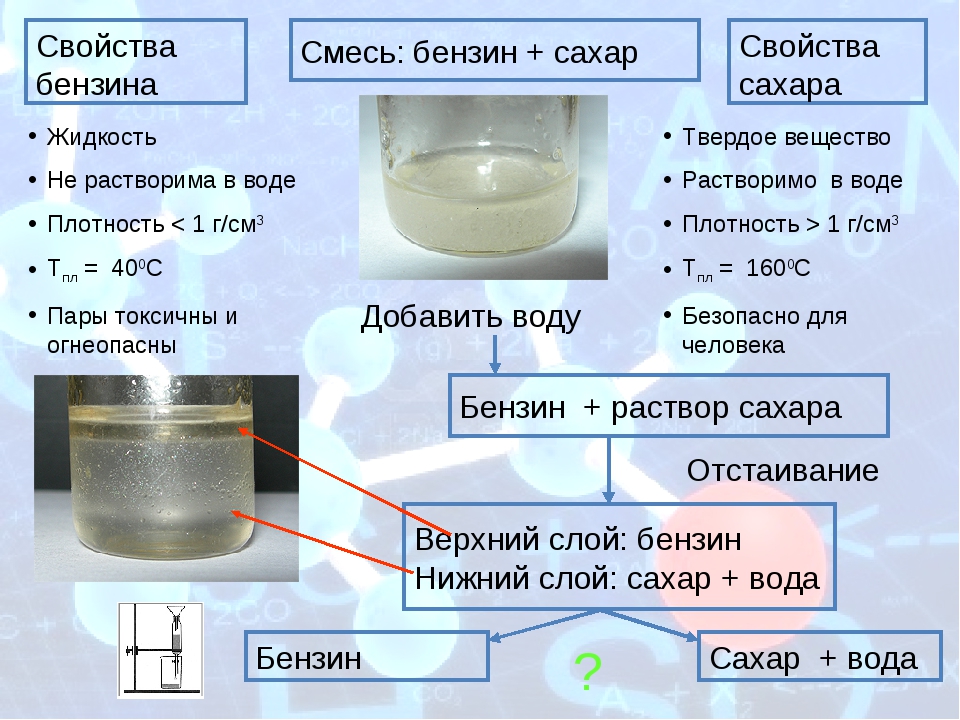
- Чистое вещество имеет постоянный состав.
- Чистое вещество обладает постоянными физическими свойствами (цвет, вкус, запах, t кип , t плав , ρ, агрегатное состояние и др.)
Примеры: дистиллированная вода, сахар, сера, железо, мел, медь…
Любой реальный образец вещества всегда содержит примеси других веществ!
Классификация химических реактивов в зависимости от количества примесей
Марка
Содержание марки
ч
Содержание примесей, %
чистый
чда
хч
Сфера применения
чистый для анализа
химически чистый
промышленное производство
спч
осч
спектрально чистый
10 — 10
анализ технических продуктов
лабораторные и научно-исследовательские
10 — 10
особо чистый
Электроника, техника и др.
10 — 10
Ядерная, космическая техника и др.
-3
-5
-5
-3
-5
-10
Как можно разделить смесь
Методы разделения смесей
Метод
Физическое свойство, используемое для разделения
Адсорбция , абсорбция
адсорбируемость, абсорбируемость
Разделение магнитом
магнетизм
Выпаривание (кристаллизация)
Дистилляция (ректификация)
растворимость твёрдого вещества
температура кипения
Фильтрование
Размер частиц
Центрифугирование
плотность
Отстаивание
плотность
Хроматография
адсорбируемость
Способы разделения неоднородных смесей
Неоднородная смесь
Отстаивание
Фильтрование
Делительная воронка
Действие магнитом
Отстаивание
- Разделение смеси вследствие разной плотности компонентов, происходит выделение из смеси нерастворимых веществ.

- Этот способ применяется в керамическом производстве для отделения песка от глины, очистки воды в искусственном водоеме.
Фильтрование
Фильтрование
Применяют для выделения из воды нерастворимых веществ. Этот метод применяется на водоочистительных станциях. В качестве фильтра там выступает слой песка.
Делительная воронка
Действие магнитом
Способы разделения однородных смесей
Однородные смеси
Кристаллизация
Дистилляция (перегонка)
Хроматография
Применение кристаллизации (выпаривания)
- Выделение твёрдого вещества из раствора при нагревании смеси
Кристаллизация
Дистилляция или перегонка
- Разделение смесей на отдельные компоненты с близкими точками кипения путём испарения жидкостей и последующей конденсацией паров
- Этот способ разделения смесей основан на различии в температурах кипения растворимых друг в друге компонентов.
- Его применяют для получения дистиллированной воды в фармакологии, а также для заполнения систем охлаждения автомобилей.
- Для получения нефтепродуктов: бензина, керосина.
- Для получения из воздуха кислорода и азота.
Центрифугирование
- Разделение смесей под действием центробежной силы в центрифугах (барабанах, вращающихся с большой скоростью)
Хроматография
Различная поглощаемость компонентов смеси веществом.
Вывод
Отличительные
особенности
Чистое вещество
Смесь
Постоянный состав;
Одно вещество;
Постоянные физические свойства;
Разделить можно только с помощью химических реакций.
Непостоянный состав;
Различные вещества;
Непостоянные физические свойства;
Разделить можно с помощью физических методов.
Игра «Крестики-нолики» Найдите выигрышный путь. Выигрышный путь составляют чистые вещества или смеси.
сахар
речная вода
гранит
молоко
спирт
сметана
глина
золото
алюминий
Определите чистые вещества и смеси (однородные и неоднородные)
- Бензин
- Крахмал
- Молоко
- Спиртовой раствор йода
- Речная вода
- Глина
- Минеральная вода
Задание: Предложите способы очистки воды от бензиновых нефтепродуктов .
Творческое задание
- Вы пошли в поход. Совершенно случайно, вся ваша соль намочилась и к тому же в нее попали кусочки грязи. Другой соли нет. Как вы поступите?
Предложите способы разделения таких смесей:
- Бензин+вода+сахар
- Соль+вода+песок
- Порошок железа+ вода+глицерин
Свойства сахара
Свойства бензина
Смесь: бензин + сахар
- Жидкость
- Не растворима в воде
- Плотность
- Т пл = 40 0 С
- Пары токсичны и огнеопасны
- Твердое вещество
- Растворимо в воде
- Плотность 1 г/см 3
- Т пл = 160 0 С
- Безопасно для человека
Добавить воду
Бензин + раствор сахара
Отстаивание
Верхний слой: бензин
Нижний слой: сахар + вода
Бензин
Сахар + вода
?
1 г/см 3 Т пл = 1610 0 С Твердое вещество Хорошо растворимо в воде Плотность 1 г/см 3 Т пл = 801 0 С Добавим воду Неоднородная смесь: раствор соли + песок Песок Однородная смесь: Соль + вода Фильтрование Выпаривание Кристаллизация Соль «Свойства песка
Свойства соли
Смесь: соль + песок
- Твердое вещество
- Не растворимо в воде
- Плотность 1 г/см 3
- Т пл = 1610 0 С
- Твердое вещество
- Хорошо растворимо в воде
- Плотность 1 г/см 3
- Т пл = 801 0 С
Добавим воду
Неоднородная смесь: раствор соли + песок
Песок
Однородная смесь: Соль + вода
Фильтрование
Выпаривание Кристаллизация
Соль
Творческое задание
- Помогите героине русской народной сказки «Василиса Прекрасная».
 В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли. Героине сказки помогли птицы. Опишите, как можно разделить крупы, мак и землю научными методами?
В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли. Героине сказки помогли птицы. Опишите, как можно разделить крупы, мак и землю научными методами?
Предложите способы разделения таких смесей:
- Медные + железные опилки
- Песок + древесная стружка
- Ж елезны е опил ки + сол ь + мел
1. Смесью является:
A. Дистиллированная вода
B. Воздух
C. Алюминий
Д . Азот
2. Смесью не является:
- Дистиллированная вода
- Воздух
- Почва
3. Из предложенных веществ назовите чистые:
- Воздух
- Вода в реке
- Вода в облаке
- Сахар
- Бензин
- Поваренная соль
С пасибо за хорошую работу на уроке !
Вода – это смесь двух различных жидкостей — интересные обзоры — Magicwaters
Вода – основа всего живого на нашей планете. Но эта простейшая и сама привычная жидкость ведет себя не так, как другие жидкости, и зачастую демонстрирует удивительные и аномальные свойства.
Например, у воды имеется более 70 свойств, которые отличают ее от других жидкостей:
температура плавления, плотность, теплоемкость и другие. По мнению ученых, эти свойства являются предпосылками для возникновения жизни, какой мы ее знаем.
Проведенные ранее исследования показывали, что оксид водорода способен находиться в двух жидких формах с возможностью взаимной конвертации. Так, аморфный лед, в котором молекулы воды расположены случайным образом, может принимать состояние с высокой и низкой плотностью. Проверить эту гипотезу было крайне проблематично, и только теперь группа стокгольмских ученых смогла справиться с задачей.
Совместный труд двух научных лабораторий, Национальной лаборатории Аргонн близ Чикаго и Большой рентгеновской лаборатории DESY в Гамбурге позволили сделать открытия в понимании свойств воды. Лаборатория Аргон смогла продемонстрировать различные структуры жидкости. Лаборатория DESY показала динамику перехода состояний с помощью рентгеновских лучей. Первооткрыватель рентгеновских лучей Вильгельм Рентген в далеком прошлом предполагал, что вода может существовать в двух разных формах. Спустя много лет его открытие помогло это доказать.
Лаборатория Аргон смогла продемонстрировать различные структуры жидкости. Лаборатория DESY показала динамику перехода состояний с помощью рентгеновских лучей. Первооткрыватель рентгеновских лучей Вильгельм Рентген в далеком прошлом предполагал, что вода может существовать в двух разных формах. Спустя много лет его открытие помогло это доказать.
Немецкие, шведские и австрийские ученые смогли проследить за трансформацией образца воды при быстром охлаждении и заметить возникновение двух форм аморфного льда. Считается, что лед – это упорядоченная кристаллическая фаза воды, но наиболее распространенная на Земле фаза является аморфной, неупорядоченной, уточняет издание Science Daily.
Например, удалось установить, что при температуре –163 °C, плотный атмосферный лед может переходить в плотную жидкость, а при дальнейшем нагревании появляется другая форма воды — менее плотная. Однако при температуре –143 °C скорость перехода снижается.
Полученные физиками результаты косвенно подтверждают теорию, что вода при комнатной температуре находится в двух разных формах, у которых разная вязкость и плотность.
Урок 7. про воздух и воду — Окружающий мир — 2 класс
Окружающий мир, 2 класс
Урок 7. Про воздух и воду
Перечень вопросов, рассматриваемых на уроке:
- Воздух и вода.
- Охрана чистоты воздуха и воды.
Глоссарий по теме
Воздух — смесь газов, составляющая атмосферу Земли.
Ветер — движение, поток воздуха в горизонтальном направлении.
Атмосфера -газообразная оболочка, окружающая Землю, некоторые другие планеты, Солнце и звёзды.
Ключевые слова
воздух, атмосфера, ветер.
Основная и дополнительная литература по теме урока:
1.Окружающий мир 2кл.:учеб.пособие для общеобразоват. организаций. В 2 ч. / А. А. Плешаков. — М.: Просвещение, 2017. С. 48-55
2.Окружающий мир. Тетрадь учебных достижений. 2кл.:учеб.пособие для общеобразоват. организаций / А. А. Плешаков, З. Д. Назарова. — М.: Просвещение, 2017. С. 35-38
организаций / А. А. Плешаков, З. Д. Назарова. — М.: Просвещение, 2017. С. 35-38
Теоретический материал для самостоятельного изучения
1. Всегда ли информация бывает правдивой? Недавно стало известно, что в мире существует 5 океанов. Пересчитав несколько раз, так и не смогли найти пятый. Известно только четыре океана – Тихий, Атлантический, Индийский и Северный Ледовитый.
2. А что касается пятого, то информация про него такая:
Это самый большой океан из всех существующих, и вы, каждый день, час, минуту, секунду, сами того не замечая «купаетесь» в нём! Океан этот не солёный, не пресный, у него нет берегов и в нём нет воды! Словно огромные серебряные рыбы проплывают по его просторам самолёты!
А как Вы думаете, о каком океане мы сегодня поговорим?
3. Я и туча, и туман,
И ручей, и океан,
И летаю, и бегу,
И стеклянной быть могу!
- Вода занимает большую часть земного шара. На картах и глобусе вода
обозначена синим цветом — это океаны, моря, озёра, реки.
5. А какая может быть вода?
Вода в природе может находиться в трёх состояниях: жидком, твёрдом и газообразном.
Жидкое: вода рек,океанов,морей; дождь и роса
Твёрдое: град, лёд, снег, иней
Газообразное: пар.
6. Вся ли вода на планете пригодна для питья?В океанах и морях вода – солёная.В некоторых странах строят специальные опреснительные станции, так как запасов пресной воды крайне мало.
В списке стран, наиболее богатых по запасам пригодной к употреблению пресной воды, Россию можно поставить на одно из лидирующих мест. Самым крупным источником пресной воды в России является озеро Байкал — в нём сосредоточено до двадцати процентов от пресной воды всей планеты Земля.
7. Как Вы думаете, о чём мы должны поговорить сейчас? Конечно, о бережном отношении к воде! Всему живому нужна чистая вода. А она, во многих местах, загрязняется тем, что в неё попадают сливы сточных вод заводов и фабрик, выбрасывание мусора в воду, мытьё машин
8. Ну а как же без воздуха?! Летом он бывает тёплым,
Ну а как же без воздуха?! Летом он бывает тёплым,
Веет холодом зимой,
Когда иней красит стёкла
И лежит на них каймой,
Мы о нём не говорим.
Просто мы его вдыхаем –
Он ведь нам необходим!
9. Всё живое давно бы задохнулось, если бы не растения. И дуб-великан, и травинка, и крохотные водоросли жадно ловят углекислый газ, он необходим растениям для питания. А возвращают в воздух кислород. Леса, луга, поля, парки, сады – все растения на Земле вместо углекислого газа дают нам живительный кислород. Чем больше вокруг зелени, тем чище воздух.
10. Воздух – это смесь разных газов: кислород -21%; азот – 1 %; углекислый газ -78%.
При дыхании живые существа поглощают из воздуха кислород, а выделяют углекислый газ.
11. Чистый воздух необходим для всего живого. К сожалению, из труб заводов и фабрик в воздух попадают вредные вещества и он загрязняется. Такой воздух опасен для людей, растений, животных
12 Чистый воздух и чистая вода – это главные и удивительные богатства природы, которые необходимо охранять и беречь!
Разбор типового тренировочного задания
- Сортировка элементов по категориям — Использование воздуха человеком.
Правильный ответ:
Разбор типового контрольного задания
2. Впишите в текст пропущенные слова:
Из труб ______ и _______в воздух попадают вредные _______ и он загрязняется. Такой _______ опасен для _________, _________,____________.
Чистый _______ – удивительное ___________ природы, которое необходимо _________ и ___________.
Ответ:
Из труб заводов и фабрик в воздух попадают вредные вещества и он загрязняется. Такой воздух опасен для людей, растений, животных.
Чистый воздух – удивительное богатство природы, которое необходимо беречь и охранять.
Вода и пищеварение
Вода и пищеварение
Что такое желудочный сок?
Желудочный сок – это смесь из различных веществ, выделяемых клетками желудка. Соляная кислота, бикарбонаты, и различные ферменты, например, пепсин и внутренний фактор Касла. Все они выполняют свои особые функции. Соляная кислота создает и поддерживает нужный уровень кислотности для работы фермента пепсина. Пепсин необходим для переваривания молекул белка. Бикарбонаты защищают слизистую желудка от воздействия на нее агрессивной соляной кислоты. А внутренний фактор Касла имеет дело с витамином B12 – способствует его усвоению в кишечнике.
Все компоненты желудочного сока растворены в воде. В 1 л желудочного сока содержится 995 мл воды.
Еда и вода
«Запивать еду нельзя, потому что кислотность в желудке снизится, и пищеварение будет нарушено» — основной аргумент о несовместимости воды и еды. Но как мы уже знаем, желудочный сок сам состоит почти полностью из воды. Так и многие продукты содержат большое количество жидкости. Например, огурцы, зелень, помидоры и многие другие. Попадая в желудок, еда точно также, как и простая вода снижает кислотность, но в ответ на это железистые клетки желудка продолжают вырабатывать соляную кислоту до тех пор, пока уровень pH не достигнет нужно значения.
Сама пища переваривается в желудке достаточно долго — около 4х часов, а вот вода в желудке почти не задерживается и продвигается дальше в кишечник. Если запивать еду не водой, а например газировкой или другими сладкими напитками стоит помнить о том, что они содержат много сахара. Если выбирать между водой, чаем или кофе то существенной разницы между ними нет, но стоит учитывать индивидуальные особенности организма. Они могут вызвать изжогу или метеоризм.
Температура воды
«Холодная еда и вода быстрее проходят желудок, чувства насыщения нет, а значит постоянное чувство голода приведет к перееданию и ожирению».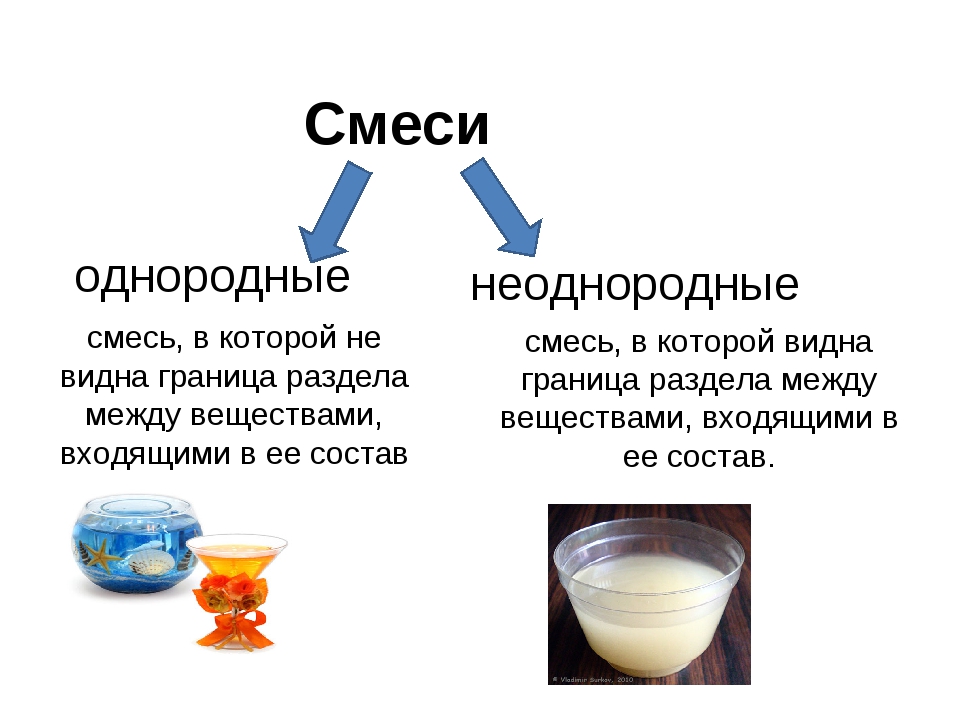 Очередной популярный миф. На самом деле температура еды и воды совершенно не влияют на скорость пищеварения. Это подтверждают исследования, в ходе которых испытуемым давали выпить растворы содержащих углеводы и с температурой 12 градусов Цельсия. С помощью назогастральных зондов измеряли температуру в желудке. В итоге температура сразу после выпитой жидкости очевидно снижалась, но через 5 минут возвращалась к исходному состоянию. Из этого можно сделать вывод, что скорость пищеварения в желудке не зависит от температуры.
Очередной популярный миф. На самом деле температура еды и воды совершенно не влияют на скорость пищеварения. Это подтверждают исследования, в ходе которых испытуемым давали выпить растворы содержащих углеводы и с температурой 12 градусов Цельсия. С помощью назогастральных зондов измеряли температуру в желудке. В итоге температура сразу после выпитой жидкости очевидно снижалась, но через 5 минут возвращалась к исходному состоянию. Из этого можно сделать вывод, что скорость пищеварения в желудке не зависит от температуры.
Вывод
Пить во время еды можно и ничего плохого с вами не случится, но предпочтение стоит отдавать негазированной и несладкой воде. А также лучше не стоит пить во время пережевывания пищи — она должна пропитаться ферментами и слюной, необходимыми для пищеварения.
https://link.springer.com/article/10.1007%2FBF03018767
https://www.ncbi.nlm.nih.gov/m/pubmed/11188020/
http://ucce.ucdavis.edu/files/datastore/608-87.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1451262/
Как приготовить детскую смесь
Для того чтобы Ваш малыш рос здоровым и чувствовал себя хорошо, важно не только грамотно выбрать молочную смесь, но и правильно ее использовать.
В первые месяцы жизни организм ребенка проходит период адаптации к внеутробным условиям, весь первый год малыш интенсивно растет и развивается. Все, что окружает малыша с самого рождения, должно способствовать его развитию, быть максимально полезным и безопасным. Именно поэтому при приготовлении детской смеси необходимо строго соблюдать правила гигиены, рекомендации по обращению с продуктом и учитывать условия хранения.
Для приготовления смеси применяйте только кипяченую воду – ее необходимо сильно прокипятить в течение как минимум 5 минут. Бутилированная вода не является стерильной, ее также следует кипятить перед использованием. Не следует разогревать воду в микроволновой печи.
Кипяченую воду остудите до рекомендуемой производителем температуры и разведите смесь, следуя инструкции. Для отмеривания смеси пользуйтесь только прилагаемой к упаковке мерной ложкой.
Если Вы развели смеси больше, чем на одно кормление, она должна храниться в холодильнике при температуре 2-4°C и быть использована в течение 24 часов. После начала кормления порция смеси должна быть использована в течение часа, так как разведенная детская смесь является прекрасной средой для размножения микроорганизмов. По прошествии часа остаток смеси следует вылить.
Нередко новорожденный малыш может уснуть прямо во время кормления – не переживайте, если такое приключилось и с Вашим крохой. Просто легонько погладьте ребенка по щеке или носу, и если он проснется, продолжите кормление.
Обратите внимание.
Сухие детские смеси после вскрытия упаковки не являются стерильными. Используйте продукт в соответствии с инструкцией и рекомендациями врача.
При вскрытии упаковки с сухой детской смесью, содержащей полезные жиры Омега-3, Омега-6, возможен легкий рыбный запах – это нормально, ведь подобные жирные кислоты также содержатся в рыбьем жире, о пользе которого мы знаем с детства. Этот запах выветривается и не чувствуется в разведенной смеси.
Не готовьте и не разогревайте смесь в микроволновой печи. В СВЧ-печах продукты разогреваются неравномерно, поэтому часть смеси может оказаться слишком горячей для малыша.
Какая посуда понадобится для приготовления смеси?
Бутылочка, соска, крышка, мерная ложечка, нож для удаления избытка смеси с ложечки. Две кастрюли: в одной Вы будете кипятить посуду, в другой – воду для приготовления смеси. Существуют также удобные современные стерилизаторы и подогреватели, которыми Вы можете пользоваться при приготовлении смеси.
Существуют также удобные современные стерилизаторы и подогреватели, которыми Вы можете пользоваться при приготовлении смеси.
Приготовление порции на одно кормление
1.Вымойте руки с мылом и вытрите их чистым полотенцем. Тщательно вымойте бутылочку, соску, крышку, мерную ложку и всю посуду, которая будет использоваться при приготовлении смеси. Делать это лучше всего с помощью специального средства для детской посуды – оно более щадящее. Внимательно отнеситесь к мытью детской посуды в посудомоечной машинке: из-за узкого горлышка бутылочка нередко остается непромытой, несмотря на то, что бутылочки большинства производителей разрешается мыть в посудомоечной машинке. Для мытья бутылочек предусмотрены специальные ершики, с помощью которых Вы сможете тщательно промыть бутылочку.
2.Сполосните всю посуду, чтобы удалить средство для мытья, и прокипятите ее в течение 5 минут.
3.Для приготовления смеси подготовьте чистую поверхность.
4.В отдельной кастрюле прокипятите воду при сильном кипении в течение 5 минут. Если в инструкции не указано другое, то следует остудить воду не менее чем до 70°С, для этого следует оставить воду не более чем на 30 минут после закипания.
5.Налейте необходимое количество теплой, предварительно прокипяченной воды в простерилизованную бутылочку. Помните, что не следует смешивать кипяченую и некипяченую воду для достижения нужной температуры.
6.Наполните смесью прилагаемую мерную ложку, затем удалите избыток смеси («горку») с помощью лезвия чистого ножа.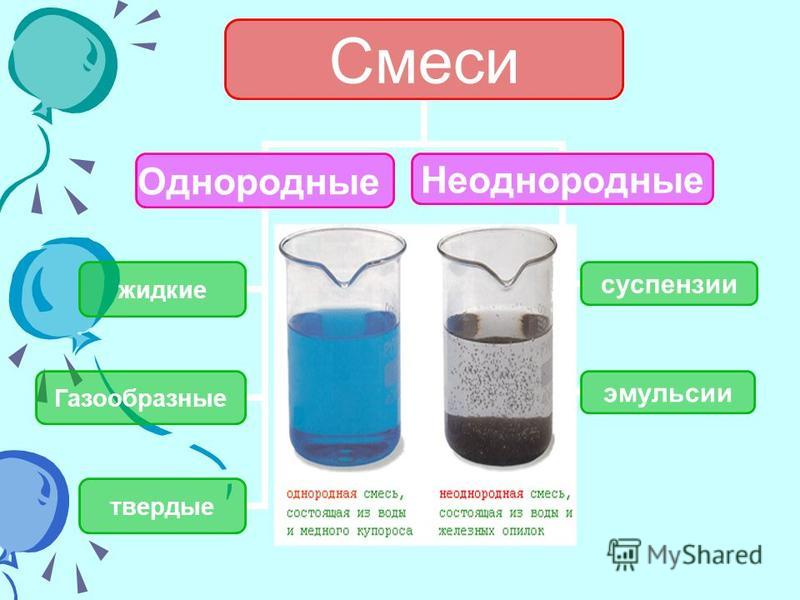
7.Добавьте смесь в бутылочку с водой. Обычно на каждые 30 мл следует добавлять 1 мерную ложку – однако необходимо свериться с инструкцией, так как бывают мерные ложки разного объема. Следует добавлять сухую смесь в бутылочку с водой, а не наоборот.
8.Перемешайте до полного растворения. Для кормления смесь должна иметь температуру тела человека, то есть 35-37°С – проверьте температуру смеси и кормите ребенка. Если смесь слишком горячая, ее можно быстро остудить, поместив бутылочку в емкость с холодной водой.
9.Устройтесь поудобнее, обнимите малыша и во время кормления смесью не теряйте физического и зрительного контакта с ним. Заранее подготовьте салфетку на случай излишка смеси, а после кормления поносите малыша «столбиком», чтобы он отрыгнул воздух, попавший в желудок во время кормления.
Остатки недоеденной ребенком в течение часа смеси, оставшейся в бутылочке, вылейте.
Как правильно разогревать бутылочки с молочной смесью?
Если вы приготовили несколько порций смеси для кормления малыша заранее, и бутылочка со смесью только-только из холодильника, важно не просто разогреть смесь, но и сделать это правильно. Итак, вот как следует это делать:
- Достаньте бутылочку с приготовленной смесью из холодильника непосредственно перед кормлением.
- Разогрейте смесь, поместив бутылочку со смесью в емкость с горячей водой так, чтобы уровень воды был ниже края бутылочки. Чтобы смесь разогревалась равномерно, следует периодически встряхивать или вращать бутылочку, при этом время разогревания не должно превышать 15 минут.

- Проверьте температуру смеси, капнув немного на внутреннюю сторону запястья. Смесь не должна быть слишком горячей, ее необходимо остудить до температуры тела человека – 35-37°С.
Как брать заранее приготовленную детскую смесь с собой в поездки и на прогулки?
Первым делом необходимо остудить приготовленную смесь. Во время поездки или прогулки хранить ее следует в холодном месте – это поможет предотвратить развитие болезнетворных бактерий.
- Приготовьте смесь, как Вы делаете это обычно, остудите ее и поставьте в холодильник (при температуре не выше 5°С, если в инструкции не указано иное).
- Достаньте смесь из холодильника непосредственно перед выходом из дома и положите ее в специальную сумку-холодильник.
- Оказавшись на месте, Вы можете снова поставить бутылочки со смесью в холодильник или разогреть их и использовать для кормления.
- Помните, что смесь должны быть использована в течение 24 часов.
Если намеченная поездка или прогулка превышает по времени два часа, у Вас может не получиться сохранить бутылочки со смесью холодными – в таком случае для кормления необходимо использовать свежеприготовленную смесь. Предусмотрите это заранее и возьмите с собой необходимое количество сухой смеси в чистом, стерилизованном контейнере. Приготовьте смесь, используя кипяченую воду – температура воды должна быть не ниже 70°С (если в инструкции не указано иное).
Соблюдая правила гигиены и обращения со смесью для своего малыша, Вы обеспечите ему комфортные условия для здорового роста и развития!
При подготовке статьи использованы материалы:
- Как правильно приготовить молочную смесь для кормления из бутылочки в домашних условиях.
 Всемирная организация здравоохранения, 2007 г.
Всемирная организация здравоохранения, 2007 г. - Безопасное приготовление, хранение и обращение с сухой детской смесью — Руководящие принципы. Всемирная организация здравоохранения, 2007 г.
Что такое антифриз, и почему его следует заливать в автомобиль?
Двигатель автомобиля генерирует большое количество тепла, и если данный процесс не контролировать, то это может привести к серьезному повреждению. По этой причине антифриз важен для вашего автомобиля. Антифриз после его смешивания с водой и добавления в радиатор помогает регулировать температуру, одновременно защищая и смазывая разные металлические детали в системе охлаждения двигателя.
Что такое антифриз и почему он так важен для автомобиля?
Антифриз – это слегка окрашенная жидкость, которая (вместе с водой) заливается в радиатор для оказания помощи в регулировании температуры двигателя. Ее важным компонентом является этиленгликоль, который снижает температуру замерзания воды и повышает ее температуру закипания. Это защищает воду в радиаторе автомобиля от замерзания, закипания и испарения. Антифриз, наряду с топливом и маслом, важен для надлежащей работы автомобиля. Без антифриза тепло, возникающее в процессе сгорания топлива, приведет к быстрому перегреву двигателя или даже к его полному заклиниванию. Антифриз также смазывает компоненты системы, которые контактируют с водой, и защищает металлические компоненты от коррозии.
Антифриз и охлаждающая жидкость — это одно и то же?
Термины «Антифриз» и «Охлаждающая жидкость» зачастую используются взаимозаменяемым образом, однако, это не совсем правильно. Антифриз это один из компонентов охлаждающей жидкости двигателя. Если говорить точнее, то охлаждающая жидкость это смесь антифриза и воды. Для охлаждения двигателя недостаточно только одной воды. Тепло, возникающее в процесс сгорания топлива, приведет к ее закипанию. Летом вода будет испаряться, а зимой она будет замерзать, что делает ее бесполезной. Большинство производителей автомобилей рекомендуют смешивать воду и антифриз в радиаторе в пропорции 50/50.
Летом вода будет испаряться, а зимой она будет замерзать, что делает ее бесполезной. Большинство производителей автомобилей рекомендуют смешивать воду и антифриз в радиаторе в пропорции 50/50.
Почему требуется замена антифриза?
Со временем антифриз, как и все жидкости в автомобиле, теряет свои рабочие характеристики, а его кислотность повышается. Это вызывает коррозию, которая ведет к повреждению радиатора и прочих важных компонентов системы охлаждения, таких как насос, шланги, термостат и крышка радиатора.
В радиаторе автомобиля также могут скапливаться ржавчина, грязь и прочие вредные частицы. Такие загрязняющие вещества могут снижать способность антифриза регулировать температуру двигателя. Это ведет, в свою очередь, к перегреву двигателя, разрыву блока цилиндров и даже к привариванию поршня к цилиндру.
Как часто следует проводить замену антифриза и как это делается?
Всегда сначала читайте инструкцию по эксплуатации автомобиля. Как правило, замена антифриза выполняется каждые 48,000 км (30,000 миль) или один раз в три года, в зависимости от того, что наступит раньше. Перед заменой антифриза подождите, пока не остынут радиатор и двигатель автомобиля. На это, как минимум, требуется один час. Откройте капот и проверьте радиатор и шланги на наличие трещин и утечек. Поврежденные детали необходимо заменить или отремонтировать. Снимите крышку радиатора. Выкрутите сливную пробку радиатора и слейте охлаждающую жидкость. Закрутите сливную пробку, заправьте радиатор дистиллированной водой и запустите двигатель на 10 минут. Дайте двигателю остыть и снова слейте жидкость. Всегда заправляйте радиатор с его промывкой, используя дистиллированную воду. Повторяйте эту процедуру до тех пор, пока сливаемая вода не будет чистой. После завершения промывки залейте в радиатор смесь антифриза и дистиллированной воды в пропорции 50/50 и закройте радиатор крышкой.
Как заливать антифриз в автомобиль?
Убедитесь в том, что двигатель и радиатор остыли. Для этого требуется, как минимум, один час. Подготовьте точную смесь антифриза и дистиллированной воды в пропорции 50/50. Осторожно снимите крышку радиатора, залейте раствор антифриза и закройте радиатор крышкой.
Для этого требуется, как минимум, один час. Подготовьте точную смесь антифриза и дистиллированной воды в пропорции 50/50. Осторожно снимите крышку радиатора, залейте раствор антифриза и закройте радиатор крышкой.
Инструкция по эксплуатации автомобиля является последней инстанцией по таким процедурам как эта, поэтому всегда, сначала читайте инструкцию по эксплуатации. Также важно помнить о том, что система охлаждения автомобиля находится под давлением и аккумулирует опасные количества тепла. Никогда не выполняйте такую процедуру при нагретом двигателе и радиаторе. Несоблюдение мер безопасности может привести к серьезному телесному повреждению.
Странные науки: чистая вода и водные смеси
Морская вода представляет собой смесь множества различных веществ. Некоторые из этих веществ можно наблюдать, когда вода в морской воде испаряется и оставляет после себя соль. Вода, H 2 O, представляет собой чистое вещество, соединение, состоящее из водорода и кислорода. Хотя вода является самым распространенным веществом на Земле, она редко встречается в природе в чистом виде. В большинстве случаев необходимо создавать чистую воду. Чистая вода называется дистиллированной или деионизированной водой.В дистиллированной воде все растворенные вещества, смешанные с водой, были удалены испарением. Когда вода испаряется, она перегоняется или оставляет соль. Чистая испарившаяся вода собирается и конденсируется с образованием дистиллированной воды.
Водопроводная вода не дистиллированная (SF Рис. 2.9 A). В большинстве водопроводных водопроводных сетей содержится хлор. Хлор используется для уничтожения микробов в воде. В общественной водопроводной воде могут быть намеренно растворены другие минералы, например фторид, предотвращающий кариес.В некоторых районах водопроводная вода поступает прямо из колодцев и не подвергается обработке. Минеральный состав колодезной воды варьируется от места к месту и придает воде из разных мест особый вкус (SF Рис. 2.9 B).
2.9 B).
Многие люди покупают или делают дистиллированную воду самостоятельно. В районах, где вода загрязнена вредными веществами из-за окружающей среды или стихийного бедствия, употребление дистиллированной воды может сохранить здоровье людей. Если людям не нравится вкус воды в том или ином месте из-за растворенных минералов, которые придают ей характерный вкус, они могут предпочесть более нейтральный вкус дистиллированной воды.
Дистиллированная вода может быть полезной для людей, но у них может быть слишком много хорошего. может чрезмерно обезвоживать или иметь слишком много воды в вашем теле. Хотя человеческие тела в основном состоят из воды, важно поддерживать правильный баланс воды и других веществ. Когда спортсмены потеют, они теряют воду и соль (SF Рис. 2.10 A.). Если спортсмен после сильного потоотделения выпьет слишком много дистиллированной или водопроводной воды, он может нарушить водно-солевой баланс в своем организме.Это влияет на способность их тел нормально функционировать. В редких случаях, если спортсмен потребляет слишком много дистиллированной или водопроводной воды, водно-солевой дисбаланс слишком велик, и спортсмен может умереть. Это причина, по которой серьезные спортсмены пьют спортивные напитки с балансом воды, солей и сахаров, чтобы поддерживать их должным образом гидратированными (SF Рис. 2.10 B). Большинство людей могут получить надлежащий баланс воды и солей с помощью обычной диеты, и им не нужно пить спортивные напитки.
гомогенных и гетерогенных смесей | Химия для неосновных
Цели обучения
- Определить смесь.
- Определите однородную смесь.
- Приведите примеры однородных смесей.
Как тебе кофе?
Как тебе кофе?
Многие люди наслаждаются чашкой кофе в какой-то момент в течение дня. Некоторые могут пить его черным, в то время как другие могут добавлять в кофе сливки (или какой-либо заменитель молока) и сахар.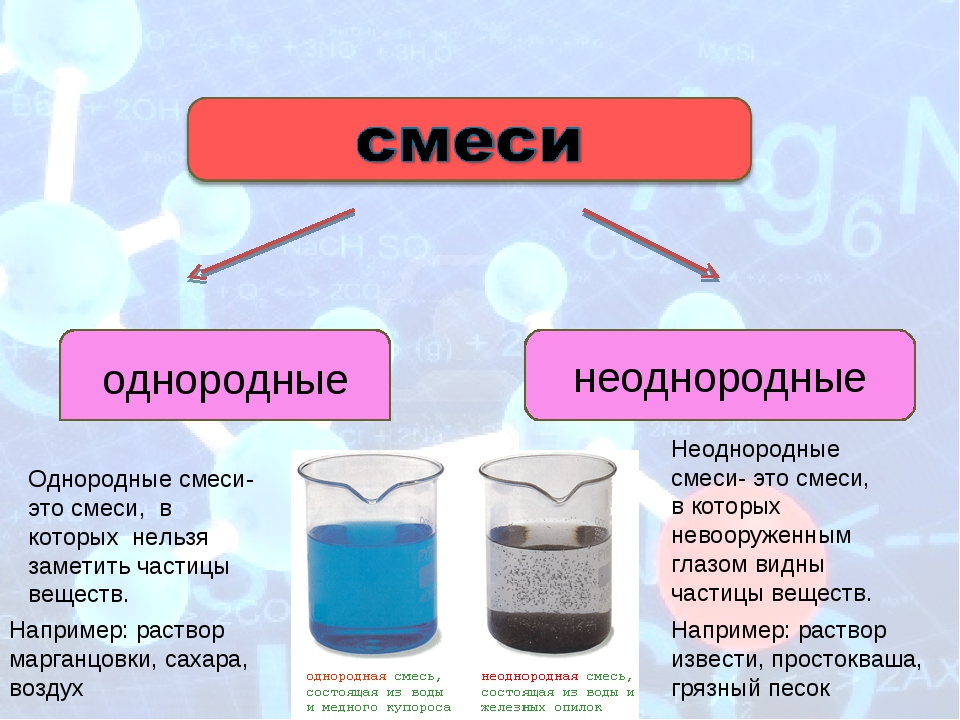 Вы можете купить элитные кофейные напитки в киосках эспрессо (сидя или проезжая). Какими бы ни были ваши предпочтения, вы хотите, чтобы кофе был одинаковым в начале и в конце напитка.Вы не хотите, чтобы компоненты разделялись, но вы хотите, чтобы ваш напиток был однородным сверху вниз.
Вы можете купить элитные кофейные напитки в киосках эспрессо (сидя или проезжая). Какими бы ни были ваши предпочтения, вы хотите, чтобы кофе был одинаковым в начале и в конце напитка.Вы не хотите, чтобы компоненты разделялись, но вы хотите, чтобы ваш напиток был однородным сверху вниз.
Смеси
Обычная поваренная соль называется хлоридом натрия. Считается веществом , потому что оно имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода — тоже чистое вещество. Соль легко растворяется в воде, но соленую воду нельзя классифицировать как вещество, поскольку ее состав может варьироваться.Вы можете растворить небольшое или большое количество соли в определенном количестве воды. Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою индивидуальность и свойства в смеси . Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Гомогенные смеси
Гомогенная смесь представляет собой смесь, состав которой однороден по всей смеси.Вышеописанная соленая вода является однородной, поскольку растворенная соль равномерно распределяется по всей пробе соленой воды. Часто легко спутать однородную смесь с чистым веществом, потому что они оба однородны. Разница в том, что состав вещества всегда одинаковый. Количество соли в соленой воде может варьироваться от образца к образцу. Все растворы будут считаться однородными, поскольку растворенный материал присутствует в одинаковом количестве во всем растворе.
Одной из характеристик смесей является то, что они могут быть разделены на компоненты. Поскольку каждая часть смеси не прореагировала с другой частью смеси, идентичность различных материалов не изменилась.
Сводка
- Гомогенная смесь — это смесь, состав которой однороден по всей смеси.
- Все решения будут считаться однородными.

Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: // www.buzzle.com/articles/homogen-mixture-examples.html
- Какой состав пороха?
- Почему уксус считается однородной смесью?
- Назовите три сплава и перечислите, из чего они состоят.
Обзор
Вопросы
- Что такое смесь?
- Что такое однородная смесь?
- Все ли растворы являются однородными смесями?
- Можно ли разделить гомогенные смеси на компоненты?
Глоссарий
- гомогенная: Смесь, состав которой однороден по всей смеси.
- смесь: состоит из нескольких веществ, соединенных вместе.
- Вещество: Имеет однородный и определенный состав.
Цели обучения
- Определите неоднородную смесь.
- Определить фазу.
- Приведите примеры гетерогенных смесей.
Как лучше всего съесть пакет с мармеладом?
Как лучше всего съесть пакет с мармеладом?
Многие люди открывают пакеты и съедают все конфеты, независимо от вкуса каждого кусочка.Остальные перебирают коллекцию. Они могут сказать: «Мне не нравятся оранжевые». Или, может быть, они просто заботятся о лимонных. В смеси есть разные виды мармеладов, и люди будут есть то, что хотят, а от остальных избавятся.
Гетерогенные смеси
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп — это неоднородная смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Фаза — это любая часть образца, имеющая однородный состав и свойства.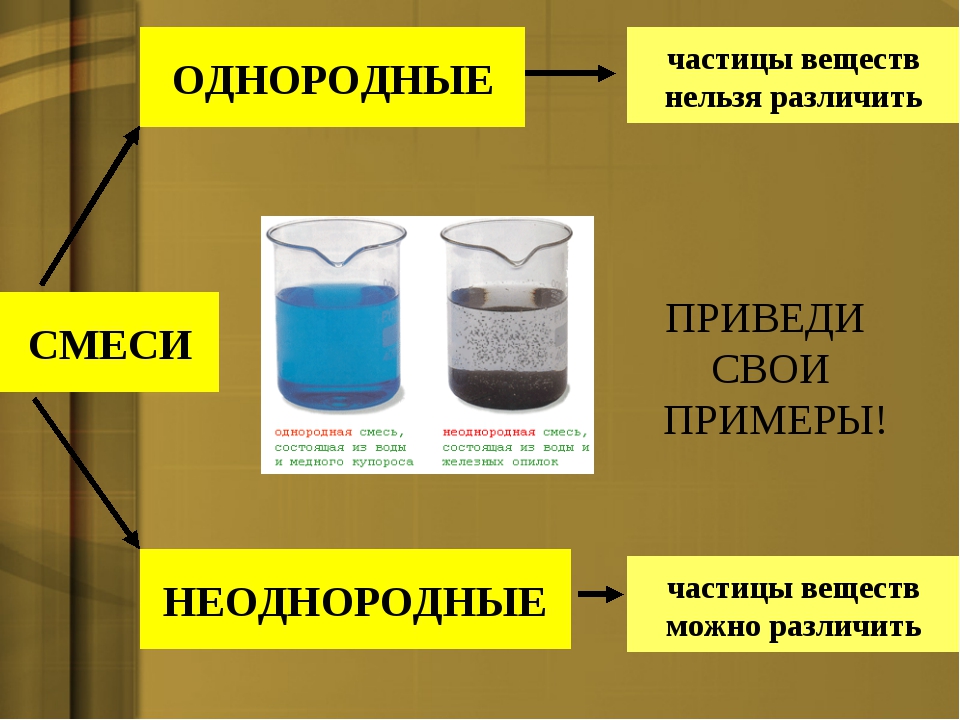 По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя. Каждый из слоев называется фазой.
По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя. Каждый из слоев называется фазой.
Рисунок 2.9
Нефть и вода не смешиваются, а образуют два отдельных слоя, называемых фазами.Масляная фаза менее плотная, чем водная, поэтому масло плавает поверх воды.
В примере с овощным супом одной фазой будет сам жидкий суп. В этой фазе растворены в воде витамины, минералы и другие компоненты. Эта фаза будет однородной. Морковь, горох, кукуруза или другие овощи представляют собой другие фазы супа. Различные овощи не смешиваются в супе равномерно, а раскладываются случайным образом.
Нас окружает большое количество разнородных смесей.Почва состоит из множества веществ и часто бывает разного состава в зависимости от взятой пробы. Одна лопата может поднимать землю и траву, а следующая лопата может содержать дождевого червя.
Смог — еще один пример неоднородной смеси. Этот мутный набор загрязняющих веществ может быть смесью воды и загрязняющих веществ от горящего бензина или пластмасс, смешанных с производными оксида азота и озоном. Вы можете видеть, что распределение смога в воздухе, показанное ниже, не равномерно, а варьируется от одной части атмосферы к другой.
Рисунок 2.10
Смог в Нью-Йорке.
Сводка
- Гетерогенная смесь — это смесь, состав которой неоднороден по всей смеси.
- Фаза — это отдельный слой в гетерогенной смеси.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: //antoine.frostburg.edu / chem / senese / 101 / material / faq / what-is-heterogen.shtml
- Почему смесь песка и сахара неоднородна?
- Какие фазы есть в стакане холодного чая?
- Как кровь неоднородная смесь?
Обзор
Вопросы
- Определите неоднородную смесь.

- Почему овощной суп — это неоднородная смесь?
- Сколько фаз в гетерогенной смеси?
Глоссарий
- гетерогенная смесь: Смесь, состав которой неоднороден по всей смеси.
- фаза: Отдельный слой в гетерогенной смеси.
Чистые вещества и смеси — Элементы, соединения и смеси — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Значение чистого
Слово «чистый» используется в химии иначе, чем его повседневное значение. Например, в магазинах продаются картонные коробки с надписью «чистый» апельсиновый сок. Этикетка означает, что содержимое представляет собой апельсиновый сок без добавления каких-либо других веществ.Однако сок не является чистым в химическом смысле, потому что он содержит разные вещества, смешанные вместе. В химии:
- чистое вещество состоит только из одного элемента или одного соединения
- смесь состоит из двух или более разных веществ, химически не связанных между собой
Смеси и соединения
Водород и кислород являются газами. Вместе, как смесь, водород и кислород могут вступать в реакцию и образовывать воду.Вода — это соединение водорода и кислорода. Есть важные различия между свойствами смеси и соединения.
В этой таблице столбец «Смесь» относится к газам водорода и кислорода, а столбец «Соединение» относится к воде.
| Смесь | Соединение | |
|---|---|---|
| Состав | Переменный состав — можно изменять относительные количества двух газов. | Постоянный состав — вода всегда содержит одинаковое соотношение водорода и кислорода.Это соотношение отражено в химической формуле соединения — H 2 O. |
| Присоединиться или нет? | Водород и кислород не соединяются. | Водород и кислород соединились, чтобы сформировать новое вещество — воду. |
| Свойства | Сохраняет свойства используемых веществ. Эта смесь находится в газовом состоянии. Эта смесь находится в газовом состоянии. | Свойства отличаются от свойств содержащихся в нем элементов. Это соединение представляет собой жидкость. |
| Разделение | Вещества в смеси можно разделить. | Нельзя разделить, но можно получить с помощью химических реакций. |
Различие между чистыми веществами и смесями
Чистые вещества имеют высокую температуру плавления , но смеси плавятся в широком диапазоне температур. Эту разницу легче всего увидеть, если измерить температуру горячей жидкости, когда она охлаждается и замерзает. На графике показана кривая охлаждения для образца соединения, называемого салолом.
Температура остается той же, пока чистое вещество меняет состояние.Горизонтальная часть графика показывает, что салол имеет резкую температуру плавления, поэтому он чистый. Загрязненный салол (смесь салола и других веществ) при замерзании вызывает постепенное понижение в диапазоне температур.
Примеры смесей
Смеси повсюду. Определение смеси — это комбинация разных вещей, которые не связаны химически. Например, когда мы печем торт, это результат смеси яиц, муки, сахара и других ингредиентов.Смеси также могут быть намного проще.
Каждый раз, когда два или более элемента объединяются, образуется смесь. Иногда разные части смеси можно разделить на отдельные объекты. В других случаях они женаты до тех пор, пока существуют. Примером смеси является добавление листового чая в горячую воду, в результате чего получается простая смесь, которую мы называем чаем. Давайте рассмотрим другие примеры смесей.
Примером смеси является добавление листового чая в горячую воду, в результате чего получается простая смесь, которую мы называем чаем. Давайте рассмотрим другие примеры смесей.
Обычные пищевые смеси
Большая часть еды, которую мы едим, представляет собой комбинацию разных продуктов.Редко мы едим только один ингредиент. Например, мы можем съесть обычную курицу, но почему бы не смешать ее с небольшим количеством приправ? Вот еще несколько примеров смесей, связанных с одним из любимых занятий американцев: едой.
- Масло и вода
- Лимонный сок и чай
- Мед и чай
- Молоко и шоколад
- Кофе и сливки
- Сливки и сахар
- Мука и масло
- Зерновые и молоко
- Овсяные хлопья и изюм
- Мука и молоко
- Апельсиновый сок и шампанское
- Сахар и вода
- Сахар и чай
- Тонизирующая вода и сок лайма
- Сода и ванильный сироп
Пищевые смеси часто представляют собой неоднородные смеси.Гетерогенная смесь такова, что компоненты могут быть отделены друг от друга. Миска Cheerios, например, неоднородна, потому что вы можете буквально вытащить отдельные кусочки хлопьев из молока.
Другие распространенные смеси
Помимо того, что мы едим, наша среда полна других смесей. Каждый раз, зажигая ароматическую свечу, вы наполняете воздух ароматами, создавая новую смесь в окружающей среде. Вот еще несколько примеров:
- Дым и туман (Смог)
- Грязь и вода (Грязь)
- Песок, вода и гравий (Цемент)
- Вода и соль (Морская вода)
- Нитрат калия, сера, и углерод (порох)
- Кислород и вода (морская пена)
- Нефть, углеводороды и топливные добавки (бензин)
- Минералы, органические материалы, воздух, вода и живые организмы (почва)
- Хлор, каустическая сода, и вода (отбеливатель)
- Плазма, лейкоциты, эритроциты и тромбоциты (кровь)
Гомогенные смеси противоположны гетерогенным смесям. Это смеси, однородные по своему составу. Примером однородной смеси может быть что-то вроде лимонада. После смешивания вам будет нелегко отделить лимонный сок от воды; это равномерно перемешано. Другой пример — воздух, которым мы дышим. Это однородная смесь кислорода, азота, аргона, углекислого газа и других газов.
Это смеси, однородные по своему составу. Примером однородной смеси может быть что-то вроде лимонада. После смешивания вам будет нелегко отделить лимонный сок от воды; это равномерно перемешано. Другой пример — воздух, которым мы дышим. Это однородная смесь кислорода, азота, аргона, углекислого газа и других газов.
Смеси сплавов
Некоторые из наиболее важных смесей — это прочные металлы, называемые сплавами. Эти металлы являются результатом объединения двух или более металлов вместе, как правило, для их усиления.
Вот список сплавов:
- Алюминий, никель и кобальт (Alnico)
- Никель, марганец, алюминий и кремний (Alumel)
- Медь и мышьяк (мышьяковая медь)
- Медь и серебро (Биллон)
- Цинк и медь (латунь)
- Серебро и медь (британское серебро)
- Никель и хром (хромель)
- Медь и никель (константан)
- Медь и вольфрам (медь-вольфрам)
- Медь, золото и серебро (коринфская бронза)
- Медь, никель и железо (Cunife)
- Медь и никель (мельхиор)
- Медь, алюминий и цинк (сплав Деварда)
- Медь и алюминий (дюралюминий)
- Медь, золото, и серебро (Electrum)
- Никель и железо (Elinvar)
- Железо, никель и кобальт (Fernico)
- Никель, медь и цинк (немецкое серебро)
- Серебро, медь и золото (Goloid)
- Медь, и небольшой профи часть золота и серебра (Hepatizon)
- Медь, марганец и олово (сплав Хейслера)
- Никель, хром и железо (Инконель)
- Никель и железо (Инвар)
- Калий и литий (KLi)
- Никель , кобальт и железо (Ковар)
- Медь, марганец и никель (Манганин)
- Свинец и медь (Молибдочалкос)
- Медь, никель, железо, марганец, углерод и кремний (металлический монель)
- Никель и железо ( Мю-металл)
- Хром, железо и никель (нихром)
- Никель, хром, кремний и магний (Nicrosil)
- Никель и кремний (Nisil)
- Медь, алюминий, цинк и олово (северное золото)
- Олово, медь, сурьма, висмут и (иногда) серебро (Pewter)
- Серебро и платина (платина стерлингового серебра)
- Золото, серебро и медь (розовое золото)
- Медь и золото (Shakudo)
- Серебро и медь (Shibuichi)
- Алюминий и кремний (Silum дюйм)
- Свинец и олово (припой)
- Железо, марганец, углерод и кремний (Spiegeleisen)
- Хром, никель, молибден, кремний, алюминий и углерод (нержавеющая сталь)
- Углерод и железо (сталь)
- Серебро и медь (Стерлинговое серебро)
- Свинец и олово (Терне)
- Медь и золото (Тумбага)
- Свинец, олово и сурьма (Тип металла)
- Цинк, алюминий, магний и медь (Замак)
Наука вокруг нас
Разве не интересно рассмотреть, как наука окружает нас? Это в еде, которую мы едим, и в воздухе, которым мы дышим. И чем больше мы экспериментируем с этим, тем больше мы раскрываем различные истины о нем. Лучший способ узнать что-то новое — это сформировать гипотезы и следовать научным методам для проверки этих гипотез. Чтобы узнать больше об этом, взгляните на эти примеры гипотез, а затем посмотрите, сможете ли вы проверить их с помощью научного метода. Удачного знакомства!
И чем больше мы экспериментируем с этим, тем больше мы раскрываем различные истины о нем. Лучший способ узнать что-то новое — это сформировать гипотезы и следовать научным методам для проверки этих гипотез. Чтобы узнать больше об этом, взгляните на эти примеры гипотез, а затем посмотрите, сможете ли вы проверить их с помощью научного метода. Удачного знакомства!
Вода — элемент или состав?
Вода — это соединение, а не элемент или смесь.Вода важна для жизни, погоды и многих процессов.Являясь элементом нашего существования, вода — это элемент? Ученые классифицируют воду как соединение, а не как элемент. Вот как это работает.
Почему вода не элемент
Элемент — это вещество, состоящее из одного типа атомов. Водород (символ элемента H) и кислород (символ элемента O) являются примерами элементов. Возможно, вы слышали воду под названием «h3O». Название связано с химической формулой воды, H 2 O. Итак, вода состоит из элементов, но сама по себе не является элементом.
До того, как люди узнали об атомах и молекулах, вода считалась элементом. Другие «элементы» включали огонь, землю, воздух, а иногда и металл, дерево или дух. Некоторые традиционные практики все еще считают воду элементом, но это отличается от научного определения.
Вода как молекула и соединение
Когда два атома образуют химическую связь, они образуют молекулу. Водород и кислород являются элементами, но они также обычно существуют в виде молекул, состоящих из двух атомов (H 2 и O 2 ).Поскольку водород образует связи с кислородом, образуя воду, вода представляет собой молекулу.
Вода — это тоже соединение. Иногда люди используют термины «молекула» и «соединение» как синонимы, но химики проводят различие между ними. Молекула образуется всякий раз, когда два или более атомов образуют химические связи, в то время как соединение возникает, когда два или более различных атомов образуют химические связи. Согласно этому узкому определению кислород и водород являются молекулами, а не соединениями. Вода — это и молекула, и соединение.
Согласно этому узкому определению кислород и водород являются молекулами, а не соединениями. Вода — это и молекула, и соединение.
Почему вода не смесь
Другой распространенный вопрос — является ли вода смесью. Считается, что, поскольку вода состоит из комбинации атомов водорода и кислорода, она должна быть смесью. Однако ученые определяют смесь как материал, получаемый при физическом соединении двух веществ. Если вы выпустите газ из баллона с водородом и баллонов с кислородом в космос, вы получите смесь молекул водорода и кислорода. Вы не получите воду, потому что в результате получается просто физическая комбинация водорода и кислорода.Если вы добавите достаточно энергии к смеси водорода и кислорода, то произойдет химическая реакция (химическая комбинация), в результате которой образуется вода. Вода — это чистое вещество, а не смесь.
Ссылки
- IUPAC (1997). Сборник химической терминологии (2-е изд.) («Золотая книга»). Оксфорд: Научные публикации Блэквелла. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook
- Уиттен К.В., Гэйли К. Д. Дэвис Р. Э. (1992). Общая химия (4-е изд.). Филадельфия: Издательство Saunders College. ISBN 978-0-03-072373-5.
Что такое смесь в химии?
Смесь — это то, что вы получаете, когда соединяете два вещества таким образом, чтобы между компонентами не происходила химическая реакция, и вы могли снова разделить их. В смеси каждый компонент сохраняет свою химическую идентичность. Обычно механическое смешивание объединяет компоненты смеси, хотя другие процессы могут производить смесь (например,г., диффузия, осмос).
Технически термин «смесь» используется неправильно, когда рецепт требует смешать, например, муку и яйца. Между этими ингредиентами для приготовления пищи действительно происходит химическая реакция. Вы не можете отменить это. Однако смешивание сухих ингредиентов, таких как мука, соль и сахар, действительно дает смесь.
Даже если компоненты смеси не изменяются, смесь может иметь другие физические свойства, чем любой из ее компонентов. Например, если вы объедините спирт и воду, смесь будет иметь другую температуру плавления и температуру кипения, чем любой из компонентов.
Примеры смесей
- Песок и вода
- Соль и вода
- Сахар и соль
- Этанол в воде
- Воздух
- Сода
- Соль и перец
- Растворы, коллоиды, суспензии
Примеры, не являющиеся смесями
- Пищевая сода и уксус
- Бура и клей для создания слайма
- Объединение соляной кислоты (HCl) и гидроксида натрия (NaOH)
Классификация смесей
Смеси можно разделить на гомогенные и гетерогенные.
Гомогенная смесь имеет однородный состав, который трудно расслаивается. Каждая часть однородной смеси имеет одинаковые свойства. В гомогенной смеси обычно есть растворенное вещество и растворитель, и полученное вещество состоит из одной фазы. Примеры гомогенных смесей включают воздух и физиологический раствор. Гомогенная смесь может содержать любое количество компонентов. В то время как физиологический раствор — это просто соль (растворенное вещество), растворенная в воде (растворителе), воздух содержит много газов.Растворенные вещества в воздухе включают кислород, диоксид углерода и водяной пар. Растворителем в воздухе является азот. Обычно размер частиц растворенного вещества в гомогенной смеси невелик.
Гетерогенная смесь, напротив, не проявляет однородных свойств. Часто можно увидеть частицы в смеси и отделить их друг от друга. Примеры гетерогенных смесей включают влажную губку, песок, гравий, грунтовую смесь и мел, взвешенный в воде.
В некоторой степени, классифицируется ли смесь как однородная или гетерогенная, зависит от масштаба.Например, туман может казаться однородным при просмотре в большом масштабе, но при увеличении концентрация воды не будет однородной от одной области к другой. Точно так же некоторые смеси, которые кажутся гетерогенными в нормальном масштабе, становятся более однородными в больших масштабах. Песок неоднороден, если рассматривать его на ладони, но кажется однородным, если смотреть на весь пляж. Практически любая смесь в молекулярном масштабе неоднородна. Математика применяется, чтобы определить, является ли смесь однородной или неоднородной.Если статистических различий между свойствами не наблюдается, смесь следует рассматривать как однородную.
Точно так же некоторые смеси, которые кажутся гетерогенными в нормальном масштабе, становятся более однородными в больших масштабах. Песок неоднороден, если рассматривать его на ладони, но кажется однородным, если смотреть на весь пляж. Практически любая смесь в молекулярном масштабе неоднородна. Математика применяется, чтобы определить, является ли смесь однородной или неоднородной.Если статистических различий между свойствами не наблюдается, смесь следует рассматривать как однородную.
Риски, связанные с смесями, угрожают качеству воды: Европейский совместный проект SOLUTIONS рекомендует внести изменения в WFD и улучшить координацию всех частей европейского законодательства по химическим веществам для улучшения защиты водной среды от воздействия множества загрязнителей | Науки об окружающей среде Европа
Проект SOLUTIONS предоставил научные концепции, необходимые для поддержки этих рекомендаций.
Мы разработали передовые рамки для оценки экотоксикологических рисков и рисков для здоровья человека от комбинированного воздействия нескольких химических веществ в европейских поверхностных водах. В данной структуре представлено несколько нововведений. В ней реализована систематическая схема уровней, которая устраняет искажения и неопределенности, связанные с широко используемыми методами оценки риска смеси, полученными на основе сложения концентраций. Мы разработали количественные критерии, которые позволяют нам идентифицировать химические вещества, оказывающие сильное воздействие на прогнозируемые риски смешения, так называемые драйверы [13].
Структура была оценена в нескольких тематических исследованиях измеренных концентраций воды для ок. 300 загрязняющих веществ в Дунае. Он оказался высокоэффективным при выделении подгрупп химических веществ, по которым имелись требуемые данные о токсичности и для которых риски смеси могли быть установлены с относительно высокой степенью уверенности.
Кроме того, для бассейнов рек Дунай, Рейн и Испании (SCARCE) на основе смоделированных концентраций воды были проведены многоуровневые оценки экологического риска и риска смешения антропогенных веществ для конкретных таксонов для смоделированных концентраций более 1800 веществ. Оценка смешанного риска по всем речным бассейнам показывает, что несколько участков реки недостаточно защищены от хронических воздействий на сообщества водорослей и дафний. Предполагалось, что многие химические вещества, которые в настоящее время не регулируются Рамочной директивой по водным ресурсам (WFD), будут способствовать возникновению связанных рисков смешения. Почти для всего водосбора Рейна, а также в западной и южной частях бассейна Дуная анализ не выявил опасений по поводу хронического воздействия на рыбу, по крайней мере, в отношении химических веществ, по которым имелись соответствующие данные о хронической токсичности.Однако признаки воздействия на рыбу ожидаются в бассейнах Испании и в центральной части бассейна Дуная. На многих участках рек имелись признаки озабоченности по поводу качества воды, когда она использовалась непосредственно в качестве источника питьевой воды. Смоделированные воздействия смеси, которые являются результатом стандартизированного сценария потребления человеком рыбы, выловленной в реках, превышают уровни, которые считаются безопасными.
Оценка смешанного риска по всем речным бассейнам показывает, что несколько участков реки недостаточно защищены от хронических воздействий на сообщества водорослей и дафний. Предполагалось, что многие химические вещества, которые в настоящее время не регулируются Рамочной директивой по водным ресурсам (WFD), будут способствовать возникновению связанных рисков смешения. Почти для всего водосбора Рейна, а также в западной и южной частях бассейна Дуная анализ не выявил опасений по поводу хронического воздействия на рыбу, по крайней мере, в отношении химических веществ, по которым имелись соответствующие данные о хронической токсичности.Однако признаки воздействия на рыбу ожидаются в бассейнах Испании и в центральной части бассейна Дуная. На многих участках рек имелись признаки озабоченности по поводу качества воды, когда она использовалась непосредственно в качестве источника питьевой воды. Смоделированные воздействия смеси, которые являются результатом стандартизированного сценария потребления человеком рыбы, выловленной в реках, превышают уровни, которые считаются безопасными.
Более того, различные тематические исследования на конкретных участках по пробам воды из рек Дунай и Рейн продемонстрировали актуальность рассмотрения смеси для объяснения наблюдаемых биологических эффектов за счет совместного использования химических и биоаналитических методов [14,15,16].
Наши результаты показывают, что цели защиты ВРД в настоящее время не могут быть реализованы для комбинированного воздействия химических веществ, которое, согласно прогнозам, может произойти в европейских водоемах.
Мы также провели тщательное изучение всех доступных концепций и методов нормативной оценки рисков, связанных с химическими смесями, и интеграции подходов к оценке рисков таких смесей в процедуры приоритизации [17]. Ни один из доступных подходов не дает комплексного решения этой сложной проблемы.Каждый подход имеет определенные преимущества, но также имеет серьезные ограничения.


 В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли. Героине сказки помогли птицы. Опишите, как можно разделить крупы, мак и землю научными методами?
В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли. Героине сказки помогли птицы. Опишите, как можно разделить крупы, мак и землю научными методами?
 Всемирная организация здравоохранения, 2007 г.
Всемирная организация здравоохранения, 2007 г.











 Утопиться чьим-то кораблям — значит быть грустным, рассерженным, с неохотой.
Утопиться чьим-то кораблям — значит быть грустным, рассерженным, с неохотой.
 v3
v3


 Hr.), nume personale și toponime în textele grecești și latine, precum și 80-90 de glossuri de Hessichia și Fotius, dintre care doar 30 sunt autentic tracice.
Hr.), nume personale și toponime în textele grecești și latine, precum și 80-90 de glossuri de Hessichia și Fotius, dintre care doar 30 sunt autentic tracice. Состояние хорошее.
Состояние хорошее. В этом другом видео решение было отменено администрацией спортивного клуба, который первоначально решил отозвать свои команды из определенного соревнования, а затем вернулся к своему решению и удержал их. Спортивный клуб перевернул его, как в Плоешти , Надлежащее значение выражения должно быть помещено в исторический контекст. В начале XIX века в начале железной дороги в Румынии через промышленный город Плоешти проходил маршрут, соединяющий Бухарест и Карпаты с юга на север (со станцией в горном курорте Предял).
В этом другом видео решение было отменено администрацией спортивного клуба, который первоначально решил отозвать свои команды из определенного соревнования, а затем вернулся к своему решению и удержал их. Спортивный клуб перевернул его, как в Плоешти , Надлежащее значение выражения должно быть помещено в исторический контекст. В начале XIX века в начале железной дороги в Румынии через промышленный город Плоешти проходил маршрут, соединяющий Бухарест и Карпаты с юга на север (со станцией в горном курорте Предял).

 А. Коток. — Москва: АСТ: АСТ МОСКВА: Восток — Запад, 2008. — 221, [3] с.
А. Коток. — Москва: АСТ: АСТ МОСКВА: Восток — Запад, 2008. — 221, [3] с. К. Брюзгина. — Москва: ООО «Медиа-Пресс», 2007. — 384 с.
К. Брюзгина. — Москва: ООО «Медиа-Пресс», 2007. — 384 с.

 169.
169. — Попытка делать две или более вещей одновременно, когда даже одно само по себе требует полного усилия, означает, что ни одно из них не будет выполнено должным образом».
— Попытка делать две или более вещей одновременно, когда даже одно само по себе требует полного усилия, означает, что ни одно из них не будет выполнено должным образом». Б. (2005). Аналогичные пословицы на десяти языках (переиздание). Kessinger Publishing. п. 71. ISBN 1417964677.
Б. (2005). Аналогичные пословицы на десяти языках (переиздание). Kessinger Publishing. п. 71. ISBN 1417964677.  272. ISBN 1-875943-44-7.
272. ISBN 1-875943-44-7. 
 Аналогичные пословицы на десяти языках (переиздание). Kessinger Publishing.п. 6. ISBN 1417964677.
Аналогичные пословицы на десяти языках (переиздание). Kessinger Publishing.п. 6. ISBN 1417964677. 

 Dicţionarul limbii romîne moderne . Editura Academiei Republicii Populare Romîne. п. 961.
Dicţionarul limbii romîne moderne . Editura Academiei Republicii Populare Romîne. п. 961. 
 п. 95.
п. 95. 



 — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  — Румынская пословица
— Румынская пословица  и жена. — Румынская пословица
и жена. — Румынская пословица  — Румынская пословица
— Румынская пословица 
 (Хорошая лошадь продается даже в конюшне)
(Хорошая лошадь продается даже в конюшне)  B. (1885). Аналогичные пословицы на десяти языках .п. 10.
B. (1885). Аналогичные пословицы на десяти языках .п. 10.  Факты в Файловом словаре Притчей . Издание информационной базы. п. 120. ISBN 978-0-8160-6673-5.
Факты в Файловом словаре Притчей . Издание информационной базы. п. 120. ISBN 978-0-8160-6673-5. 
 , а вес буквой
, а вес буквой  .
.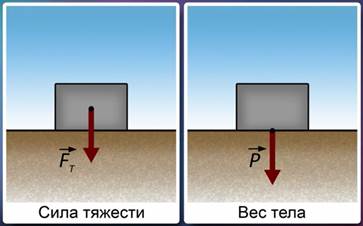




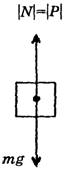
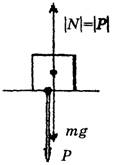
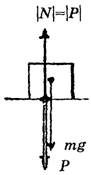


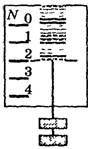
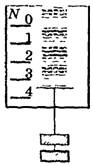
 , где Р’ – искусственный вес тела в данных условиях.
, где Р’ – искусственный вес тела в данных условиях.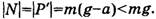
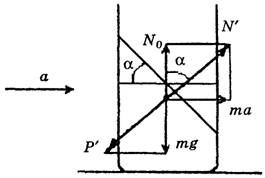
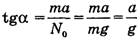
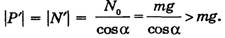
 8m-5.4)-3/7(2.1m-4.2)=
и пожалуйста объясните как вы его решили
8m-5.4)-3/7(2.1m-4.2)=
и пожалуйста объясните как вы его решили Он отметил, что президент во время «Прямой линии» назвал оппозиционера «пациентом в берлинской клинике». «Я впал в кому, очнулся, потом вышел из больницы <…> У вас был адрес», — настаивал Навальный.
Он отметил, что президент во время «Прямой линии» назвал оппозиционера «пациентом в берлинской клинике». «Я впал в кому, очнулся, потом вышел из больницы <…> У вас был адрес», — настаивал Навальный.
 Как сообщили ТАСС в УФСИН, в течение 2020 года Навальный минимум шесть раз, до заболевания, не явился на регистрацию — 13 января, 27 января, 3 февраля, 16 марта, 6 июля, 17 августа. По каждому нарушению ему выносились официальные предупреждения.
Как сообщили ТАСС в УФСИН, в течение 2020 года Навальный минимум шесть раз, до заболевания, не явился на регистрацию — 13 января, 27 января, 3 февраля, 16 марта, 6 июля, 17 августа. По каждому нарушению ему выносились официальные предупреждения. Суд оставил навального в СИЗО.
Суд оставил навального в СИЗО. Ему вменили и незаконное хранение оружия — из-за лежавшего дома фрагмента ствола от старого охотничьего ружья.
Ему вменили и незаконное хранение оружия — из-за лежавшего дома фрагмента ствола от старого охотничьего ружья.
 — Скажу так: иллюзий никто не строил. Дважды отмененный приговор. Что касается 13 лет — не то чтобы там было какое-то ожидание, но никого этот результат не удивил. Я имею в виду меня, самого Юрия Дмитриева или Виктора Ануфриева. Но это не значит, конечно, что с приговором мы согласны. Не согласны категорически, и приговор будет обжалован в кассационном порядке, безусловно».
— Скажу так: иллюзий никто не строил. Дважды отмененный приговор. Что касается 13 лет — не то чтобы там было какое-то ожидание, но никого этот результат не удивил. Я имею в виду меня, самого Юрия Дмитриева или Виктора Ануфриева. Но это не значит, конечно, что с приговором мы согласны. Не согласны категорически, и приговор будет обжалован в кассационном порядке, безусловно». )
) 2
2 )
) )
) )
)
 Акции Pfizer (еще один производитель противоковидной вакцины) торгуются на премаркете на 1% выше уровня закрытия предыдущего дня.
Акции Pfizer (еще один производитель противоковидной вакцины) торгуются на премаркете на 1% выше уровня закрытия предыдущего дня. Из 34 млн человек, получивших вакцину в Великобритании, ЕС и трех других странах, у 222 был обнаружен тромбоз. Позже Европейское агентство по лекарственным средствам (EMA) заявило, что польза от вакцины AstraZeneca перевешивает риски.
Из 34 млн человек, получивших вакцину в Великобритании, ЕС и трех других странах, у 222 был обнаружен тромбоз. Позже Европейское агентство по лекарственным средствам (EMA) заявило, что польза от вакцины AstraZeneca перевешивает риски.


 A.
A. 




 В этом примере 280 — это , часть , которая ответила Да. Это соответствует 7.
В этом примере 280 — это , часть , которая ответила Да. Это соответствует 7. Каждый мл раствора для инъекций содержит 0,1 мг моногидрата сульфата атропина, что эквивалентно 0,085 мг атропина. Каждый шприц на 5 мл содержит 0.5 мг моногидрата сульфата атропина, что эквивалентно 0,415 мг атропина.
Наполнитель с известным эффектом: натрий Каждый мл раствора для инъекций содержит 3,5 мг, эквивалентные 0,154 ммоль натрия. Каждый шприц на 5 мл содержит 17,7 мг, эквивалентные 0,770 ммоль натрия.
Полный список вспомогательных веществ см. В разделе 6.1. Раствор для инъекций в предварительно заполненном шприце. Прозрачный бесцветный раствор. PH 3,2 — 4,0. Сульфат атропина 0,5 мг / 5 мл, раствор для инъекций в предварительно заполненном шприце показан взрослым и детям с рождения, но с массой тела более 3 кг (см.2). — в качестве преанестезирующего препарата для предотвращения вагусных реакций, связанных с интубацией трахеи и хирургическими манипуляциями; — для ограничения мускариновых эффектов неостигмина при послеоперационном введении для противодействия недеполяризующим миорелаксантам; — для лечения гемодинамически нарушающей брадикардии и / или атриовентрикулярная блокада из-за чрезмерного тонуса блуждающего нерва в экстренных случаях — Сердечно-легочная реанимация: для лечения симптоматической брадикардии и AV-блокады В качестве антидота при передозировке или отравлении ингибиторами ацетилхолинэстеразы e.грамм. антихолинэстеразы, фосфорорганические, карбаматы и мускариновые грибы Атропина сульфат 0,5 мг / 5 мл, раствор для инъекций в предварительно заполненном шприце, следует вводить под наблюдением врача.
Каждый мл раствора для инъекций содержит 0,1 мг моногидрата сульфата атропина, что эквивалентно 0,085 мг атропина. Каждый шприц на 5 мл содержит 0.5 мг моногидрата сульфата атропина, что эквивалентно 0,415 мг атропина.
Наполнитель с известным эффектом: натрий Каждый мл раствора для инъекций содержит 3,5 мг, эквивалентные 0,154 ммоль натрия. Каждый шприц на 5 мл содержит 17,7 мг, эквивалентные 0,770 ммоль натрия.
Полный список вспомогательных веществ см. В разделе 6.1. Раствор для инъекций в предварительно заполненном шприце. Прозрачный бесцветный раствор. PH 3,2 — 4,0. Сульфат атропина 0,5 мг / 5 мл, раствор для инъекций в предварительно заполненном шприце показан взрослым и детям с рождения, но с массой тела более 3 кг (см.2). — в качестве преанестезирующего препарата для предотвращения вагусных реакций, связанных с интубацией трахеи и хирургическими манипуляциями; — для ограничения мускариновых эффектов неостигмина при послеоперационном введении для противодействия недеполяризующим миорелаксантам; — для лечения гемодинамически нарушающей брадикардии и / или атриовентрикулярная блокада из-за чрезмерного тонуса блуждающего нерва в экстренных случаях — Сердечно-легочная реанимация: для лечения симптоматической брадикардии и AV-блокады В качестве антидота при передозировке или отравлении ингибиторами ацетилхолинэстеразы e.грамм. антихолинэстеразы, фосфорорганические, карбаматы и мускариновые грибы Атропина сульфат 0,5 мг / 5 мл, раствор для инъекций в предварительно заполненном шприце, следует вводить под наблюдением врача. В сочетании с неостигмином для ограничения его мускаринового эффекта :
В сочетании с неостигмином для ограничения его мускаринового эффекта : 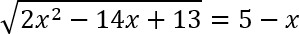





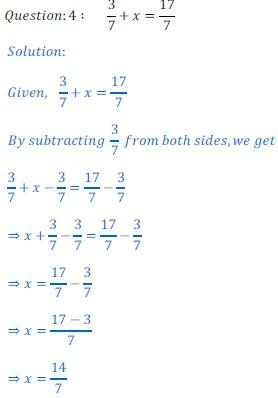

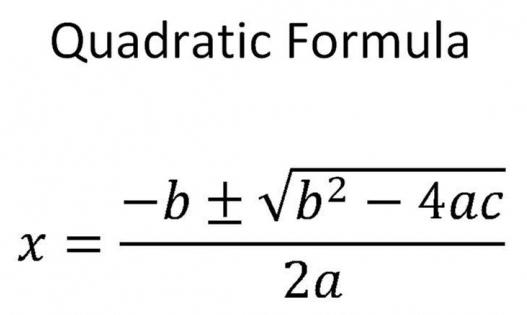
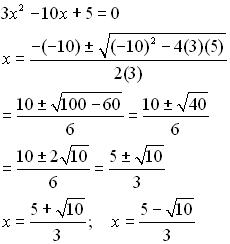





 Не ставится запятая перед что, как, чем, куда и т. п., когда эти слова входят в состав неразложимых выражений, как-то: во что бы то ни стало, чем попало, как ни в чем не бывало, черт знает что и т. п., например: Надо этого добиваться во что бы то ни стало. Упал и встал как ни в чем не бывало. Били чем попало. Действует как следует. Говорили кто во что горазд. Кричал что есть мочи.
Не ставится запятая перед что, как, чем, куда и т. п., когда эти слова входят в состав неразложимых выражений, как-то: во что бы то ни стало, чем попало, как ни в чем не бывало, черт знает что и т. п., например: Надо этого добиваться во что бы то ни стало. Упал и встал как ни в чем не бывало. Били чем попало. Действует как следует. Говорили кто во что горазд. Кричал что есть мочи.

 Также данный раздел нередко используется учащимися вузов и ссузов.
Также данный раздел нередко используется учащимися вузов и ссузов. Изначально эта программа вводилась как эксперимент и уже в первые месяцы тестирования зарекомендовала себя как объективную систему тестирования выпускников. Так что же все-таки представляет из себя этот ЕГЭ?
Изначально эта программа вводилась как эксперимент и уже в первые месяцы тестирования зарекомендовала себя как объективную систему тестирования выпускников. Так что же все-таки представляет из себя этот ЕГЭ? Я знаю, что во многих школах учителя предлагают организовывать собственные школьные подготовительные курсы за небольшую плату, а то и вовсе бесплатно.
Я знаю, что во многих школах учителя предлагают организовывать собственные школьные подготовительные курсы за небольшую плату, а то и вовсе бесплатно. ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke&text=\u0422\u0440\u0435\u0434: \u041f\u0440\u0430\u0432\u0438\u043b\u0430 \u043f\u0443\u043d\u043a\u0442\u0443\u0430\u0446\u0438\u0438 \u0432 \u0430\u043d\u0433\u043b\u0438\u0439\u0441\u043a\u043e\u043c \u044f\u0437\u044b\u043a\u0435″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/tjournal.ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u0422\u0440\u0435\u0434: \u041f\u0440\u0430\u0432\u0438\u043b\u0430 \u043f\u0443\u043d\u043a\u0442\u0443\u0430\u0446\u0438\u0438 \u0432 \u0430\u043d\u0433\u043b\u0438\u0439\u0441\u043a\u043e\u043c \u044f\u0437\u044b\u043a\u0435&body=https:\/\/tjournal.ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke&text=\u0422\u0440\u0435\u0434: \u041f\u0440\u0430\u0432\u0438\u043b\u0430 \u043f\u0443\u043d\u043a\u0442\u0443\u0430\u0446\u0438\u0438 \u0432 \u0430\u043d\u0433\u043b\u0438\u0439\u0441\u043a\u043e\u043c \u044f\u0437\u044b\u043a\u0435″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/tjournal.ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u0422\u0440\u0435\u0434: \u041f\u0440\u0430\u0432\u0438\u043b\u0430 \u043f\u0443\u043d\u043a\u0442\u0443\u0430\u0446\u0438\u0438 \u0432 \u0430\u043d\u0433\u043b\u0438\u0439\u0441\u043a\u043e\u043c \u044f\u0437\u044b\u043a\u0435&body=https:\/\/tjournal.ru\/internet\/86519-tred-pravila-punktuacii-v-angliyskom-yazyke»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false} — Он не боится ни ветра, ни мороза, ни снега.
— Он не боится ни ветра, ни мороза, ни снега. — В зале ждали гости.
— В зале ждали гости.




 )
) Поэтому в этом предложении должны быть запятые.)
Поэтому в этом предложении должны быть запятые.) Е. Не требуется определять слово, которое она изменяет), то она должна быть отделена от остальной части предложения запятыми.
Е. Не требуется определять слово, которое она изменяет), то она должна быть отделена от остальной части предложения запятыми. Его также называют «определяющим положением», что, на мой взгляд, является более точным термином. Вокруг ограничительного предложения никогда не бывает запятых.При введении ограничительной оговорки слова «who» и «which» можно заменить на «that». (Примечание: предложения, начинающиеся с «это», никогда не ставятся запятыми.)
Его также называют «определяющим положением», что, на мой взгляд, является более точным термином. Вокруг ограничительного предложения никогда не бывает запятых.При введении ограничительной оговорки слова «who» и «which» можно заменить на «that». (Примечание: предложения, начинающиеся с «это», никогда не ставятся запятыми.)


 Когда вы убираете фразу «что мне нравится больше всего», меняете ли вы смысл предложения?
Когда вы убираете фразу «что мне нравится больше всего», меняете ли вы смысл предложения?














 Но им недоставало надежных и подробных
сведений об элементах. К середине XIX в. знаний о химических элементах стало
достаточно, а число элементов возросло настолько, что в науке возникла
естественная потребность в их классификации. Первые попытки классификации
элементов на металлы и неметаллы оказались несостоятельными. Предшественники
Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали
для подготовки открытия периодического закона, но не смогли постичь истину.
Дмитрий Иванович установил связь между массой элементов и их свойствами.
Но им недоставало надежных и подробных
сведений об элементах. К середине XIX в. знаний о химических элементах стало
достаточно, а число элементов возросло настолько, что в науке возникла
естественная потребность в их классификации. Первые попытки классификации
элементов на металлы и неметаллы оказались несостоятельными. Предшественники
Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали
для подготовки открытия периодического закона, но не смогли постичь истину.
Дмитрий Иванович установил связь между массой элементов и их свойствами. Противников – много, особенно в Германии и Англии.
Противников – много, особенно в Германии и Англии.

 В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый. Одни уверены в том, что до Менделеева это совершали и другие химики. Вторые утверждают, что русский ученый создал свою систему на основе предыдущих изысканий зарубежных исследователей.
В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый. Одни уверены в том, что до Менделеева это совершали и другие химики. Вторые утверждают, что русский ученый создал свою систему на основе предыдущих изысканий зарубежных исследователей. Тем самым им впервые была высказана идея о периодичности изменения свойств элементов.
Тем самым им впервые была высказана идея о периодичности изменения свойств элементов. Шанкуртуа нанес на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам элементов. Таким образом, элементы, атомные веса которых отличались на 16 или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной вертикальной линии.
Шанкуртуа нанес на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам элементов. Таким образом, элементы, атомные веса которых отличались на 16 или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной вертикальной линии. Однако ученые умы России, да и всего мира, отнеслись к его открытию с некоторым скепсисом. И кто знает, как все бы обернулось, если бы уже через несколько лет Менделеевские открытия не получили подтверждения.
Однако ученые умы России, да и всего мира, отнеслись к его открытию с некоторым скепсисом. И кто знает, как все бы обернулось, если бы уже через несколько лет Менделеевские открытия не получили подтверждения. Впоследствии Д.И. Менделеев, якобы, рассказывал своему соратнику: «В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного материала. И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне совершенно явственно представилась таблица. Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги».
Впоследствии Д.И. Менделеев, якобы, рассказывал своему соратнику: «В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного материала. И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне совершенно явственно представилась таблица. Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги».
 Что и понятно. Ведь когда-то таблица Менделеева стала одним из величайших открытий в химии. Она внесла удивительный порядок в, казалось бы, хаотическое нагромождение разнообразных элементов. Наш великий соотечественник расположил элементы так, чтобы соседи по столбцу имели схожие химические свойства.
Что и понятно. Ведь когда-то таблица Менделеева стала одним из величайших открытий в химии. Она внесла удивительный порядок в, казалось бы, хаотическое нагромождение разнообразных элементов. Наш великий соотечественник расположил элементы так, чтобы соседи по столбцу имели схожие химические свойства. На основе такого столбца они и создали свою таблицу, расположив в строках элементы слева направо по мере заполнения оболочек.
На основе такого столбца они и создали свою таблицу, расположив в строках элементы слева направо по мере заполнения оболочек. Так что если бы в то время таблицы Менделеева не было, то она могла бы быть предложена просто как следствие фундаментальных квантовых законов.
Так что если бы в то время таблицы Менделеева не было, то она могла бы быть предложена просто как следствие фундаментальных квантовых законов. Об этом премьер-министр заявил на заседании возглавляемого им оргкомитета по проведению Международного года Периодической таблицы химических элементов.
Об этом премьер-министр заявил на заседании возглавляемого им оргкомитета по проведению Международного года Периодической таблицы химических элементов. Окончательная формулировка закона была дана учёным в июле 1871 г.
Окончательная формулировка закона была дана учёным в июле 1871 г. Его разработку и углубление Дмитрий Иванович продолжал еще в течение почти трёх лет. В 1870 г. Менделеев в «Основах химии» опубликовал второй вариант системы («Естественную систему элементов»): горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Его разработку и углубление Дмитрий Иванович продолжал еще в течение почти трёх лет. В 1870 г. Менделеев в «Основах химии» опубликовал второй вариант системы («Естественную систему элементов»): горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона. Многие свойства периодически повторяются. Когда элементы расположены правильно, тенденции в свойствах элементов становятся очевидными и могут использоваться для прогнозирования неизвестных или незнакомых элементов, просто основываясь на их размещении в таблице.
Многие свойства периодически повторяются. Когда элементы расположены правильно, тенденции в свойствах элементов становятся очевидными и могут использоваться для прогнозирования неизвестных или незнакомых элементов, просто основываясь на их размещении в таблице.
 Только в 1911 году Резерфорд провел свой эксперимент с золотой фольгой, который продемонстрировал наличие ядра в атоме. Всего два года спустя, в 1913 году, английский физик Генри Мозли (1887-1915) исследовал рентгеновские спектры ряда химических элементов. Он будет снимать рентгеновские лучи через кристаллы элемента и изучать длины волн обнаруженного им излучения. Мозли обнаружил связь между длиной волны и атомным номером. Его результаты привели к определению атомного номера как количества протонов, содержащихся в ядре каждого атома.Затем он понял, что элементы периодической таблицы должны быть расположены в порядке увеличения атомного номера, а не увеличения атомной массы.
Только в 1911 году Резерфорд провел свой эксперимент с золотой фольгой, который продемонстрировал наличие ядра в атоме. Всего два года спустя, в 1913 году, английский физик Генри Мозли (1887-1915) исследовал рентгеновские спектры ряда химических элементов. Он будет снимать рентгеновские лучи через кристаллы элемента и изучать длины волн обнаруженного им излучения. Мозли обнаружил связь между длиной волны и атомным номером. Его результаты привели к определению атомного номера как количества протонов, содержащихся в ядре каждого атома.Затем он понял, что элементы периодической таблицы должны быть расположены в порядке увеличения атомного номера, а не увеличения атомной массы. famousscientists.org/henry-moseley/
famousscientists.org/henry-moseley/ Элементы в группе имеют очень похожие химические свойства, которые возникают из количества присутствующих валентных электронов, то есть количества электронов в крайних электронах. оболочка атома.
Элементы в группе имеют очень похожие химические свойства, которые возникают из количества присутствующих валентных электронов, то есть количества электронов в крайних электронах. оболочка атома. Столь быстрое расширение химических знаний вскоре потребовало классификации, поскольку на классификации химических знаний основана не только систематизированная химическая литература, но и лабораторные науки, благодаря которым химия передается как живая наука от одного поколения химиков к другому. Связи между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отстала от классификации соединений. Фактически, между химиками не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общепринятыми.
Столь быстрое расширение химических знаний вскоре потребовало классификации, поскольку на классификации химических знаний основана не только систематизированная химическая литература, но и лабораторные науки, благодаря которым химия передается как живая наука от одного поколения химиков к другому. Связи между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отстала от классификации соединений. Фактически, между химиками не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общепринятыми. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся спиральная кривая привела тесно связанные элементы в соответствующие точки над или под друг другом на цилиндре, и, как следствие, он предположил, что «свойства элементов являются свойствами чисел», что является замечательным предсказанием в свете современных знаний.
Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся спиральная кривая привела тесно связанные элементы в соответствующие точки над или под друг другом на цилиндре, и, как следствие, он предположил, что «свойства элементов являются свойствами чисел», что является замечательным предсказанием в свете современных знаний. В том же году немецкий ученый Лотар Мейер независимо предложил те же идеи. Эта договоренность выявила большое обобщение, известное теперь как Периодический закон. Дмитрий Менделеев включил все 65 элементов, известных в его эпоху по их атомному весу и химической валентности. Такие закономерности очень упрощают изучение химии. Тщательное изучение одного элемента в группе элементов значительно упрощает изучение других членов группы, поскольку многие свойства и химические реакции элементов схожи.
В том же году немецкий ученый Лотар Мейер независимо предложил те же идеи. Эта договоренность выявила большое обобщение, известное теперь как Периодический закон. Дмитрий Менделеев включил все 65 элементов, известных в его эпоху по их атомному весу и химической валентности. Такие закономерности очень упрощают изучение химии. Тщательное изучение одного элемента в группе элементов значительно упрощает изучение других членов группы, поскольку многие свойства и химические реакции элементов схожи. Таким образом, Периодический закон оказал большую услугу в указании вероятных ошибок.
Таким образом, Периодический закон оказал большую услугу в указании вероятных ошибок. 9 AMU
9 AMU ЭЛЕКТРОНЫ УДАЛЯЮТСЯ ПЕРВЫМ.
ЭЛЕКТРОНЫ УДАЛЯЮТСЯ ПЕРВЫМ. Периодическая таблица Менделеева.
внимание к тому факту, что «восьмой элемент, начиная с данного элемента, является своего рода повторением первого, как восьмая нота октавы в музыке», и, таким образом, сделал & lowbar; наиболее заметным шагом вперед к системе классификации элементы, которые еще были выполнены.
Однако именно русскому химику Менделееву химия обязана системой классификации элементов, основанной на признании этого фундаментального факта: «свойства элементов, а также свойства и состав соединений периодически меняются в зависимости от атомный вес элементов.”
Этот принцип, известный как Периодический закон, был провозглашен Менделеевым в двух мемуарах, опубликованных в 1869 и 1871 годах, соответственно, и расположение элементов, основанное на этом законе, которое он окончательно принял, проиллюстрировано на рис.1.
Хотя обсуждение этого закона можно найти почти в любом учебнике по химии, несколько замечаний общего характера могут быть в этой связи не лишними.
Менделеев распределяет элементы по сериям и группам. В каждой серии порядок элементов соответствует увеличению атомного веса, и при этом изменении атомного веса очевидно постепенное изменение.
изменение всех свойств как элементов, так и их соединений.С другой стороны, расположение в группах демонстрирует периодическое повторение элементов, обладающих довольно аналогичными свойствами.
Изменение валентности, показанное формулой оксидов и гидридов, вероятно, является одним из самых поразительных фактов, обнаруженных периодическим расположением элементов.
У одновалентных элементов, таких как H, Li, Na и т. Д., Валентность кислорода регулярно увеличивается до тех пор, пока в соединениях, таких как OsO, элементы не будут иметь валентность восьми. Максимальная валентность водорода, по-видимому, равна четырем, и хотя валентность кислорода увеличивается от группы I к группе VIII, валентность водорода уменьшается таким же образом от группы IV к группе VIII.Соединения демонстрируют градацию свойств, очень похожую на свойства самих элементов.
Периодическая таблица Менделеева.
внимание к тому факту, что «восьмой элемент, начиная с данного элемента, является своего рода повторением первого, как восьмая нота октавы в музыке», и, таким образом, сделал & lowbar; наиболее заметным шагом вперед к системе классификации элементы, которые еще были выполнены.
Однако именно русскому химику Менделееву химия обязана системой классификации элементов, основанной на признании этого фундаментального факта: «свойства элементов, а также свойства и состав соединений периодически меняются в зависимости от атомный вес элементов.”
Этот принцип, известный как Периодический закон, был провозглашен Менделеевым в двух мемуарах, опубликованных в 1869 и 1871 годах, соответственно, и расположение элементов, основанное на этом законе, которое он окончательно принял, проиллюстрировано на рис.1.
Хотя обсуждение этого закона можно найти почти в любом учебнике по химии, несколько замечаний общего характера могут быть в этой связи не лишними.
Менделеев распределяет элементы по сериям и группам. В каждой серии порядок элементов соответствует увеличению атомного веса, и при этом изменении атомного веса очевидно постепенное изменение.
изменение всех свойств как элементов, так и их соединений.С другой стороны, расположение в группах демонстрирует периодическое повторение элементов, обладающих довольно аналогичными свойствами.
Изменение валентности, показанное формулой оксидов и гидридов, вероятно, является одним из самых поразительных фактов, обнаруженных периодическим расположением элементов.
У одновалентных элементов, таких как H, Li, Na и т. Д., Валентность кислорода регулярно увеличивается до тех пор, пока в соединениях, таких как OsO, элементы не будут иметь валентность восьми. Максимальная валентность водорода, по-видимому, равна четырем, и хотя валентность кислорода увеличивается от группы I к группе VIII, валентность водорода уменьшается таким же образом от группы IV к группе VIII.Соединения демонстрируют градацию свойств, очень похожую на свойства самих элементов. Таким образом, Na, O является сильно основным, MgO — менее щелочным, Al, O3 соединяется с кислотами с образованием солей, а с гидратами щелочных металлов — с образованием солей.
образуют алюминаты, то есть адсорбируются как ангидрид как кислот, так и оснований. В SiO2 имеется слабый ангидрид кислоты, тогда как кислоты, образованные из P20, SO и Cl, O, имеют силу в том же порядке.
АТОМНЫЙ ОБЪЕМ КАК ПЕРИОДИЧЕСКАЯ ФУНКЦИЯ АТОМНОГО ВЕСА.
Вероятно, лучшую иллюстрацию значения Периодического закона Менделеева можно передать, построив график некоторых свойств различных элементов в зависимости от атомного веса.На рис. 2, взятом из книги Холлемана «Неорганическая химия», атомный объем (удельный вес, деленный на атомный вес) нанесен по оси ординат, а атомные веса — по оси абсцисс. Можно заметить, что элементы, обладающие аналогичными химическими и физическими свойствами, занимают аналогичные позиции на кривой. В математике периодическая функция — это функция, которая возвращает одно и то же значение при определенных приращениях независимой переменной. Из рис. 2 очевидно, что мы можем аналогичным образом утверждать, что атомный объем является периодической функцией атомного веса.Удельная теплоемкость элементов, построенная в виде ординат против атомного веса, показывает аналогичную периодичность максимумов и минимумов, и то же самое можно сказать и о других свойствах.
ПРИМЕНЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА ДЛЯ ОПРЕДЕЛЕНИЯ АТОМНОЙ МАССЫ.
Одним из наиболее важных приложений Периодического закона, предложенного Менделеевым, было определение
Определение атомных весов из свойств элементов. Другими словами, он заявил в качестве фундаментальной аксиомы, что атомный вес элемента должен определять его свойства.Он проиллюстрировал этот вывод, подробно предсказав свойства трех неизвестных элементов, которые он назвал эка-бором, эка-алюминием и эка-кремнием, и которым он присвоил приблизительные атомные веса 44, 68 и 72 соответственно. Его предсказания впоследствии были полностью подтверждены открытием элементов скандий (эка-бор), галлий (эка-алюминий) и германий (эка-кремний).
Таким образом, Na, O является сильно основным, MgO — менее щелочным, Al, O3 соединяется с кислотами с образованием солей, а с гидратами щелочных металлов — с образованием солей.
образуют алюминаты, то есть адсорбируются как ангидрид как кислот, так и оснований. В SiO2 имеется слабый ангидрид кислоты, тогда как кислоты, образованные из P20, SO и Cl, O, имеют силу в том же порядке.
АТОМНЫЙ ОБЪЕМ КАК ПЕРИОДИЧЕСКАЯ ФУНКЦИЯ АТОМНОГО ВЕСА.
Вероятно, лучшую иллюстрацию значения Периодического закона Менделеева можно передать, построив график некоторых свойств различных элементов в зависимости от атомного веса.На рис. 2, взятом из книги Холлемана «Неорганическая химия», атомный объем (удельный вес, деленный на атомный вес) нанесен по оси ординат, а атомные веса — по оси абсцисс. Можно заметить, что элементы, обладающие аналогичными химическими и физическими свойствами, занимают аналогичные позиции на кривой. В математике периодическая функция — это функция, которая возвращает одно и то же значение при определенных приращениях независимой переменной. Из рис. 2 очевидно, что мы можем аналогичным образом утверждать, что атомный объем является периодической функцией атомного веса.Удельная теплоемкость элементов, построенная в виде ординат против атомного веса, показывает аналогичную периодичность максимумов и минимумов, и то же самое можно сказать и о других свойствах.
ПРИМЕНЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА ДЛЯ ОПРЕДЕЛЕНИЯ АТОМНОЙ МАССЫ.
Одним из наиболее важных приложений Периодического закона, предложенного Менделеевым, было определение
Определение атомных весов из свойств элементов. Другими словами, он заявил в качестве фундаментальной аксиомы, что атомный вес элемента должен определять его свойства.Он проиллюстрировал этот вывод, подробно предсказав свойства трех неизвестных элементов, которые он назвал эка-бором, эка-алюминием и эка-кремнием, и которым он присвоил приблизительные атомные веса 44, 68 и 72 соответственно. Его предсказания впоследствии были полностью подтверждены открытием элементов скандий (эка-бор), галлий (эка-алюминий) и германий (эка-кремний). Следует отметить, что без помощи Периодического закона точное определение атомного веса элемента, все соединения которого являются нелетучими, становится делом исключительной трудности.Таким образом, химический анализ оксида индия показывает, что элемент имеет эквивалентный вес 38, то есть 38 весовых частей индия эквивалентны 1 весовой части водорода. В то время, когда Менделеев опубликовал свои статьи, атомный вес этого элемента был принят равным 76, а формула оксида — InO. Изучение свойств этого оксида и самого металла с точки зрения Периода I, aw, привело Менделеева к отнесению его к Группе III, наряду с B и Al.Следовательно, оксид должен иметь формулу InO3, а атомный вес должен быть около 114.
расхождения в таблице Менделеева.
Еще Менделеев заметил, что существует несоответствие в случае теллура и йода. По порядку атомных весов йод должен предшествовать теллуру; но даже самое поверхностное исследование свойств этих элементов и их соединений показывает, что йод принадлежит к семейству хлора, в то время как теллур очень похож на серу и селен.Поэтому Менделеев утверждал, что атомный вес теллура должен быть меньше; но, несмотря на самые тщательные и детальные исследования, предпринятые в этом направлении, результаты всегда приводили к одному и тому же выводу.
Подобные расхождения наблюдались в случае кобальта и никеля, аргона и калия (см. «Редкие земли», стр. 620). В следующем разделе будет показано, что эти расхождения исчезают в свете самых последних предположений.
инертные газы по отношению к периодической таблице.Когда было обнаружено существование инертных газов, возник интересный вопрос об их месте в Периодической таблице. Как хорошо известно, эти газы оказались химически абсолютно инертными, что радикально отличается от всех других элементов, известных к тому времени. Следовательно, они не могли быть помещены ни в одну из известных групп. Однако, если разместить их в группе слева от Группы I (см. Рис.4), они показаны как естественный переход от элементов Группы VIII к элементам Группы I.
Следует отметить, что без помощи Периодического закона точное определение атомного веса элемента, все соединения которого являются нелетучими, становится делом исключительной трудности.Таким образом, химический анализ оксида индия показывает, что элемент имеет эквивалентный вес 38, то есть 38 весовых частей индия эквивалентны 1 весовой части водорода. В то время, когда Менделеев опубликовал свои статьи, атомный вес этого элемента был принят равным 76, а формула оксида — InO. Изучение свойств этого оксида и самого металла с точки зрения Периода I, aw, привело Менделеева к отнесению его к Группе III, наряду с B и Al.Следовательно, оксид должен иметь формулу InO3, а атомный вес должен быть около 114.
расхождения в таблице Менделеева.
Еще Менделеев заметил, что существует несоответствие в случае теллура и йода. По порядку атомных весов йод должен предшествовать теллуру; но даже самое поверхностное исследование свойств этих элементов и их соединений показывает, что йод принадлежит к семейству хлора, в то время как теллур очень похож на серу и селен.Поэтому Менделеев утверждал, что атомный вес теллура должен быть меньше; но, несмотря на самые тщательные и детальные исследования, предпринятые в этом направлении, результаты всегда приводили к одному и тому же выводу.
Подобные расхождения наблюдались в случае кобальта и никеля, аргона и калия (см. «Редкие земли», стр. 620). В следующем разделе будет показано, что эти расхождения исчезают в свете самых последних предположений.
инертные газы по отношению к периодической таблице.Когда было обнаружено существование инертных газов, возник интересный вопрос об их месте в Периодической таблице. Как хорошо известно, эти газы оказались химически абсолютно инертными, что радикально отличается от всех других элементов, известных к тому времени. Следовательно, они не могли быть помещены ни в одну из известных групп. Однако, если разместить их в группе слева от Группы I (см. Рис.4), они показаны как естественный переход от элементов Группы VIII к элементам Группы I. редкоземельные элементы по отношению к периодической таблице.
Группа элементов, известная как «редкоземельные элементы», представляет чрезвычайно интересную проблему в отношении их расположения в системе классификации Менделеева.
Элементы этой группы и их соединения очень похожи друг на друга по химическим свойствам; фактически, их можно разделить только из-за незначительных различий в физических свойствах, таких как растворенные вещества.
Рис. 2. — Графическое изображение периодического изменения атомных объемов элементов в зависимости от их атомного веса.© 1916 НАУЧНЫЙ АМЕРИКАН, ИНК.
гибкость, температура плавления или цвет; так что выделение соли любого из членов группы является наиболее трудоемким процессом, предполагающим, вероятно, несколько тысяч перекристаллизаций.
К настоящему времени определенно установлено наличие следующих элементов:
Атомный вес.
Скандий Группа: Скандий 44,1
Иттрий 88,7
Церит Земли: лантан 139,0
Церий 140,25
Презеодимий 140,6
Неодим 144,3
Самарий 150,4
Европий .. 152,0
Иттербиевые Земли: Гадолиний 157.3
Тербий 159,2
Диспрозий 162,5
Эрбий 167,4
Тулий 168,5
иттербий 172,0
Лютеций 174,0
Что касается первых четырех из вышеперечисленных элементов, не было никаких сомнений в том, какое место они должны занимать в Периодической таблице. Когда в 1879 г. впервые был выделен скандий, он сразу же был признан элементом эка-бор, свойства которого предсказывал Менделей эфф. Положение иттрия и лантана в группе III как элементов, аналогичных алюминию и скандию, также не подвергалось сомнению.Поскольку церий образует оксид CeO. аналогичен SnO. и его соли напоминают соли олова и германия, одинаково хорошо известно, что этот элемент принадлежит к группе IV.
Но до настоящего времени оставался открытым вопрос о том, как следует расположить другие двенадцать элементов. Проф. Мейер предложил объединить их в группу III между лантаном и церием, подчеркнув тем самым сходство в химических свойствах различных элементов, составляющих эту группу.Это, однако, поставило бы лютеций с атомным весом 174 перед церием с атомным весом 140.
редкоземельные элементы по отношению к периодической таблице.
Группа элементов, известная как «редкоземельные элементы», представляет чрезвычайно интересную проблему в отношении их расположения в системе классификации Менделеева.
Элементы этой группы и их соединения очень похожи друг на друга по химическим свойствам; фактически, их можно разделить только из-за незначительных различий в физических свойствах, таких как растворенные вещества.
Рис. 2. — Графическое изображение периодического изменения атомных объемов элементов в зависимости от их атомного веса.© 1916 НАУЧНЫЙ АМЕРИКАН, ИНК.
гибкость, температура плавления или цвет; так что выделение соли любого из членов группы является наиболее трудоемким процессом, предполагающим, вероятно, несколько тысяч перекристаллизаций.
К настоящему времени определенно установлено наличие следующих элементов:
Атомный вес.
Скандий Группа: Скандий 44,1
Иттрий 88,7
Церит Земли: лантан 139,0
Церий 140,25
Презеодимий 140,6
Неодим 144,3
Самарий 150,4
Европий .. 152,0
Иттербиевые Земли: Гадолиний 157.3
Тербий 159,2
Диспрозий 162,5
Эрбий 167,4
Тулий 168,5
иттербий 172,0
Лютеций 174,0
Что касается первых четырех из вышеперечисленных элементов, не было никаких сомнений в том, какое место они должны занимать в Периодической таблице. Когда в 1879 г. впервые был выделен скандий, он сразу же был признан элементом эка-бор, свойства которого предсказывал Менделей эфф. Положение иттрия и лантана в группе III как элементов, аналогичных алюминию и скандию, также не подвергалось сомнению.Поскольку церий образует оксид CeO. аналогичен SnO. и его соли напоминают соли олова и германия, одинаково хорошо известно, что этот элемент принадлежит к группе IV.
Но до настоящего времени оставался открытым вопрос о том, как следует расположить другие двенадцать элементов. Проф. Мейер предложил объединить их в группу III между лантаном и церием, подчеркнув тем самым сходство в химических свойствах различных элементов, составляющих эту группу.Это, однако, поставило бы лютеций с атомным весом 174 перед церием с атомным весом 140. Ввиду более поздней работы Мозли по высокочастотным спектрам элементов, о которых будет упомянуто далее, автор предварительно расположил редкоземельные элементы, как показано на рис. 4. Таким образом, они приведены ниже. лантан и церий и до тантала.
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ.
Открытие радиоактивных элементов естественным образом привело к вопросу о том, какое отношение они имеют к другим элементам Периодической таблицы.Не могло быть никаких сомнений относительно положения таких элементов, как радий, торий и уран, которые можно было получить в достаточно больших количествах, чтобы определить их атомный вес и химические свойства, но до прошлого года было много спекуляций по поводу способ, которым должны быть расположены другие радиоактивные элементы, и только после огромного количества тщательных исследований и гениальных выводов со стороны блестящих физико-химиков, таких как Содди и Фаянс, вся ситуация была прояснена, и была создана новая эпоха Глава добавлена к истории Периодического закона.Во многом это связано с заключением, сделанным этими исследователями, о том, что настоящая статья особенно озабочена.
Как известно, радиоактивные элементы характеризуются большей или меньшей нестабильностью. После определенного среднего периода существования, который может варьироваться от более тысячи миллионов лет, как в случае с ураном (U), до миллионной доли сеонда, как в случае RaGu, атом самопроизвольно распадается и дает атом, который обладает совершенно разными свойствами. Распад обнаруживается по изгнанию либо альфа ‘, либо бета4-частиц.Вместе с выбросом бета-частиц в ряде случаев наблюдается также испускание гамма-лучей. Это электромагнитные импульсы чрезвычайно короткой длины волны (около 10 сантиметров), вероятно, вызванные бомбардировкой атомов самого радиоактивного вещества бета-частицами.
В результате большого объема тщательной работы, которая была проведена в течение последних нескольких лет по исследованию взаимосвязи между различными радиоактивными элементами и продуктами их превращения, был сделан вывод о существовании трех четко определенных серий распада, отправными точками которых являются: уран, торий и актиний соответственно.
Ввиду более поздней работы Мозли по высокочастотным спектрам элементов, о которых будет упомянуто далее, автор предварительно расположил редкоземельные элементы, как показано на рис. 4. Таким образом, они приведены ниже. лантан и церий и до тантала.
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ.
Открытие радиоактивных элементов естественным образом привело к вопросу о том, какое отношение они имеют к другим элементам Периодической таблицы.Не могло быть никаких сомнений относительно положения таких элементов, как радий, торий и уран, которые можно было получить в достаточно больших количествах, чтобы определить их атомный вес и химические свойства, но до прошлого года было много спекуляций по поводу способ, которым должны быть расположены другие радиоактивные элементы, и только после огромного количества тщательных исследований и гениальных выводов со стороны блестящих физико-химиков, таких как Содди и Фаянс, вся ситуация была прояснена, и была создана новая эпоха Глава добавлена к истории Периодического закона.Во многом это связано с заключением, сделанным этими исследователями, о том, что настоящая статья особенно озабочена.
Как известно, радиоактивные элементы характеризуются большей или меньшей нестабильностью. После определенного среднего периода существования, который может варьироваться от более тысячи миллионов лет, как в случае с ураном (U), до миллионной доли сеонда, как в случае RaGu, атом самопроизвольно распадается и дает атом, который обладает совершенно разными свойствами. Распад обнаруживается по изгнанию либо альфа ‘, либо бета4-частиц.Вместе с выбросом бета-частиц в ряде случаев наблюдается также испускание гамма-лучей. Это электромагнитные импульсы чрезвычайно короткой длины волны (около 10 сантиметров), вероятно, вызванные бомбардировкой атомов самого радиоактивного вещества бета-частицами.
В результате большого объема тщательной работы, которая была проведена в течение последних нескольких лет по исследованию взаимосвязи между различными радиоактивными элементами и продуктами их превращения, был сделан вывод о существовании трех четко определенных серий распада, отправными точками которых являются: уран, торий и актиний соответственно. На рис. 3 схематично показано, каким образом члены этой серии связаны между собой.
Когда мезоторий II распадается, он дает радиоторий, а поскольку бета-частица удаляется во время превращения, атомный вес не изменяется. Радиоторий химически связан с торием и неотделим от него. Эти факты позволяют сделать вывод, что радиоторий принадлежит к группе IV, а мезоторий II должен принадлежать к группе III.
Переходя к торию X, мы здесь снова приходим к элементу, который химически подобен радию, таким образом помещая его в Группу II.Атом тория X выталкивает альфа-частицу и дает эманацию тория, газа, который химически инертен и конденсируется при низких давлениях между -120 град. Cent. и –150 град. Cent. Таким образом, эманация напоминает инертные газы группы аргона.
Эманация тория является первым членом группы продуктов трансформации, составляющих «активный осадок» тория. На рис. 3 они обозначены как торий A, B, 0 ”0 и D.
Диаграммы, иллюстрирующие ряды этиния и урана, не требуют пояснений.В целом три серии очень похожи. Наиболее примечательной особенностью этих радиоактивных элементов является тот факт, что отдельные члены каждой серии кажутся химически неотличимыми от некоторых членов другой серии. Таким образом, торий B и радий B обладают идентичными химическими свойствами. Если бы не разница в сроках существования обоих веществ, их было бы невозможно различить.
ИЗОТОПЫ.
Содди первым обратил внимание на этот и аналогичные случаи радиоактивных элементов, которые химически идентичны, и, поскольку они должны занимать одно и то же место в Периодической таблице, он обозначил их изотопами.Таким образом, элементы уран X ”, ионий и радиоактиний являются изотопными. Аналогичный пример дают три эманации, а также радий и торий X. Замечательная особенность этих изотопов состоит в том, что, хотя они химически одинаковы, они различаются по атомному весу. Другими словами, здесь мы имеем дело с элементами, которые абсолютно неразделимы всеми химическими методами, разработанными до сих пор, и все же различаются в том отношении, которое до сих пор считалось наиболее важной характеристикой элемента — его атомным весом.
На рис. 3 схематично показано, каким образом члены этой серии связаны между собой.
Когда мезоторий II распадается, он дает радиоторий, а поскольку бета-частица удаляется во время превращения, атомный вес не изменяется. Радиоторий химически связан с торием и неотделим от него. Эти факты позволяют сделать вывод, что радиоторий принадлежит к группе IV, а мезоторий II должен принадлежать к группе III.
Переходя к торию X, мы здесь снова приходим к элементу, который химически подобен радию, таким образом помещая его в Группу II.Атом тория X выталкивает альфа-частицу и дает эманацию тория, газа, который химически инертен и конденсируется при низких давлениях между -120 град. Cent. и –150 град. Cent. Таким образом, эманация напоминает инертные газы группы аргона.
Эманация тория является первым членом группы продуктов трансформации, составляющих «активный осадок» тория. На рис. 3 они обозначены как торий A, B, 0 ”0 и D.
Диаграммы, иллюстрирующие ряды этиния и урана, не требуют пояснений.В целом три серии очень похожи. Наиболее примечательной особенностью этих радиоактивных элементов является тот факт, что отдельные члены каждой серии кажутся химически неотличимыми от некоторых членов другой серии. Таким образом, торий B и радий B обладают идентичными химическими свойствами. Если бы не разница в сроках существования обоих веществ, их было бы невозможно различить.
ИЗОТОПЫ.
Содди первым обратил внимание на этот и аналогичные случаи радиоактивных элементов, которые химически идентичны, и, поскольку они должны занимать одно и то же место в Периодической таблице, он обозначил их изотопами.Таким образом, элементы уран X ”, ионий и радиоактиний являются изотопными. Аналогичный пример дают три эманации, а также радий и торий X. Замечательная особенность этих изотопов состоит в том, что, хотя они химически одинаковы, они различаются по атомному весу. Другими словами, здесь мы имеем дело с элементами, которые абсолютно неразделимы всеми химическими методами, разработанными до сих пор, и все же различаются в том отношении, которое до сих пор считалось наиболее важной характеристикой элемента — его атомным весом. ЗАКОН ПОСЛЕДОВАТЕЛЬНОСТИ ИЗМЕНЕНИЙ СОДДИ.
Всестороннее исследование химических свойств различных радиоактивных элементов привело Содди и Фаянс независимо к интересному и чрезвычайно важному исследованию.
важное обобщение, которое позволяет им отнести эти изотопы к их местам в Периодической таблице.
Напомним, что альфа-частица — это атом гелия с двумя положительными зарядами. Следовательно, изгнанием атом должен потерять два положительных заряда, и атомный вес должен уменьшиться на четыре единицы.Точно так же изгнание бета-частицы означает потерю отрицательного заряда или, что эквивалентно, усиление одного положительного заряда; а поскольку масса бета-частицы чрезвычайно мала по сравнению с массой атома, атомный вес практически не уменьшается. Теперь в Периодической таблице валентность кислорода, электроотрицательного элемента, регулярно увеличивается по мере перехода от группы 0 к группе VIII, в то время как валентность водорода, электро-положительного элемента, уменьшается, т.е. е., электроположительная характеристика увеличивается на одну единицу при каждом изменении номера группы при прохождении в любой серии слева направо.Кроме того, в каждой группе электроположительный характер регулярно увеличивается с увеличением атомного веса.
Эти соображения привели Содди и Фаянса к такому выводу:
Изгнание альфа-частицы из любого радиоактивного элемента приводит к элементу, который находится на две позиции ниже в Периодической таблице (и имеет атомный вес, который на четыре единицы меньше), в то время как испускание бета-частицы приводит к элементу, который находится на одну позицию. выше, но имеет тот же атомный вес.
Следовательно, возможно иметь элементы с одинаковым атомным весом, но обладающие явно разными химическими свойствами, и, с другой стороны, поскольку эффект излучения одной альфа-частицы может быть нейтрализован последующим испусканием двух бета-частиц. , возможно наличие двух элементов, которые различаются по атомной массе на четыре единицы (или кратно четырем), но при этом обладают сходными химическими свойствами.
ЗАКОН ПОСЛЕДОВАТЕЛЬНОСТИ ИЗМЕНЕНИЙ СОДДИ.
Всестороннее исследование химических свойств различных радиоактивных элементов привело Содди и Фаянс независимо к интересному и чрезвычайно важному исследованию.
важное обобщение, которое позволяет им отнести эти изотопы к их местам в Периодической таблице.
Напомним, что альфа-частица — это атом гелия с двумя положительными зарядами. Следовательно, изгнанием атом должен потерять два положительных заряда, и атомный вес должен уменьшиться на четыре единицы.Точно так же изгнание бета-частицы означает потерю отрицательного заряда или, что эквивалентно, усиление одного положительного заряда; а поскольку масса бета-частицы чрезвычайно мала по сравнению с массой атома, атомный вес практически не уменьшается. Теперь в Периодической таблице валентность кислорода, электроотрицательного элемента, регулярно увеличивается по мере перехода от группы 0 к группе VIII, в то время как валентность водорода, электро-положительного элемента, уменьшается, т.е. е., электроположительная характеристика увеличивается на одну единицу при каждом изменении номера группы при прохождении в любой серии слева направо.Кроме того, в каждой группе электроположительный характер регулярно увеличивается с увеличением атомного веса.
Эти соображения привели Содди и Фаянса к такому выводу:
Изгнание альфа-частицы из любого радиоактивного элемента приводит к элементу, который находится на две позиции ниже в Периодической таблице (и имеет атомный вес, который на четыре единицы меньше), в то время как испускание бета-частицы приводит к элементу, который находится на одну позицию. выше, но имеет тот же атомный вес.
Следовательно, возможно иметь элементы с одинаковым атомным весом, но обладающие явно разными химическими свойствами, и, с другой стороны, поскольку эффект излучения одной альфа-частицы может быть нейтрализован последующим испусканием двух бета-частиц. , возможно наличие двух элементов, которые различаются по атомной массе на четыре единицы (или кратно четырем), но при этом обладают сходными химическими свойствами. В качестве иллюстрации рассмотрим урановую серию. Уран I относится к VI группе. Изгнанием альфа-частицы мы получаем уран! » элемент IV группы. Этот атом, в свою очередь, распадается с выбросом бета-частицы. Следовательно, уран X2 должен. принадлежат к Группе V. Таким образом мы можем проследить отдельные изменения, которые приводят к различным членам ряда, и посредством обобщения Содди и Фаянса мы не только можем назначить каждому элементу его место в Периодической таблице, но также и его атомный вес, как это сделано на рис.3.
Это обобщение оказало материальную помощь в прояснении некоторых трудных проблем при изучении рядов дезинтеграции. Более того, это привело к чрезвычайно интересному выводу, что конечным продуктом каждой из трех радиоактивных серий является изотоп свинца. Результаты самой последней работы по атомному весу свинца прекрасно согласуются с этим выводом, поскольку было обнаружено, что свинец радиоактивного происхождения имеет несколько меньший атомный вес, чем обычный свинец.’
В нескольких случаях изотоп не был определенно изолирован, но вряд ли можно сомневаться в его существовании. Таким образом, продукт распада радия C2 должен быть элементом группы IV, но доказательства его существования очень скудны.
ЯДЕРНАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА.
Все эти выводы согласуются с интересной теорией атомной структуры, которая была впервые выдвинута Резерфордом и развита Бором, Мозли и Дарвином. Поскольку эта теория подробно обсуждалась в связи с другой серией статей8, мы ограничимся здесь несколькими замечаниями по ее основным моментам.Короче говоря, эта теория предполагает, что атом состоит из положительно заряженного ядра, окруженного системой электронов, которые удерживаются вместе силами притяжения ядра. «Предполагается, что это ядро является вместилищем основной части массы атома, и его линейные размеры чрезвычайно малы по сравнению с линейными размерами всего атома».
Согласно Бору, экспериментальные данные подтверждают гипотезу о том, что ядерный заряд любого элемента соответствует положению этого элемента в ряду возрастающих атомных весов.
В качестве иллюстрации рассмотрим урановую серию. Уран I относится к VI группе. Изгнанием альфа-частицы мы получаем уран! » элемент IV группы. Этот атом, в свою очередь, распадается с выбросом бета-частицы. Следовательно, уран X2 должен. принадлежат к Группе V. Таким образом мы можем проследить отдельные изменения, которые приводят к различным членам ряда, и посредством обобщения Содди и Фаянса мы не только можем назначить каждому элементу его место в Периодической таблице, но также и его атомный вес, как это сделано на рис.3.
Это обобщение оказало материальную помощь в прояснении некоторых трудных проблем при изучении рядов дезинтеграции. Более того, это привело к чрезвычайно интересному выводу, что конечным продуктом каждой из трех радиоактивных серий является изотоп свинца. Результаты самой последней работы по атомному весу свинца прекрасно согласуются с этим выводом, поскольку было обнаружено, что свинец радиоактивного происхождения имеет несколько меньший атомный вес, чем обычный свинец.’
В нескольких случаях изотоп не был определенно изолирован, но вряд ли можно сомневаться в его существовании. Таким образом, продукт распада радия C2 должен быть элементом группы IV, но доказательства его существования очень скудны.
ЯДЕРНАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА.
Все эти выводы согласуются с интересной теорией атомной структуры, которая была впервые выдвинута Резерфордом и развита Бором, Мозли и Дарвином. Поскольку эта теория подробно обсуждалась в связи с другой серией статей8, мы ограничимся здесь несколькими замечаниями по ее основным моментам.Короче говоря, эта теория предполагает, что атом состоит из положительно заряженного ядра, окруженного системой электронов, которые удерживаются вместе силами притяжения ядра. «Предполагается, что это ядро является вместилищем основной части массы атома, и его линейные размеры чрезвычайно малы по сравнению с линейными размерами всего атома».
Согласно Бору, экспериментальные данные подтверждают гипотезу о том, что ядерный заряд любого элемента соответствует положению этого элемента в ряду возрастающих атомных весов. Химические свойства атома зависят от величины этого ядерного заряда; поскольку, однако, любое заданное количество электронов может принимать разные конфигурации, возможно существование двух или более элементов, имеющих одинаковый ядерный заряд, но разный атомный вес. Другими словами, возможное существование изотопов выводится из предположений Резерфорда и Бора.
Таким образом, атомный вес играет роль второстепенной характеристики; Важным свойством любого элемента является его ядерный заряд, так что, располагая элементы в порядке увеличения ядерного заряда, мы должны получить гораздо лучшее приближение к периодическому
© 1916 НАУЧНЫЙ АМЕРИКАН, ИНК.
46
НАУЧНЫЕ АМЕРИКАНСКИЕ ДОБАВКИ 2089
15 января 1916 г.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕФА
Содержащие атомные массы, атомные нурберы и изотопные радиоактивные элементы
Группа 0
Группа 1 EitO
Группа 2 EO
Группа 3 E2O3
Группа 4
EOa Eh5
Группы
EzOa EHa
6 группа
EOa Eh3
Группа 7
E20y EH
Группа 8 EO4
Он
С.99
(S)
ЧАС:
Ли
6. ”
(S) ‘
Зверь;
9.1
(4)
11.00
(5).
12.00
N
mSfU1
о
16.00
(8)
19.0
(9)
Nei
Ar
33,88
(18)
(10)
Na
23.00
(11)
39. 1O
(19)
Mg
24. ”
(НАС)
A1 21,1
(18)
Si 28.1
(14)
31.04
(15)
32,07
(16)
Cl
36,46
(17)
Ca
40,07
(эо).
Sc
44,1
(11) ‘
Ti
IB.l
(22).
61,0
(«S)
Cr
62.0.
(Я.)
Mn
. »93
««
Fe Co Ni
66,84 118,97 88,68
(«?) (SS).
Kr
82,92
(38)
Cu
63,67
(S9)
Zn,
68,37
(ТАК,)
Ga
69,9
(81)
Ge
72,8
(82)
В виде
74,96
(88)
Se
79,2
(S4)
Br
79,92
(35)
Руб.
86,4 8
(37)
Sr
87,63
(88)
Yt
69,0
(SS)
Zr
90: 6
(40)
CBT
93.6
(41)
Пн
96,0
(48)
Ru Rh Pd
101,7 л 9 106,7
(44) ‘(45) (48)
Xe
180,2
(04)
Ag
107,88
(47)
CD
112,40
(48)
В
114,8
(49)
Sn
119,0
(60)
Sb
120,1
(61)
Te ‘
127,8
(5 «)
126,92
(6S)
CS
132,81
(55)
Ба
137,37
(58)
Ла
139,0
(67)
Ce
14O.2S
(68)
Рис ..— Подготовлено научно-исследовательской лабораторией компании General Electric.
(4 »
расположение элементов. Так получилось, что в большинстве случаев порядок увеличения атомного веса совпадает с порядком увеличения атомного номера (заряда ядра), но это не обязательно.так во всех случаях.
Химические свойства атома зависят от величины этого ядерного заряда; поскольку, однако, любое заданное количество электронов может принимать разные конфигурации, возможно существование двух или более элементов, имеющих одинаковый ядерный заряд, но разный атомный вес. Другими словами, возможное существование изотопов выводится из предположений Резерфорда и Бора.
Таким образом, атомный вес играет роль второстепенной характеристики; Важным свойством любого элемента является его ядерный заряд, так что, располагая элементы в порядке увеличения ядерного заряда, мы должны получить гораздо лучшее приближение к периодическому
© 1916 НАУЧНЫЙ АМЕРИКАН, ИНК.
46
НАУЧНЫЕ АМЕРИКАНСКИЕ ДОБАВКИ 2089
15 января 1916 г.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕФА
Содержащие атомные массы, атомные нурберы и изотопные радиоактивные элементы
Группа 0
Группа 1 EitO
Группа 2 EO
Группа 3 E2O3
Группа 4
EOa Eh5
Группы
EzOa EHa
6 группа
EOa Eh3
Группа 7
E20y EH
Группа 8 EO4
Он
С.99
(S)
ЧАС:
Ли
6. ”
(S) ‘
Зверь;
9.1
(4)
11.00
(5).
12.00
N
mSfU1
о
16.00
(8)
19.0
(9)
Nei
Ar
33,88
(18)
(10)
Na
23.00
(11)
39. 1O
(19)
Mg
24. ”
(НАС)
A1 21,1
(18)
Si 28.1
(14)
31.04
(15)
32,07
(16)
Cl
36,46
(17)
Ca
40,07
(эо).
Sc
44,1
(11) ‘
Ti
IB.l
(22).
61,0
(«S)
Cr
62.0.
(Я.)
Mn
. »93
««
Fe Co Ni
66,84 118,97 88,68
(«?) (SS).
Kr
82,92
(38)
Cu
63,67
(S9)
Zn,
68,37
(ТАК,)
Ga
69,9
(81)
Ge
72,8
(82)
В виде
74,96
(88)
Se
79,2
(S4)
Br
79,92
(35)
Руб.
86,4 8
(37)
Sr
87,63
(88)
Yt
69,0
(SS)
Zr
90: 6
(40)
CBT
93.6
(41)
Пн
96,0
(48)
Ru Rh Pd
101,7 л 9 106,7
(44) ‘(45) (48)
Xe
180,2
(04)
Ag
107,88
(47)
CD
112,40
(48)
В
114,8
(49)
Sn
119,0
(60)
Sb
120,1
(61)
Te ‘
127,8
(5 «)
126,92
(6S)
CS
132,81
(55)
Ба
137,37
(58)
Ла
139,0
(67)
Ce
14O.2S
(68)
Рис ..— Подготовлено научно-исследовательской лабораторией компании General Electric.
(4 »
расположение элементов. Так получилось, что в большинстве случаев порядок увеличения атомного веса совпадает с порядком увеличения атомного номера (заряда ядра), но это не обязательно.так во всех случаях. —
СПЕКТРЫ ВЫСОКОЙ ЧАСТОТНОСТИ ЭЛЕМЕНТОВ.
Бор показал, что должна существовать «определенная связь» между зарядом ядра и частотой характерного рентгеновского излучения, испускаемого веществом. Поэтому Мозли «измерил длины волн характеристических рентгеновских лучей, излучаемых различными элементами, когда они« были »сделаны антикатодами в рентгеновской трубке, и определил таким образом атомные номера все]! элементы frbm aluminium, 13, 00 gold, 79.Похоже, что в этом диапазоне «есть только» три элемента, которые не были обнаружены химиком.
«ПЕРИОДИЧЕСКАЯ ТАБЛИЦА В НАЛИЧИИ.
Пересмотренная «форма периодической таблицы Менделеева», которая была составлена на рис. 4, представляет собой попытку воплотить самые последние результаты различных направлений «исследований, которые обсуждались здесь. Под каждым элементом указан атомный вес и порядковый номер (в скобках). Однако в этой связи необходимо сделать несколько замечаний о различных элементах этой таблицы.НЕОН И МЕТА-НЕОН. НЕБУЛИЙ.
Доказательства существования «двух изотопов» неона недавно были получены профессором Дж. Дж. Томсоном и
Астон. Путем тщательных экспериментов по диффузии последний смог отделить от неона другой газ с атомной массой 22%. который получил название мета-неон. Эти два газа различаются только своими гравитационными • свойствами, но идентичны химически и спектроскопически.
В течение последнего года были получены спектроскопические доказательства существования нового элемента netraliti, имеющего атомный вес около 3.Этот элемент встречается в спектре туманности Ориона. однако, вероятно, слишком рано пытаться размышлять о его месте в Периодической таблице. Есть ряд элементов, таких как туманность, наличие которых у нас есть. только спектроскопическое свидетельство, и может быть, как было недавно предложено, что это протоэлементы, из которых построены наши земные элементы.
РЕДКИЕ ЗЕМЛИ
Случай редкоземельных элементов уже обсуждался в предыдущем разделе. Схема, показанная на рис.4 соответствует атомным номерам, определенным Мозли для следующих элементов: лантана, церия, пресеодима, неодимия, самария, европия, гадолиния и гольмия.
—
СПЕКТРЫ ВЫСОКОЙ ЧАСТОТНОСТИ ЭЛЕМЕНТОВ.
Бор показал, что должна существовать «определенная связь» между зарядом ядра и частотой характерного рентгеновского излучения, испускаемого веществом. Поэтому Мозли «измерил длины волн характеристических рентгеновских лучей, излучаемых различными элементами, когда они« были »сделаны антикатодами в рентгеновской трубке, и определил таким образом атомные номера все]! элементы frbm aluminium, 13, 00 gold, 79.Похоже, что в этом диапазоне «есть только» три элемента, которые не были обнаружены химиком.
«ПЕРИОДИЧЕСКАЯ ТАБЛИЦА В НАЛИЧИИ.
Пересмотренная «форма периодической таблицы Менделеева», которая была составлена на рис. 4, представляет собой попытку воплотить самые последние результаты различных направлений «исследований, которые обсуждались здесь. Под каждым элементом указан атомный вес и порядковый номер (в скобках). Однако в этой связи необходимо сделать несколько замечаний о различных элементах этой таблицы.НЕОН И МЕТА-НЕОН. НЕБУЛИЙ.
Доказательства существования «двух изотопов» неона недавно были получены профессором Дж. Дж. Томсоном и
Астон. Путем тщательных экспериментов по диффузии последний смог отделить от неона другой газ с атомной массой 22%. который получил название мета-неон. Эти два газа различаются только своими гравитационными • свойствами, но идентичны химически и спектроскопически.
В течение последнего года были получены спектроскопические доказательства существования нового элемента netraliti, имеющего атомный вес около 3.Этот элемент встречается в спектре туманности Ориона. однако, вероятно, слишком рано пытаться размышлять о его месте в Периодической таблице. Есть ряд элементов, таких как туманность, наличие которых у нас есть. только спектроскопическое свидетельство, и может быть, как было недавно предложено, что это протоэлементы, из которых построены наши земные элементы.
РЕДКИЕ ЗЕМЛИ
Случай редкоземельных элементов уже обсуждался в предыдущем разделе. Схема, показанная на рис.4 соответствует атомным номерам, определенным Мозли для следующих элементов: лантана, церия, пресеодима, неодимия, самария, европия, гадолиния и гольмия. Порядок атомных номеров в случае дизопрозия и гольмия очевидно обратное атомному весу. Но в этом случае, как и в случае теллура, йода; кобальт, никель; и аргон, калий, больше не кажется аномальным, когда элементы
расположены в порядке увеличения атомного номера, а не в порядке увеличения атомного веса; Атомный вес неойттербия был определен в течение прошлого года; «Однако в настоящее время невозможно утверждать, какое отношение он имеет к« другим »элементам группы редкоземельных элементов.РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ.
Радиоактивные элементы расположены в группы изотопов, а атомные номера основаны на порядке различных элементов в серии распада (см. Рис. 3), предполагая, что атомный номер свинца равен 82.
Атомный вес актиния и продуктов его распада не определен. Поэтому мы приняли значение, предложенное Фаджансом, которое составляет около 227. Все, что мы можем сказать определенно, — это то, что атомный вес больше, чем у радия, и значительно меньше, чем у тория.Атомные веса урана и радия основаны на следующих соображениях: во-первых, поскольку радий получается из урана путем выброса трех альфа-частиц, атомные веса должны отличаться на 3 х 3,99 единиц. — Во-вторых, согласно самый последний доклад Международного комитета по атомным весам — там просачивается! быть вескими причинами для принятия — значения ‘, которое очень близко к 238,2 для атомной массы урана. Фактическое значение, полученное Хёнигшмидом (Z. Elect. 20, 452, 1914), варьировалось от 238; W.: до 238,18; но комитет считает последнее значение более точным. Определение атомного веса радия дало результаты, варьирующиеся от 225,9 до 226,4, и последнее является значением, приведенным в Таблице атомных весов, выпущенной Интернационалом. Комитет на текущий год. Однако в wiew 0f. Из приведенных выше соображений мы использовали значение 226,2. ‘
Номенклатура радиоактивных элементов основана на номенклатуре Soddy !, когда они были изолированы, там было ,.конечно нет определенных знаний относительно их отношений и того. Поэтому результат был довольно запутанным .
Порядок атомных номеров в случае дизопрозия и гольмия очевидно обратное атомному весу. Но в этом случае, как и в случае теллура, йода; кобальт, никель; и аргон, калий, больше не кажется аномальным, когда элементы
расположены в порядке увеличения атомного номера, а не в порядке увеличения атомного веса; Атомный вес неойттербия был определен в течение прошлого года; «Однако в настоящее время невозможно утверждать, какое отношение он имеет к« другим »элементам группы редкоземельных элементов.РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ.
Радиоактивные элементы расположены в группы изотопов, а атомные номера основаны на порядке различных элементов в серии распада (см. Рис. 3), предполагая, что атомный номер свинца равен 82.
Атомный вес актиния и продуктов его распада не определен. Поэтому мы приняли значение, предложенное Фаджансом, которое составляет около 227. Все, что мы можем сказать определенно, — это то, что атомный вес больше, чем у радия, и значительно меньше, чем у тория.Атомные веса урана и радия основаны на следующих соображениях: во-первых, поскольку радий получается из урана путем выброса трех альфа-частиц, атомные веса должны отличаться на 3 х 3,99 единиц. — Во-вторых, согласно самый последний доклад Международного комитета по атомным весам — там просачивается! быть вескими причинами для принятия — значения ‘, которое очень близко к 238,2 для атомной массы урана. Фактическое значение, полученное Хёнигшмидом (Z. Elect. 20, 452, 1914), варьировалось от 238; W.: до 238,18; но комитет считает последнее значение более точным. Определение атомного веса радия дало результаты, варьирующиеся от 225,9 до 226,4, и последнее является значением, приведенным в Таблице атомных весов, выпущенной Интернационалом. Комитет на текущий год. Однако в wiew 0f. Из приведенных выше соображений мы использовали значение 226,2. ‘
Номенклатура радиоактивных элементов основана на номенклатуре Soddy !, когда они были изолированы, там было ,.конечно нет определенных знаний относительно их отношений и того. Поэтому результат был довольно запутанным . .. Таким образом, название полоний было применено к RaF, в то время как UX21 также известен как brevium. Обозначение «нитон» для эманации радия стало довольно хорошо известно. Однако было сочтено целесообразным использовать те названия, которые лучше всего передают взаимосвязь различных элементов, и была предпринята попытка осуществить этот план при составлении таблиц. изотопы.
ВЫВОДЫ.
Принимая во внимание отношения, демонстрируемые различными радиоактивными веществами.элементов, понимаешь, что мечта алхимиков, возможно, не была такой бессмысленной, как казалось до недавнего времени. Идея абсолютно стабильного атома должна быть отброшена раз и навсегда, и ее место займет эта миниатюрная солнечная система, так сказать, состоящая из центрального ядра и одного или нескольких колец электронов. Но само ядро, по-видимому, является средоточием огненных сил, несмотря на их огромные масштабы. бесконечно малых размеров он содержит как альфа-частицы, так и электроны. Время от времени ядро одного из атомов спонтанно распадается и изгоняет a.n альфа- или бета-частица. Родился новый элемент. Что вызывает эти преобразования? Они могут. быть под контролем? Это вопросы, на которые может дать ответ только будущее. Но если бы в наших силах удалить две альфа-частицы из атома висмута или любого из его изотопов, мечта алхимиков не только осуществилась бы, но и стал бы обладателем человека. такие чрезвычайно мощные источники энергии, что все наши угольные шахты, гидроэнергетика и взрывчатые вещества станут незначительными по сравнению с ними.РЕКОМЕНДАЦИИ.
1. Паттисон Мьюир — История химических теорий и законов,
2. Ф. Содди — Химия радиоэлементов, части I и II.
3. K. Fajans — Naturwissenschaften, Vol. II, 429, 462 (1914).
.. Таким образом, название полоний было применено к RaF, в то время как UX21 также известен как brevium. Обозначение «нитон» для эманации радия стало довольно хорошо известно. Однако было сочтено целесообразным использовать те названия, которые лучше всего передают взаимосвязь различных элементов, и была предпринята попытка осуществить этот план при составлении таблиц. изотопы.
ВЫВОДЫ.
Принимая во внимание отношения, демонстрируемые различными радиоактивными веществами.элементов, понимаешь, что мечта алхимиков, возможно, не была такой бессмысленной, как казалось до недавнего времени. Идея абсолютно стабильного атома должна быть отброшена раз и навсегда, и ее место займет эта миниатюрная солнечная система, так сказать, состоящая из центрального ядра и одного или нескольких колец электронов. Но само ядро, по-видимому, является средоточием огненных сил, несмотря на их огромные масштабы. бесконечно малых размеров он содержит как альфа-частицы, так и электроны. Время от времени ядро одного из атомов спонтанно распадается и изгоняет a.n альфа- или бета-частица. Родился новый элемент. Что вызывает эти преобразования? Они могут. быть под контролем? Это вопросы, на которые может дать ответ только будущее. Но если бы в наших силах удалить две альфа-частицы из атома висмута или любого из его изотопов, мечта алхимиков не только осуществилась бы, но и стал бы обладателем человека. такие чрезвычайно мощные источники энергии, что все наши угольные шахты, гидроэнергетика и взрывчатые вещества станут незначительными по сравнению с ними.РЕКОМЕНДАЦИИ.
1. Паттисон Мьюир — История химических теорий и законов,
2. Ф. Содди — Химия радиоэлементов, части I и II.
3. K. Fajans — Naturwissenschaften, Vol. II, 429, 462 (1914).
 В химии, имея больше информации об электронной конфигурации элементов, можно наблюдать сходство в конфигурации валентных электронов для определенной группы.Электронную конфигурацию атома можно записать с позиции в периодической таблице. Повторяющийся узор в электронных конфигурациях элементов периодической таблицы объясняет многие тенденции в свойствах по периодам или по столбцам, включая атомные радиусы, ионные радиусы, энергии первой ионизации, электроотрицательность и то, является ли элемент твердым телом или газом при комнатной температуре. Дополнительная энергия ионизации, сродство к электрону и периодические свойства переходных элементов, рядов лантаноидов и актинидов зарезервированы для более глубокого изучения.
В химии, имея больше информации об электронной конфигурации элементов, можно наблюдать сходство в конфигурации валентных электронов для определенной группы.Электронную конфигурацию атома можно записать с позиции в периодической таблице. Повторяющийся узор в электронных конфигурациях элементов периодической таблицы объясняет многие тенденции в свойствах по периодам или по столбцам, включая атомные радиусы, ионные радиусы, энергии первой ионизации, электроотрицательность и то, является ли элемент твердым телом или газом при комнатной температуре. Дополнительная энергия ионизации, сродство к электрону и периодические свойства переходных элементов, рядов лантаноидов и актинидов зарезервированы для более глубокого изучения.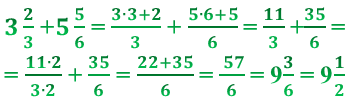
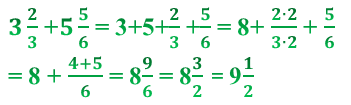







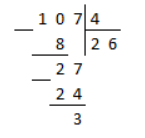
 После деления столбиком у нас появились неполное частное, его записываем в целую часть дроби. Остаток записываем в числитель, а делитель записываем в знаменатель.
После деления столбиком у нас появились неполное частное, его записываем в целую часть дроби. Остаток записываем в числитель, а делитель записываем в знаменатель. Получили смешанную дробь \(15\frac{1}{5}\)
Получили смешанную дробь \(15\frac{1}{5}\)